相关试卷
-
1、下列离子方程式正确的是( )A、过氧化钠与水反应: B、舍勒制备 C、氯气的尾气处理: D、向饱和的碳酸钠通入
-
2、设为阿伏加德罗常数,下列说法正确的是( )A、在标准状况下的含有电子的数目为 B、在标准状况下,含有分子数为 C、的含有的的数目为 D、的含有的原子个数为
-
3、将的下列物质完全燃烧,将燃烧的产物完全通入到足量的中,增重等于的是( )
①和 ② ③ ④ ⑤
A、②③④ B、①⑤ C、②⑤ D、①③ -
4、下列关于和说法正确的是( )A、和都是黑色固体 B、中和价铁的比例为 C、铁与水蒸气反应生产 D、又称为磁性氧化铁
-
5、下列关于新制氯水说法不正确的是( )A、取新制的氯水置于试管,加入盐酸酸化,再加入硝酸银,产生白色沉淀,证明新制氯水中含有 B、新制的氯水中加入紫色石蕊,溶液先变红后褪色,说明新制氯水中含有 C、新制的氯水呈现淡黄绿色,说明氯水中含有氯气分子 D、新制氯水需要放在棕色细口瓶中保存的原因是次氯酸见光易分解
-
6、小明同学用洁净的铂丝蘸取某无色溶液在酒精灯外焰上灼烧,火焰呈黄色.通过该实验现象,下列四位同学对该溶液中存在的金属离子判断正确的是( )A、
 B、
B、 .
C、
.
C、 D、
D、
-
7、下列有关和说法不正确的是( )A、的热稳定性比要强 B、碳酸氢钠可作食品膨松剂 C、俗称小苏打,可用于治疗胃酸过多 D、的溶解性大于
-
8、下列离子既有氧化性又用还原性的是( )A、 B、 C、 D、
-
9、下列物质的性质与用途具有对应关系的是( )A、盐酸有挥发性,可用于除铁锈 B、具有强氧化性,可用作漂白剂 C、能溶于水,可用于工业制盐酸 D、显碱性,可用作干燥剂
-
10、下列离子能大量共存的是( )A、使无色酚酞试液呈红色的溶液中: B、无色澄清透明的溶液中: C、在含大量的溶液中: D、使石蕊试液变红的溶液中:
-
11、下列有关物质的分类正确的是( )A、石墨、铜在常温下都能导电所以它们都是电解质 B、氯化钠属于盐,溶于水在电流的作用下电离出和 C、碱式碳酸铜属于盐 D、碳酸钠的水溶液在常温下的约为11.6,碳酸钠属于碱
-
12、下列不属于同素异形体的是( )A、红磷和白磷 B、金刚石和 C、氧气和臭氧 D、和
-
13、我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为)恢复了磁性,下列关于“钴酞菁”分子的说法正确的是( )A、其在水中形成的分散系属于溶液 B、其在水中形成的分散系能产生丁达尔效应 C、“钴酞菁”分子直径比H+的直径小 D、“钴酞菁”分子不能透过滤纸
-
14、某废旧金属材料中主要含Fe、Cu、Al、、FeO、、CuO和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Cu、Al、绿矾等。回答下列问题:

【已知:焙烧主要除去可燃性有机物】
(1)、灼烧需要的主要仪器有。操作Ⅲ的名称是。(2)、操作Ⅰ、Ⅱ中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是。(3)、碱浸时发生反应的化学方程式为、(4)、滤液Ⅰ与试剂b发生反应的化学方程式为。(5)、制取的绿矾在空气中容易被部分氧化。现取被部分氧化的绿矾晶体8.22g溶于稀盐酸后,加入足量的溶液,过滤得沉淀9.32g;再通入112mL(标准状况)氯气恰好将其中的完全氧化。推测晶体中。 -
15、铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。(1)、Ⅰ.某学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验。
实验①
实验②


请回答下列问题:
实验①中湿棉花、肥皂液作用分别是、;实验①中能观察到肥皂液中持续产生肥皂泡,当用燃烧着火柴靠近肥皂泡时,气泡破裂,气体燃烧,火焰呈黄色,并发出轻微的爆鸣声。解释火焰呈黄色的原因;实验①中反应的化学方程式是。(2)、实验②前,甲同学对其反应及现象进行预测:向反应后固体加入稀硫酸发生反应的离子方程式;实验②中溶液B呈现色,其中发生反应的离子方程式。(3)、实验②中,乙同学观察到溶液B未呈现红色,则溶液B未呈现红色的原因(用离子方程式表示)。检验B溶液中金属离子的方法。(4)、Ⅱ.我国具有5000年文化,文物是活的历史。某博物馆修复出土铁器包括:检测锈蚀产物→分析腐蚀原理→脱氯→形成保护层等过程。
锈蚀产物的主要成分为、、、、FeOCl。研究发现,出土文物保护层被氧化为而引起腐蚀的。中铁的化合价为。(5)、利用在NaOH溶液中,溶解度FeOCl大于 , 对固体FeOCl进行脱氯,离子方程式为(6)、用把脱氯产物还原为 , 生成1mol 需要mol 。 -
16、为了防控疫情,家居、学校等公共场所都要定时进行消毒。(1)、Ⅰ.工业上使用氯气与氢氧化钠反应制取“84消毒液”
写出“84消毒液”中的有效成分。(2)、“84消毒液”使用时应按比例稀释,放置20~30min,放置过程中有生成碳酸氢钠,该反应的离子方程式为。(3)、Ⅱ.“消毒液”中氯元素的存在形态与溶液的pH关系如表:
写出pH降低时产生氯气的离子方程式。溶液pH >9 5~6 4~5 2~3 <2 主要成分 NaClO HCl与NaClO(少量) HCl与(少量) HClO与 (4)、Ⅲ.同学猜测“84消毒液”(以下简称“84”)可漂白米醋【米醋是一种用稻谷酿制的食用醋,含少量醋酸(),因含有有机色素而成棕色】,进行了如下实验:
实验二的目的是:编号 实验一 实验二 实验操作 

实验现象 滴入米醋后立即褪色,闻到刺激性气味 溶液为浅棕色,无刺激性气味 ①排除米醋因为挥发产生刺激性气味气体的可能;
②。
(5)、结合反应的方程式,解释实验一立即褪色的原因。(6)、若用氯气做如图1的实验,向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加NaOH溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法正确的是____。
图1 图2
A、阶段①说明氯气溶于水,溶于水的氯气全部与水反应 B、阶段②的压强变小,该过程发生了氧化还原反应 C、阶段③的压强变大,该过程是NaClO分解产生的原因 D、若将换成 , 所得的压强变化趋势与图2相似(7)、若将一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00 NaOH溶液恰好完全吸收,测得溶液中NaClO的物质的量浓度为0.6(忽略溶液体积的变化),则:①所得溶液中的物质的量浓度为;
②氯气和参加反应的氢气的物质的量之比为。
-
17、(1)、Ⅰ.可供选择的药品有:胆矾()、浓硫酸(质量分数为98%、密度为1.80);可供选择的仪器有:玻璃棒、烧杯、电子天平、药匙、量筒、胶头滴管。
实验任务:
实验Ⅰ:配制100mL 0.1 溶液;
实验Ⅱ:配制480mL 0.18
溶液回答下列问题:
完成实验Ⅱ,除上述可选仪器外,还缺少的仪器是。(2)、实验过程中,需称取胆矾g,需量取浓硫酸mL。(3)、将图中的实验步骤A~F按实验过程先后顺序排列。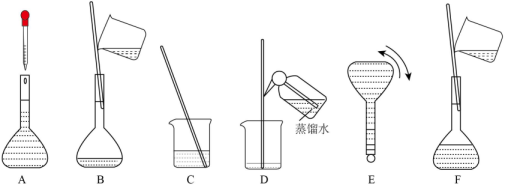 (4)、对所配制的、溶液进行测定,发现浓度均偏大,可能的原因是。
(4)、对所配制的、溶液进行测定,发现浓度均偏大,可能的原因是。a.量取浓硫酸时俯视读数;
b.溶解浓硫酸时放热,未冷却就转移至容量瓶并定容;
c.称量的固体已经部分失去结晶水;
d.称量的固体中含有杂质;
e.称量固体时,砝码与物质位置颠倒
(5)、Ⅱ.铝镁合金已成为飞机制造、化工生产等行业的重要材料.某研究性学习小组的同学,为测定某铝镁合金(不含其他元素)中镁的质量分数,请你完成下列实验方案。方案一:将一定质量的镁铝合金与足量稀硫酸反应,测定生成气体的体积。拟选用下列实验装置完成实验:
你认为最简易的装置其连接顺序是: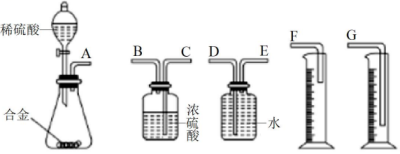
A接接接。(填接口字母,可不填满)
(6)、请同学们自主设计方案二:。 -
18、离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知、、的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的 , 溶液导电能力随通入量的变化趋势正确的是( )A、
 B、
B、 C、
C、 D、
D、
-
19、在由Fe、FeO和组成的混合物中加入100mL 2的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无 , 则下列判断正确的是( )A、混合物中3种物质反应时消耗盐酸的物质的量之比为3∶1∶3 B、反应后所得溶液中的与的物质的量浓度之比为1∶2 C、混合物中,FeO的物质的量无法确定,但比Fe的物质的量少 D、混合物中,的物质的量无法确定,但Fe比FeO的物质的量少
-
20、以太阳能为热源分解 , 经热化学铁氧化合物循环分解水制的过程如图所示。下列叙述不正确的是( )
 A、过程Ⅰ和过程Ⅱ都属于氧化还原反应 B、过程Ⅱ的化学方程式为 C、整个过程中和都是还原产物 D、铁氧化合物循环制具有节约能源、产物易分离等优点
A、过程Ⅰ和过程Ⅱ都属于氧化还原反应 B、过程Ⅱ的化学方程式为 C、整个过程中和都是还原产物 D、铁氧化合物循环制具有节约能源、产物易分离等优点