相关试卷
-
1、表示阿伏加德罗常数的值,下列说法正确的是( )A、3.36 L NH3气体中含氮原子个数为 B、与NaOH反应时,每消耗1 mol Cl2转移电子数目为 C、48 g由O2和O3组成的混合气体中含有的原子数为 D、常温常压下,1 mol/L的NaCl溶液中含有个
-
2、工业废水中含有重铬酸根离子(),有毒,必须处理达标后才能排放。工业上常用绿矾()做处理剂,反应的原理为:。下列关于该反应的说法中,正确的是( )A、氧化剂是 B、每处理1 mol , 需要消耗 56 g C、氧化性强弱: D、每处理0.1 mol , 转移电子数为
-
3、用下列装置进行实验,能达到实验目的的是( )
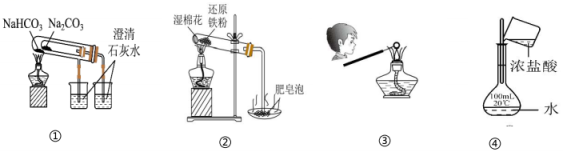 A、用图①比较Na2CO3和NaHCO3的稳定性 B、用图②装置进行铁与水蒸气的反应,点燃肥皂泡检验氢气 C、用图③装置乙检验草木灰中含有 D、用图④浓盐酸配制一定物质的量浓度的稀盐酸
A、用图①比较Na2CO3和NaHCO3的稳定性 B、用图②装置进行铁与水蒸气的反应,点燃肥皂泡检验氢气 C、用图③装置乙检验草木灰中含有 D、用图④浓盐酸配制一定物质的量浓度的稀盐酸 -
4、下列物质或试剂加到紫色石蕊溶液中,不能使其褪色的是( )A、新制氯水 B、久置氯水 C、过氧化钠 D、漂白粉
-
5、下列关于钠及其化合物的性质及用途的说法不正确的是( )A、相同温度时,在水中的溶解性:NaHCO3<Na2CO3 B、向碳酸钠中加入少量水后,碳酸钠会结块变为晶体,并伴随有吸热现象 C、过氧化钠可在呼吸面具中作为氧气的来源 D、存有金属钠的现场发生火灾时,不能用水来灭火
-
6、34号元素硒(Se)是人体必需的微量元素,其最外层有6个电子。下列有关说法不正确的是( )A、Se元素位于元素周期表第四周期第ⅥA族 B、H2Se的还原性比H2O的还原性强 C、和互为同位素 D、原子中质子数为34,中子数为78
-
7、微纳米材料研究所研发的纳米量级碳酸钙直径约为30 nm,下列有关说法正确的是( )A、纳米量级碳酸钙是一种胶体 B、若将纳米量级碳酸钙均匀分散到蒸馏水中,不能透过滤纸 C、若将纳米量级碳酸钙加入稀盐酸中,不会有二氧化碳产生 D、若将纳米量级碳酸钙均匀分散到蒸馏水中,会产生丁达尔效应
-
8、下列物质在水溶液中的电离方程式不正确的是( )A、 B、 C、 D、
-
9、下列反应属于氧化还原反应的是( )A、 B、 C、 D、
-
10、下列物质能导电且属于电解质的是( )A、NaCl固体 B、石墨 C、KNO3溶液 D、熔融的MgCl2
-
11、下列仪器与名称对应且书写正确的是( )A、三脚架
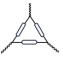 B、坩埚
B、坩埚 C、长颈漏斗
C、长颈漏斗 D、圆底烧瓶
D、圆底烧瓶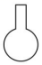
-
12、下列物质属于酸性氧化物的是( )A、CO2 B、Na2O2 C、NO D、Fe2O3
-
13、氯酸锶为白色结晶粉末,可溶于水,微溶于酒精,主要用于制造红色焰火。可溶于水,是一种常见的可溶性强碱。
下图为实验室制取氯酸锶的实验装置图,反应的化学方程式:。已知将浓盐酸滴入高锰酸钾固体中,产生黄绿色气体,溶液的紫红色褪去。请回答下列问题:
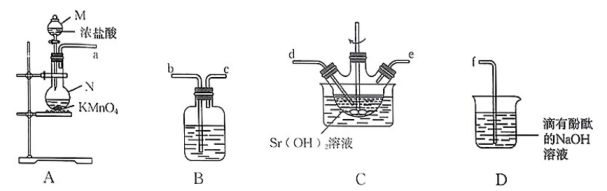 (1)、仪器M的名称是 , 仪器N的名称是。(2)、仪器接口的连接顺序为a→。(3)、D中发生反应的化学方程式为。(4)、使浓盐酸顺利滴下的操作方法为 , 再打开分液漏斗下端活塞。(5)、装置B中所装试剂名称为 , 其作用是。(6)、实验过程中发现装置D中溶液褪色,分析可能的原因:(答出两点)。
(1)、仪器M的名称是 , 仪器N的名称是。(2)、仪器接口的连接顺序为a→。(3)、D中发生反应的化学方程式为。(4)、使浓盐酸顺利滴下的操作方法为 , 再打开分液漏斗下端活塞。(5)、装置B中所装试剂名称为 , 其作用是。(6)、实验过程中发现装置D中溶液褪色,分析可能的原因:(答出两点)。 -
14、硫酸亚铁铵晶体俗名为摩尔盐。某学校化学兴趣小组使用摩尔盐配制溶液。请回答下列问题:(1)、配制溶液过程中需要的玻璃仪器除量筒、烧杯、玻璃棒外,还需。(2)、用电子天平(精确度为)称量晶体g。(3)、定容时发现液面超过了刻度线,处理的方法是。(4)、下列操作将导致所配制的溶液浓度偏小的是(填序号)。
①摩尔盐放置过程中失去了部分结晶水
②定容后振荡容量瓶发现液面低于刻度线,继续加蒸馏水定容
③定容时仰视容量瓶刻度线
④容量瓶注入溶液前有少量蒸馏水
(5)、已知溶液的密度大于水,用溶液和等质量的水混合,所得溶液的浓度(填“大于”、“小于”或“等于”)。 -
15、物质的量是宏观量与微观量相互联系的桥梁,回答下列问题。(1)、等质量的和所含分子个数比为;常温常压下,等体积的和两种气体所含原子个数比为 , 质量比为。(2)、将6L标准状况下的氯化氢气体溶于100mL水中(水的密度近似为),得到密度为的盐酸,则该盐酸的物质的量浓度是(列出计算式)。(3)、铜有两种常见的氧化物CuO和。某学习小组用电子天平称取固体,加热至完全分解成铜的氧化物,其质量随温度的变化如图所示,计算N点各成分的质量:CuOg,g。

-
16、完成下列填空:
现有物质:①铜 ②干冰 ③盐酸 ④液态硫酸 ⑤蔗糖 ⑥固体 ⑦红褐色的氢氧化铁胶体。
(1)、属于分散系的是(填序号,下同);能够导电的是;写出属于酸式盐的物质溶于水后的电离方程式:。(2)、⑦区别于溶液和浊液的本质特征为 , 利用效应可区分胶体和溶液。(3)、氢氧化铁胶体可用于净水的原因是。 -
17、一个密闭容器中间有一可自由滑动的隔板(厚度不计),隔板将容器分成左右两室,左室充入 , 右室充入一定量的CO和 , 隔板位置如图Ⅰ,并持续用电火花引燃右室气体,充分反应后恢复至起始温度,隔板位置如图Ⅱ。右室中生成的物质的量为( )
 A、 B、 C、 D、
A、 B、 C、 D、 -
18、下列相关实验装置或微观图及所得结论错误的是( )
选项
A
B
C
D
实验装置或微观图




实验结论
石墨可以导电,但是石墨不属于电解质
固态NaCl不导电,但是NaCl属于电解质
NaCl在水中电离成水合离子
熔融态的NaCl能导电,其属于电解质
A、A B、B C、C D、D -
19、数字化实验是利用传感器和信息处理终端进行实验数据的采集与分析。某兴趣小组利用数字化实验测定光照过程中氯水的pH、氯水中氯离子的浓度、广口瓶中氧气的体积分数、溶液的电导率(表示溶液传导电流的能力)的变化,针对该实验(不考虑溶剂和溶质的挥发),下列图像错误的是( )A、
 B、
B、 C、
C、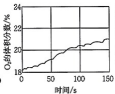 D、
D、
-
20、将KCl、、溶于水配成混合溶液,溶液体积为1L,部分离子物质的量如图所示,下列说法错误的是( )
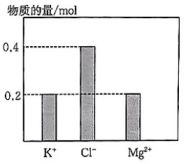 A、该混合溶液中的物质的量为0.1mol B、若将该混合溶液加水稀释至体积为5L,稀释后溶液中的物质的量浓度为 C、若向该混合溶液中逐滴加入溶液至恰好完全沉淀,需NaOH溶液50mL D、该混合溶液中由电离出的浓度为
A、该混合溶液中的物质的量为0.1mol B、若将该混合溶液加水稀释至体积为5L,稀释后溶液中的物质的量浓度为 C、若向该混合溶液中逐滴加入溶液至恰好完全沉淀,需NaOH溶液50mL D、该混合溶液中由电离出的浓度为