相关试卷
-
1、测定中和反应反应热的装置如图.已知: , 下列说法正确的是( )
 A、用金属材质的搅拌器效果更好 B、为使反应充分,应分批加入酸碱 C、测盐酸温度后的温度计可立即测溶液 D、若把盐酸换成醋酸,所测
A、用金属材质的搅拌器效果更好 B、为使反应充分,应分批加入酸碱 C、测盐酸温度后的温度计可立即测溶液 D、若把盐酸换成醋酸,所测 -
2、在一恒容密闭容器中,仅与发生反应生成 , 反应速率分别用表示.若从反应开始至达到平衡的这一段时间内,测得 , 则该反应的方程式为( )A、 B、 C、 D、
-
3、下列关于电化学的说法错误的是( )A、原电池可使化学能转化成电能 B、可通过电解熔融的办法获得单质 C、组成的原电池中作负极 D、电解水时可在水中加入少量以增强溶液导电性
-
4、下列资源利用的措施不是从环境保护角度考虑的为( )A、使用电子鞭炮代替烟花爆竹 B、使用乙醇汽油 C、燃煤脱硫 D、天然气中加入臭味剂
-
5、夏季,受台风影响,某些地区狂降暴雨.下列有关水汽变成雨的过程中焓变和熵变的判断正确的是( )A、 B、 C、 D、
-
6、2023年4月12日21时,中国有“人造太阳”之称的全超导托卡马克核聚变实验装置创造了新的世界纪录,成功实现稳态高约束模式等离子体运行403秒,对提升核聚变能源经济性、可行性,加快实现聚变发电具有重要意义.其原理为 , 下列有关说法正确的是( )A、核聚变为放热反应 B、聚变发电有利于减少碳排放量 C、聚变发电,可使核能全部转化成电能 D、互为同素异形体
-
7、我国力争在2060年前实现“碳中和”,综合利用CO2具有重要的意义。300 MPa、200℃条件下,CO2与H2反应可制得气态甲醇(CH3OH),其反应方程式为。(1)、该反应的能量变化如图所示:
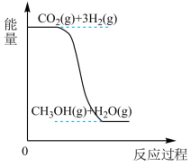
该反应是反应(填“吸热”或“放热”),判断的理由是。
(2)、为了加快该反应的速率,可以采取措施(任写一种)。(3)、在实际生产中,测得合成塔中H2及H2O(g)的物质的量随时间变化如下图所示,则图中代表H2的曲线是(填“X”或“Y”),v(正)与v(逆)相等的点为(填字母)。 (4)、在一定温度下,将2 mol CO2与6 mol H2气体混合于2 L密闭容器中制甲醇,2 min末生成0.8 mol H2O(g):
(4)、在一定温度下,将2 mol CO2与6 mol H2气体混合于2 L密闭容器中制甲醇,2 min末生成0.8 mol H2O(g):①用单位时间内CO2浓度的减小来表示2 min内该反应的平均速率为;
②2 min末容器中H2的物质的量浓度。
-
8、写出下列反应的热化学方程式。(1)、16 g CH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890.3 kJ热量:。(2)、若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量:。(3)、汽油的重要成分是辛烷(C8H18),1 mol C8H18(l)在O2(g)在燃烧,生成CO2(g)和H2O(l),放出5518 kJ热量:。(4)、卫星发射时可用肼(N2H4)作燃料,1 mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622 kJ热量:。
-
9、根据要求,回答下列问题:(1)、有机物M经过太阳光光照可转化成有机物N,转化过程如下:

两者稳定性大小是:NM(填“>”“<”或“=”)。
(2)、已知:的燃烧热; 。则(填“>”“<”或“=”)。(3)、使Cl2(g)和H2O(g)通过灼热的炭层,生成HCl(g)和CO2(g)。每消耗1 mol Cl2(g)放出145 kJ热量,则该反应的热化学方程式为。(4)、火箭和导弹表面的涂层是耐高温的物质。将铝粉、二氧化钛粉和石墨粉按一定比例混合在高温下煅烧,所得物质可作耐高温材料,反应的热化学方程式为 。则反应过程中,每转移2 mol电子,放出的热量为kJ。 -
10、某温度时,ⅥA元素单质与H2反应生成气态H2X的热化学方程式如下:
①
②
③
请回答:
(1)、上述反应中属于放热反应的是(填序号,下同),属于吸热反应的是。(2)、2 g H2完全燃烧生成气态水,放出的热量为。(3)、请写出O2与H2S反应生成S的热化学方程式。(4)、根据下图写出热化学方程式。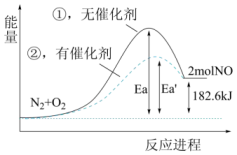 (5)、加入催化剂该反应的反应热是否发生了改变(填“是”或“否”)。
(5)、加入催化剂该反应的反应热是否发生了改变(填“是”或“否”)。 -
11、下图表示H2O2分解时能量随反应进程的变化,下列说法正确的是( )
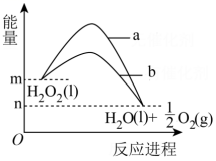 A、曲线a表示加入催化剂时能量随反应进程的变化 B、曲线b表示反应的热效应减小了 C、双氧水催化分解不需要加热,由此推测,催化剂存在下的分解都不需要加热 D、该反应的热化学方程式:
A、曲线a表示加入催化剂时能量随反应进程的变化 B、曲线b表示反应的热效应减小了 C、双氧水催化分解不需要加热,由此推测,催化剂存在下的分解都不需要加热 D、该反应的热化学方程式: -
12、下列热化学方程式正确的是( )A、通常状况下,将1 g氢气在氯气中完全燃烧,放出92.4 kJ热量:; B、已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出b kJ热量:; C、1 g炭与适量水蒸气反应生成一氧化碳和氢气,需吸收10.94 kJ的热量: D、已知甲烷燃烧生成二氧化碳和液态水放出的热量为:;
-
13、下面均是正丁烷与氧气反应的热化学方程式(25°,101 kPa):
①
②
③
④
由此判断,正丁烷的燃烧热是( )
A、-2878 kJ/mol B、-2658 kJ/mol C、-1746 kJ/mol D、-1526 kJ/mol -
14、下列说法或表示方法正确的是( )A、吸热反应一定需要加热才能发生 B、氢气与氧气反应生成等量的液态水和水蒸气,后者放出的热量多 C、1 mol硫完全燃烧放热297.3 kJ,其热化学方程式为: D、在稀溶液中: , , 若将含0.5 mol H2SO4的稀硫酸与含1.1 mol NaOH的稀溶液混合,放出的热量等于57.3 kJ
-
15、强酸与强碱的稀溶液发生中和反应的热效应为: 。分别向1 L 的的溶液中加入①浓硫酸;②稀硫酸;③稀硝酸;④稀醋酸,恰好完全反应的热效应分别为、、、 , 下列关系正确的是( )A、 B、 C、 D、
-
16、下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )

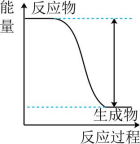
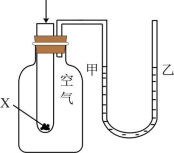
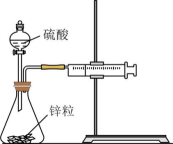
A.温度计的水银柱不断上升
B.反应物总能量大于生成物总能量
C.反应开始后,甲处液面低于乙处液面
D.反应开始后,针筒活塞向右移动
A、A B、B C、C D、D -
17、 (); , 下列能量变化示意图正确的是( )A、
 B、
B、 C、
C、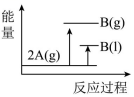 D、
D、
-
18、下列关于反应热的叙述正确的是( )A、当时,表示该反应为吸热反应 B、1 mol H2与0.5 mol O2反应生成1 mol水时放出的热量即是H2的燃烧热 C、热化学方程式中的化学计量数只能是整数,不能是分数 D、1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH<HNO3
-
19、已知 , 和反应过程中的能量变化如图所示。a、b、c、d都表示正数,下列说法正确的是( )
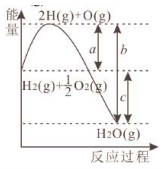 A、c代表新键形成所放出的能量 B、该反应是吸热反应 C、若 , 则 D、
A、c代表新键形成所放出的能量 B、该反应是吸热反应 C、若 , 则 D、 -
20、CO2是一种廉价的碳资源,其综合利用具有重要意义,用CO2与NH3为原料合成尿素是固定和利用CO2的成功范例。
已知:①
②
③
则:反应的为( )
A、 B、 C、 D、