相关试卷
-
1、 下列化学用语表达正确,且与所给事实相符的是 ( )A、滴加酚酞的苏打水呈红色:+2H2OH2CO3+2OH- B、铁在潮湿空气中生成红褐色的铁锈,其负极的电极反应:Fe-2e-=Fe2+ C、用铁作电极电解NaCl溶液:2Cl-+2H2O2OH-+H2↑+Cl2↑ D、NaHS溶液水解:HS-+H2OS2-+H3O+
-
2、 NA设为阿伏加德罗常数的值,下列说法正确的是 ( )A、40g处于基态的氩气中含有的p轨道电子总数为12NA B、0.1mol/L的CH3COOH溶液中H+数目一定小于0.1NA C、电解精炼含锌等杂质的粗铜,阴极增加64g,转移电子总数小于2NA D、100mL0.1mol/L的K2Cr2O7溶液中,数目为0.01NA
-
3、 下列说法正确的是 ( )A、在外加电流法中,高硅铸铁惰性辅助阳极的作用为损耗阳极材料和传递电流 B、电解冶炼镁、铝通常电解熔融的MgCl2和Al2O3 , 也可电解MgO和AlCl3 C、利用焓判据可判断N2(g)+3H2(g)=2NH3(g) △H=-92.4kJ/mol能自发进行 D、纯物质完全燃烧生成1mol稳定氧化物时所放出的热量叫做该物质的燃烧热
-
4、 下列事实不能用勒夏特列原理解释的是 ( )A、向氯水中加入CaCO3固体提高HClO的浓度 B、盛有Na2S2O3溶液与稀硫酸混合液的试管浸入热水时迅速变浑浊 C、向0.1mol/LK2Cr2O7溶液中滴入10滴浓NaOH溶液,溶液由橙色变黄色 D、红棕色的NO2 , 加压后颜色先变深后变浅
-
5、 下列Li原子电子排布图表示的状态中,能量最高的是( )A、
 B、
B、 C、
C、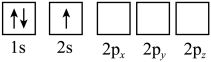 D、
D、
-
6、 下列各元素性质的叙述中,正确的是 ( )A、N、O、F的电负性依次减小 B、、、的第一电离能依次增大 C、符号为和的基态微粒的轨道表示式相同 D、基态原子的电子排布式为:
-
7、 2022年12月4日随着神舟十四号返回舱在东风着陆场成功着陆,载人飞行任务取得圆满成功。“天宫课堂”在中国空间站的开展,展示了我国科技发展的巨大成就。下列说法正确的是( )A、“太空冰雪实验”中,乙酸钠过饱和溶液结晶形成温热“冰球”,该过程放出热量 B、“五环实验”中,向乙酸溶液中滴加甲基橙溶液后变成黄色 C、在太空失重状态下,“水油分离实验”中,能通过分液实现水和油的分离 D、由“泡腾片(主要成分为柠檬酸和碳酸氢钠)实验”可知,酸性:碳酸Ka1>柠檬酸Ka1
-
8、苯乙烯是用于生产苯乙烯系列树脂、丁苯橡胶、离子交换树脂及医药品的原料之一,可通过乙苯的分解制备.(1)、标准状态时,由指定单质生成物质的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用表示.规定(C,石墨)和为0,利用标准摩尔生成焓可以求出化学反应热,已知相关物质的标准摩尔生成焓如下表:
物质
乙苯分解反应的 , 该反应在(填标号)下有利于自发进行.
a.高温 b.低温 c.任何温度
(2)、向密闭容器中充入气态乙苯发生反应 , 其平衡转化率随温度和压强变化的情况如图所示.
①由大到小的顺序是 , 理由是 .
②A点对应的条件下,的体积分数为(保留三位有效数字)%,下,该反应的物质的量分数平衡常数[用平衡时各物质的物质的量分数(物质的量分数=某组分的物质的量÷总物质的量)来代替各物质的平衡浓度,得到的平衡常数称为物质的量分数平衡常数];与压强平衡常数(以分压表示,分压=总压×物质的量分数,表示总压)的关系为 .
③向A点平衡体系中加入可提高平衡转化率,欲将平衡转化率提高至80%,需要向反应器中充入作为稀释气.
-
9、某学习小组为探究的电离情况,进行了如下实验.
 (1)、【实验一】配制并测定醋酸中的浓度.
(1)、【实验一】配制并测定醋酸中的浓度.
配制稀醋酸,用(填标号)量取于锥形瓶中,加入几滴溶液作指示剂.(2)、用的溶液滴定,达到滴定终点时的现象为 .(3)、4次滴定消耗溶液的体积记录如下:实验次数
1
2
3
4
滴定前
滴定终点
消耗溶液的体积/
25.07
25.02
26.88


第4次滴定消耗溶液的体积为 , 则所配稀醋酸的物质的量浓度约为(保留4位有效数字) .
(4)、【实验二】探究浓度对电离程度的影响.用计测定时不同浓度的醋酸的 , 结果如下:
由表中数据计算的电离常数 .浓度/
0.0010
0.0100
0.1000
3.88
3.38
2.88
(5)、从表中数据可以计算得出:随着浓度的增大,的电离程度将(填“增大”“减小”或“不变”). -
10、回收废旧电池,既可以减轻重金属对环境的污染,又可以变废为宝.对废弃的锂电池正极材料进行氯化处理以回收等金属的工艺路线如图:
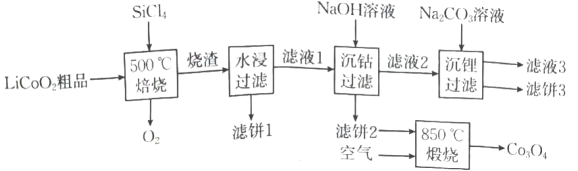
已知:常温下,的电离常数的电离常数 .
回答下列问题:
(1)、写出一条提高焙烧效率的措施: .(2)、若烧渣是和的混合物,写出焙烧时发生反应的化学方程式: .(3)、简述洗涤滤饼3的操作: .(4)、现有相同的以下三种溶液.a.溶液 b.溶液 c.氨水
①(填“>”“<”或“=”)1.
②三种溶液中由水电离出的的浓度的关系是(用a、b、c表示).
(5)、完全沉淀时(溶液中离子浓度小于时可认为沉淀完全),溶液的最小值约为 .(6)、煅烧滤饼2时发生反应的化学方程式为 , 得到的的组成类似于 , 则中与的个数比为 . -
11、丙烷作为奥运火炬的燃料,价格低廉,燃烧后只生成二氧化碳和水,不会对环境造成污染.丙烷燃烧产生的火焰呈亮黄色,比较醒目.
已知:①某些常见化学键的键能数据如下.
化学键
键能/
803
463
348
413
497
② .
(1)、写出表示丙烷燃烧热的热化学方程式:;该反应中反应物的总能量(填“>”“<”或“=”)生成物的总能量.(2)、丙烷的爆炸极限窄,故其为比较理想的便携式燃料电池的燃料.以丙烷为燃料的固体氧化物(能传导)燃料电池的结构示意图如图.该电池利用催化剂对正、负极气体选择催化性的差异而产生电势差进行工作.
①电池工作时,丙烷在(填“正”或“负”)极上发生(填“氧化”或“还原”)反应,电极反应式为 .
②电池工作时,丙烷会与氧气反应转化成合成气(成分为和)而造成电能损失.若丙烷先完全转化成合成气后再发生电极反应,则电能损失率为%,总反应消耗氧气的物质的量(填“增大“减小”或“不变”).
-
12、常温下,向三元酸溶液中滴加的溶液,溶液中含A微粒的物质的量分数随溶液的变化如图所示,下列说法正确的是( )
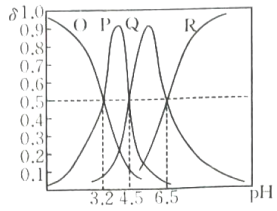 A、P为的物质的量分数与溶液的关系曲线 B、该三元酸的第一步电离是完全的 C、常温下,的水解常数 D、当加入溶液时,溶液显酸性
A、P为的物质的量分数与溶液的关系曲线 B、该三元酸的第一步电离是完全的 C、常温下,的水解常数 D、当加入溶液时,溶液显酸性 -
13、我国某大学科研团队提出用多孔泡沫铁、高度膨化的纳米泡沫碳和添加了的溶液构建独特的“摇椅式”全铁离子电池,电池结构如图(阴离子未标出).下列说法错误的是( )
 A、可增加电解质溶液的导电性 B、充电时,阳极的电极反应式为 C、放电时,电极N为负极 D、放电时,每转移 , 参与反应的铁元素的总质量为
A、可增加电解质溶液的导电性 B、充电时,阳极的电极反应式为 C、放电时,电极N为负极 D、放电时,每转移 , 参与反应的铁元素的总质量为 -
14、如表所示,在三个初始温度均为的容器中进行反应: , 下列说法正确的是( )
容器编号
容器类型
初始体积
反应物的起始投入量/
平衡时
A
B
C
甲
恒温恒容
0
0
2
1.6
乙
恒容绝热
2
1
0
a
丙
恒温恒容
6
3
0
b
A、 B、 C、下该反应的平衡常数 D、平衡时A的正反应速率: -
15、羰基硫是一种粮食熏蒸剂,能防治某些害虫和真菌的危害.一定条件下,与能反应生成羰基硫: , 设为阿伏加德罗常数的值,下列说法正确的是( )A、每转移个 , 吸收能量 B、溶液中含有的数目为 C、中含有的双键数目为 D、与充分反应可生成分子的数目为
-
16、常温下,将溶液和溶液均稀释到 . 下列叙述正确的是( )A、稀释后两溶液中的均减小 B、稀释后两溶液中水的电离程度均减小 C、稀释后两溶液的导电性均增强 D、稀释后两溶液中含硫微粒的关系:
-
17、用石墨作电极,电解溶液的装置如图,当电路中通过时,下列说法错误的是( )
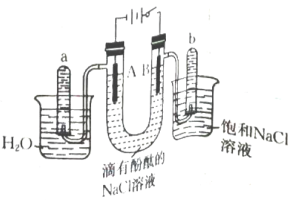 A、滴有酚酞的溶液变为红色 B、通入 , 可使电解质溶液恢复到电解前的状态 C、a试管中的气体体积略大于b试管中的 D、A极的电极反应式仅为
A、滴有酚酞的溶液变为红色 B、通入 , 可使电解质溶液恢复到电解前的状态 C、a试管中的气体体积略大于b试管中的 D、A极的电极反应式仅为 -
18、常温下,下列离子组在指定溶液中能大量共存的是( )A、“84”消毒液中: B、的溶液中: C、常温下,的溶液中: D、久置的饱和氯水中:
-
19、直接甲醇燃料电池具有能量密度高、成本低、运输方便等优点,是便携式电子设备以及电动汽车的理想供能装置.其中,由于甲醇氧化反应涉及多个电子转移步骤,通常需要使用基催化剂来加快反应.在两种催化剂表面的反应历程如图.下列说法错误的是( )
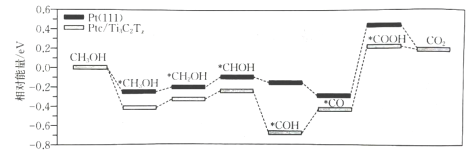 A、使反应焓变降低的程度比大 B、反应过程中有极性键的断裂和形成 C、对甲醇分子具有较高的吸附和活化能力 D、吸附在催化剂表面的过程放出能量
A、使反应焓变降低的程度比大 B、反应过程中有极性键的断裂和形成 C、对甲醇分子具有较高的吸附和活化能力 D、吸附在催化剂表面的过程放出能量 -
20、利用下列装置进行的实验,不能达到预期目的的是( )
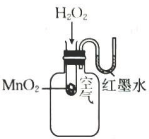

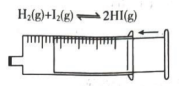
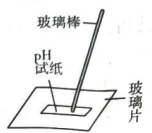
A.探究双氧水分解的热效应
B.制作水果(柠檬)电池
C.探究压强对平衡移动的影响
D.粗测碳酸钠溶液的
A、A B、B C、C D、D