相关试卷
-
1、已知:一些烷烃的燃烧热(101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量)如表:
化合物
甲烷
乙烷
丙烷
燃烧热
-891.0
-1560.8
-2221.5
下列说法中正确的是( )
A、C—H键的键能为 B、乙烷燃烧的热化学方程式为 C、等质量的三种烷烃完全燃烧,丙烷放出的热量最多 D、由表中数据不能确定C—C键的键能 -
2、已知 ,
,
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )kJ
A、 B、 C、 D、 -
3、已知:的。其中相关的键能数据如下表所示,则x的值为( )
化学键
F—F
N—F
键能
946
x
283
A、471 B、157 C、138 D、756 -
4、已知:氧化锂(Li2O)晶体形成过程中的能量变化如图所示。
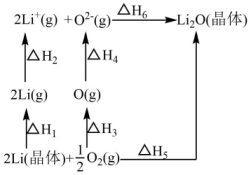
下列说法正确的是( )
A、 , B、 C、 , D、 -
5、在同温同压下,下列各组热化学方程式中,的是( )A、 ; B、 ; C、 ; D、 ;
-
6、关于化学反应与能量的说法正确的是( )A、需要加热的反应都是吸热反应 B、反应物总能量与生成物总能量一定相等 C、断裂化学键要吸收能量 D、燃烧热指的是101 kPa时,1 mol纯物质完全燃烧生成氧化物时所放出的热量
-
7、一种以生石灰(CaO)为原料制备KClO3的流程如图:
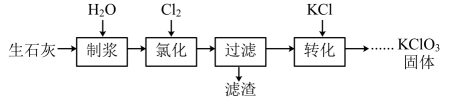 (1)、“制浆”过程中发生的化学反应方程式为。(2)、“氯化”过程氯化过程是Cl2与Ca(OH)2作反应。
(1)、“制浆”过程中发生的化学反应方程式为。(2)、“氯化”过程氯化过程是Cl2与Ca(OH)2作反应。①可以通过缓慢通入的方法提高Cl2的利用率,二者反应生成Ca(ClO3)2的离子方程式为。
②Cl2与Ca(OH)2作用除生成Ca(ClO3)2外,还可能生成Ca(ClO)2 , 若生成含等物质的量氯元素的Ca(ClO3)2与Ca(ClO)2时,消耗的Cl2的物质的量之比为。
③“氯化”过程中会有少量Ca(ClO)2 , 经光照还会有少量无色无味气体生成,该气体可能是(填化学式)。
(3)、“转化”过程各物质的溶解度曲线如图所示。
①Ca(ClO3)2的溶解度曲线是(填A或B),若溶液中KClO3的含量为100g•L-1 , 从该溶液中得到KClO3固体的方法是蒸发浓缩、、、洗涤。
②KClO3与SO2在强酸性条件下可反应制得ClO2 , SO2被氧化为S , 该反应的离子方程式为。
-
8、(1)、I.铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设并进行了如下实验:
【查阅资料】
i.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
ii.KSCN中的硫元素为-2价。
iii.Fe(OH)3受热分解生成Fe2O3。
实验I.检验该补铁剂中铁元素的价态。
试剂2是。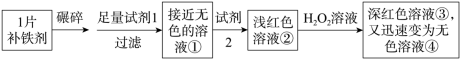 (2)、能证明溶液①中含有Fe2+的实验现象是。(3)、写出Fe2+与H2O2发生反应的离子方程式:。(4)、实验II.测定该补铁剂中铁元素的含量。
(2)、能证明溶液①中含有Fe2+的实验现象是。(3)、写出Fe2+与H2O2发生反应的离子方程式:。(4)、实验II.测定该补铁剂中铁元素的含量。
计算每片该补铁剂含铁元素的质量为g。 (5)、II. 乳酸亚铁是一种很好的补铁剂,制备乳酸亚铁晶体的方法之一是用新制的碳酸亚铁与乳酸溶液反应,某化学社团小组成员模拟上述流程制备碳酸亚铁,反应的装置如图所示:
(5)、II. 乳酸亚铁是一种很好的补铁剂,制备乳酸亚铁晶体的方法之一是用新制的碳酸亚铁与乳酸溶液反应,某化学社团小组成员模拟上述流程制备碳酸亚铁,反应的装置如图所示: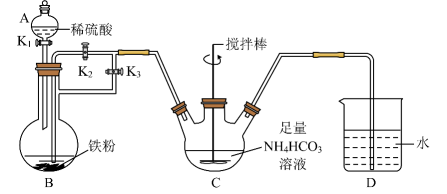
完成下列填空:
小组成员按上图连接好装置,检查装置气密性后加入药品,打开K1和K3 , 关闭K2。
仪器A中名称为。
(6)、反应一段时间后,关闭(填“K1”、“K2”或“K3”,下同),打开 , 观察到B中的溶液会流入C中,同时C中析出沉淀。(7)、B中产生的气体除了把B中溶液压进C外,还有什么作用?。(8)、仪器C中生成的离子方程式为。 -
9、某实验小组同学在配制80mL0.5mol/LNa2CO3(式量为106)溶液时,进行如下实验操作:
①将称量好的Na2CO3固体放入小烧杯中,加适量蒸馏水溶解。
②将Na2CO3溶液冷却到室温后,小心转入____中。
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都要小心转入容量瓶中,并轻轻摇匀。
④继续加蒸馏水至液面距刻度线1~2cm处,改用____滴加蒸馏水至溶液凹液面最低点与刻度线相切。
⑤将容量瓶瓶塞塞紧,充分摇匀。
回答下列问题:
(1)、实验中需称量gNa2CO3固体。(2)、实验步骤②④中需使用的仪器名称分别为、 。(3)、所配溶液中Na+物质的量浓度是mol/L。(4)、取出50mL配置好的溶液,加入足量稀盐酸,产生的气体在标况下的体积是L,写出该反应的离子方程式。(5)、经过测定,某同学配制该溶液浓度偏高,则可能的原因是(填序号)①容量瓶用蒸馏水洗涤后未经干燥
②洗涤烧杯内壁后将洗涤液弃去
③转移溶液时,不慎有少量溶液洒出
④定容、摇匀后发现溶液的凹液面低于刻度线
⑤定容时,俯视容量瓶刻度线
(6)、下列关于容量瓶的操作,正确的是。
-
10、一些物质的分类如图,根据所学知识填空。
 (1)、A组物质中属于碱性氧化物的电解质是。A组物质中Na2O2具有强氧化性,和A组中CO2一样SO2也为非电解质,但SO2有还原性,写出Na2O2和SO2发生化合反应的化学方程式。(2)、B组中两种金属均可在氯气中燃烧,1molCl2与足量金属铁粉充分反应生成+3价的三氯化铁,理论上转移电子数为个。(3)、D组中两种单质均能与H2O反应,写出熔点低的那种金属与H2O反应的方程式(属于离子反应的写离子方程式)。(4)、写出A组物质中属于酸式盐的物质在熔融状态下的电离方程式。(5)、向少量的Ba(OH)2溶液中逐滴加入稀硫酸可生成硫酸钡,其反应的离子方程式为:Ba2++2OH-+2H++ = BaSO4↓+2H2O。下列三种情况下,离子方程式与题干中相同的是____(填序号)。A、向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性 B、向NaHSO4溶液中逐滴加入Ba(OH)2溶液至恰好完全沉淀 C、向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量 D、向少量的稀硫酸溶液中逐滴加入Ba(OH)2至溶液显中性(6)、磷元素的含氧酸有H3PO4、H3PO3(亚磷酸)、H3PO2(次磷酸)等多种。其中已知:H3PO2+NaOH(过量) = NaH2PO2+H2O。则NaH2PO2属于(填“正盐”或“酸式盐”)。
(1)、A组物质中属于碱性氧化物的电解质是。A组物质中Na2O2具有强氧化性,和A组中CO2一样SO2也为非电解质,但SO2有还原性,写出Na2O2和SO2发生化合反应的化学方程式。(2)、B组中两种金属均可在氯气中燃烧,1molCl2与足量金属铁粉充分反应生成+3价的三氯化铁,理论上转移电子数为个。(3)、D组中两种单质均能与H2O反应,写出熔点低的那种金属与H2O反应的方程式(属于离子反应的写离子方程式)。(4)、写出A组物质中属于酸式盐的物质在熔融状态下的电离方程式。(5)、向少量的Ba(OH)2溶液中逐滴加入稀硫酸可生成硫酸钡,其反应的离子方程式为:Ba2++2OH-+2H++ = BaSO4↓+2H2O。下列三种情况下,离子方程式与题干中相同的是____(填序号)。A、向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性 B、向NaHSO4溶液中逐滴加入Ba(OH)2溶液至恰好完全沉淀 C、向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量 D、向少量的稀硫酸溶液中逐滴加入Ba(OH)2至溶液显中性(6)、磷元素的含氧酸有H3PO4、H3PO3(亚磷酸)、H3PO2(次磷酸)等多种。其中已知:H3PO2+NaOH(过量) = NaH2PO2+H2O。则NaH2PO2属于(填“正盐”或“酸式盐”)。 -
11、已知氧化性:Cl2>Br2>Fe3+ , 向含溶质amolFeBr2的溶液中通入bmolCl2 , 充分反应。下列说法不正确的是( )A、离子的还原性强弱: Fe2+>Br->Cl- B、当a=2b时,发生的离子反应:2Fe2++Cl2 = 2Fe3++2Cl- C、当a=b时,反应后的离子浓度:c(Fe3+):c(Br-):c(Cl-) = 1:2:2 D、当3a=2b时,发生的离子反应:2Fe2++4Br+3Cl2 = 2Fe3++2Br2+6Cl-
-
12、下列叙述中正确的是( )
①标准状况下,1 L HCl和1 L H2O的物质的量相同
②若一个硫原子的质量是ag,12C原子的质量是b g,NA只表示阿伏加德罗常数的数值,则该硫原子的摩尔质量为 g·mol-1或aNAg·mol-1
③物质A加热完全分解,分解方程式为 2AB+2C+3D且产物都是气体,测得生成的混合气体对氢气的相对密度为15,则A的相对分子质量为60
④物质的量相同的两种物质,则它们在标准状况下的体积也相同
⑤温度和容积相同的两容器中分别盛有5molO2和2molN2 , 则压强之比为5:2
⑥等温等压下,SO2气体与CO2气体的密度之比等于16:11
A、①②③ B、②⑤⑥ C、②③⑥ D、④⑤⑥ -
13、钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示,下列说法不正确的是( )
①3Fe+NaNO2+5NaOH = 3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O → Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O = Fe3O4+4NaOH
A、碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 B、反应①、②是氧化还原反应,③不是氧化还原反应 C、反应②配平后,H2O的化学计量数是6 D、整个反应过程中,每有16.8gFe参加反应转移0.8mol电子 -
14、X 溶液中可能含有下列离子中的若干种:Cl-、、Na+、K+、Fe2+、Fe3+、Mg2+。现对X 溶液进行如图所示的实验,其现象和结果如下:

下列说法不正确的是( )
A、X 溶液中一定含有Fe2+ 、Cl- B、取溶液B进行焰色试验,若能看到黄色火焰,则X溶液中有Na+ C、取溶液B进行焰色试验,若透过蓝色钴玻璃能看到紫色火焰,则X溶液中有K+ D、白色沉淀A在空气中变红褐色的反应方程式为:4Fe(OH)2+O2+2H2O = 4Fe(OH)3 -
15、下列装置能达到实验目的的是( )
A
B
C
D




证明热稳定性:
制取
制备Fe(OH)3
胶体
称取一定质量的NaOH固体
A、A B、B C、C D、D -
16、下列实验室制取、净化、收集并进行尾气吸收的装置和原理能达到实验目的的是( )
 A、制备 B、净化 C、收集 D、尾气处理
A、制备 B、净化 C、收集 D、尾气处理 -
17、下列除杂试剂的选择或除杂操作不正确的是( )
选项
括号内为杂质
除杂试剂
除杂操作
A
Cu(Fe)固体
稀盐酸
充分反应后过滤
B
(HCl)气体
饱和溶液
洗气
C
()溶液
铁粉
充分反应后过滤
D
(HCl)气体
饱和溶液
洗气
A、A B、B C、C D、D -
18、在通常条件下,分别向三个气球(同一规格,忽略气球自身的重量)吹进两种按体积比1:1混合的气体,吹出体积相等的①、②、③三个气球。下列判断不正确的是( )
 A、三个气球中所含气体的分子数相等 B、三个气球中所含气体的原子数不相等 C、三个气球中气体分子间的平均距离相等 D、三个气球放在空气中,只有一个往下沉
A、三个气球中所含气体的分子数相等 B、三个气球中所含气体的原子数不相等 C、三个气球中气体分子间的平均距离相等 D、三个气球放在空气中,只有一个往下沉 -
19、设为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,含有的分子数为 B、0.1molNaCl含有的数为 C、常温常压下,含有的原子数为 D、溶液含有的数为
-
20、下列关于含氯消毒剂的解释不正确的是( )A、“84”消毒液不能与洁厕灵混合使用:2H++Cl-+ClO-=Cl2↑+H2O B、将氯气通入澄清石灰水制取漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O C、氯水中含有HClO,能杀死水中的病菌,起到消毒的作用 D、向Ca(ClO)2溶液中通入适量CO2:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO