相关试卷
-
1、下列各组离子在给定条件下一定能大量共存的是( )A、使酚酞溶液变红的溶液中:、、、 B、含有大量的溶液中:、、、 C、使石蕊溶液变红的溶液中:、、、 D、的溶液中:、、、
-
2、水是一种重要的资源,图中和水相连的物质都能和水反应,下列说法正确的是( )
 A、①反应,1molNa与足量水反应,放出11.2L氢气 B、②反应,与足量水反应的离子方程式为: C、③反应,生成和 D、④反应,水为还原剂
A、①反应,1molNa与足量水反应,放出11.2L氢气 B、②反应,与足量水反应的离子方程式为: C、③反应,生成和 D、④反应,水为还原剂 -
3、“化学”和生活密切相关,学好化学会让生活更美好,下列说法正确的是( )A、Na的还原性很强,能够将大多数金属从它的盐溶液中置换出来 B、小苏打指碳酸氢钠,可用于治疗胃酸过多 C、84消毒液可与洁厕灵(主要成分为HCl)混合使用以此增强溶液的消毒能力 D、为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰包
-
4、下列方框中的物质或溶液之间发生的反应分别是①②③④,下列有关这些反应的说法不正确的是( )
 A、①置换反应,反应的离子方程式为 B、②是复分解反应,反应的离子方程式为 C、③是化合反应,但不是离子反应 D、④中反应的离子方程式可能是
A、①置换反应,反应的离子方程式为 B、②是复分解反应,反应的离子方程式为 C、③是化合反应,但不是离子反应 D、④中反应的离子方程式可能是 -
5、分类是一种重要的学习方法。物质的分类如图所示,下列说法中正确的是( )
 A、图甲所示的分类方法属于树状分类法 B、酸性氧化物一定是非金属氧化物 C、Fe(OH)3胶体属于碱 D、甲图中“……”包含混合物
A、图甲所示的分类方法属于树状分类法 B、酸性氧化物一定是非金属氧化物 C、Fe(OH)3胶体属于碱 D、甲图中“……”包含混合物 -
6、的回收与利用是科学家研究的热点课题.工业上有一种用生产甲醇燃料的方法:.将和充入的恒温刚性密闭容器中,测得的氢气物质的量随时间变化如图所示(实线).
 (1)、下列说法能表明该反应已经达到平衡状态的是____(填序号).A、 B、混合气体的平均相对分子质量不变 C、保持不变 D、压强保持不变(2)、a点正反应速率(填“>”、“<”或“=”)b点逆反应速率,前内.用表示的平均反应速率为.(保留两位有效数字)(3)、平衡时的转化率为 , 该条件下反应的平衡常数.(4)、若温度不变达到平衡后往容器中分别充入 , 各 , 请问(填“>”、“<”或“=”).(5)、仅改变某一实验条件再进行实验,测得的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是.
(1)、下列说法能表明该反应已经达到平衡状态的是____(填序号).A、 B、混合气体的平均相对分子质量不变 C、保持不变 D、压强保持不变(2)、a点正反应速率(填“>”、“<”或“=”)b点逆反应速率,前内.用表示的平均反应速率为.(保留两位有效数字)(3)、平衡时的转化率为 , 该条件下反应的平衡常数.(4)、若温度不变达到平衡后往容器中分别充入 , 各 , 请问(填“>”、“<”或“=”).(5)、仅改变某一实验条件再进行实验,测得的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是. -
7、碱式碳酸铜可用作有机催化剂.工业上以辉铜矿(主要成分为 , 含及少量)为原料制备碱式碳酸铜,工业流程如下:
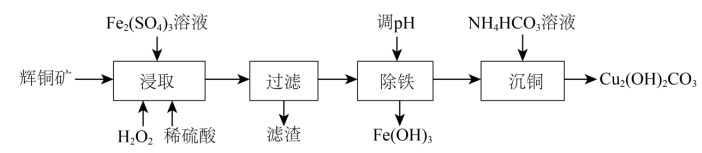 (1)、滤渣可能含S、(填化学式).(2)、①“浸取”时能提高辉铜矿浸取率的措施有(填2条).
(1)、滤渣可能含S、(填化学式).(2)、①“浸取”时能提高辉铜矿浸取率的措施有(填2条).②某小组测得浸取率随浓度及温度影响的变化曲线如下:

图一 图二
由图一可知适宜的浓度范围为;由图一中的a点分析,浸取时也起到了氧化辉铜矿的作用,该反应的离子方程式为;
图二中高于85℃时浸取率下降的原因是.
(3)、“除铁”步骤调可加入试剂(填选项字母);a.氨气 b. c. d.
(4)、常温下,“过滤”后的滤液中 , 则“除铁”步骤调应小于[常温下,]. -
8、草酸是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性溶液发生反应:.(1)、探究外界条件对反应速率的影响.
实验编号
所加试剂及用量/mL
条件
溶液颜色褪至无色所需时间/min
溶液
溶液
稀
水
温度℃
1
12.0
2.0
3.0
3.0
20
2
6.0
2.0
3.0
20
3
2.0
3.0
9.0
30
①完成此实验设计,其中: , .
②对比实验1、2可探究对反应速率的影响.
(2)、某兴趣小组用草酸及草酸盐的性质测定硬水中钙离子的浓度.
根据消耗酸性标准溶液的体积即可测定硬水样品中的浓度.
①实验过程提及的下列仪器,在使用之前一定要润洗的是(填字母).
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②滴定过程中(填“需要”或“不需要”)另加指示剂,如何判断滴定终点.
③本实验滴定管起点和终点的液面位置如图所示,则滴定过程中消耗的标准溶液为.该硬水样品中的浓度为.

④下列不当操作会使测得的硬水样品的浓度偏高的是(填字母)
A.滴定管未用标准溶液润洗 B.草酸钙沉淀洗涤不充分
C.滴定前仰视读数并记录数据 D.盛放草酸溶液的锥形瓶没有干燥
-
9、电化学手段对于研究物质性质以及工业生产中都有重要价值.(1)、Ⅰ.结合所学知识,按要求回答问题.
按要求写出电极反应式①碱性锌锰电池的总反应为 ,
写出正极反应式.
(2)、Ⅱ.载人航天工程对科学研究及太空资源开发具有重要意义,其发展水平是衡量一个国家综合国力的重要指标.中国正在逐步建立自己的载人空间站“天宫”,神舟十三号载人飞船在北京时间10月16日0时23分点火发射,又一次正式踏上飞向浩挱星辰的征途.
氢氧燃料电池(构造示意图如图)单位质量输出电能较高,反应生成的水可作为航天员的饮用水,氧气可以作为备用氧源供给航天员呼吸.由此判断X极为电池的极,向(填“正”或“负”)极作定向移动,Y极的电极反应式为. (3)、在宇宙飞船或潜艇中,还可利用氢氧燃料电池所产生的水作为饮用水,今欲得常温下1.8L水,则电池内电子转移的物质的量约为mol(4)、“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池.飞船在光照区运行时,太阳能电池帆板将能转化为电能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来.其工作原理为: , 当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性(填“增大”“减小”或“不变”).
(3)、在宇宙飞船或潜艇中,还可利用氢氧燃料电池所产生的水作为饮用水,今欲得常温下1.8L水,则电池内电子转移的物质的量约为mol(4)、“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池.飞船在光照区运行时,太阳能电池帆板将能转化为电能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来.其工作原理为: , 当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性(填“增大”“减小”或“不变”). -
10、常温下,用溶液滴定(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
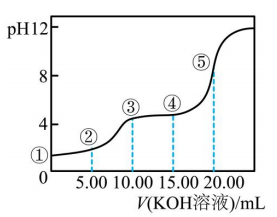 A、点①所示溶液中: B、点②所示溶液中: C、点③所示溶液中: D、点④所示溶液中:
A、点①所示溶液中: B、点②所示溶液中: C、点③所示溶液中: D、点④所示溶液中: -
11、甲烷燃料电池的工作原理如图,下列说法正确的是( )
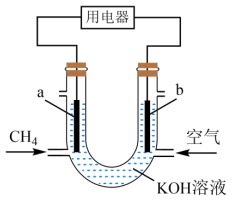 A、a极为正极 B、从b极经溶液流向a极 C、工作一段时间后,b极附近的pH会增大 D、a极的电极反应为
A、a极为正极 B、从b极经溶液流向a极 C、工作一段时间后,b极附近的pH会增大 D、a极的电极反应为 -
12、常温下, , 常温下在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
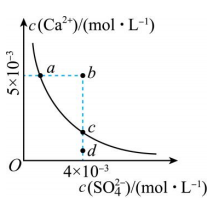 A、加入可使溶液由a点变到b点 B、b点将有沉淀生成,平衡后溶液中一定等于 C、d点溶液通过蒸发可以变到c点 D、a点对应的等于c点对应的
A、加入可使溶液由a点变到b点 B、b点将有沉淀生成,平衡后溶液中一定等于 C、d点溶液通过蒸发可以变到c点 D、a点对应的等于c点对应的 -
13、下列说法中正确的是( )A、的溶液中: B、浓度均为的①②③④ , 由小到大的顺序:④<③<①<② C、向、的混合饱和溶液中加入少量 , 溶液中减小 D、溶液中离子浓度大小顺序为
-
14、、、分别表示酸的电离常数、水的离子积常数、溶度积常数,下列判断正确的是( )A、室温下 , 说明的电离度一定比的大 B、室温下向的醋酸溶液中加入水稀释后,溶液中不变 C、25℃时,均为4的盐酸和溶液中不相等 D、两种难溶电解质做比较时,越小的电解质,其溶解度一定越小
-
15、由下列实验及现象不能推出相应结论的是( )
选项
实验操作
实验现象
解释或结论
A
向溶液中加入的溶液
有无色气体生成
酸性:
B
含和的浊液中通入气体
生成黑色沉淀
溶解度:
C
向均盛有溶液的两支试管中分别滴入和溶液1mL
前者产生气泡的速率更快
催化效果:
D
向浓度均为的和混合溶液中滴加少量溶液
先出现黄色沉淀
A、A B、B C、C D、D -
16、常温下,下列各组离子在指定条件下可能大量共存的是( )A、含有的溶液中:、、、 B、与反应能放出的溶液中:、、、 C、含有的溶液中:、、、 D、使甲基橙变红的溶液中:、、、
-
17、下列关于盐类水解的应用,说法不正确的是( )A、除去溶液中的可加入后过滤 B、水溶液蒸发结晶能得到固体 C、工业上可利用水解制备 D、配制溶液时,先将固体溶于较浓的盐酸中
-
18、下列各图所示装置能达到实验目的的是( )
A
B
C
D
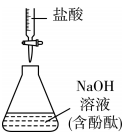
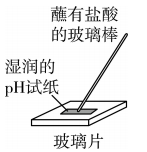
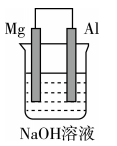

用已知浓度的盐酸测定溶液浓度
用pH试纸测定盐酸的pH
比较Mg和Al的金属性强弱
蒸干溶液制取无水
A、A B、B C、C D、D -
19、下列说法中正确的是( )A、的溶液一定呈酸性 B、将盐酸稀释至 , 所得溶液的为9 C、在常温下,当水电离出的为 , 时,此溶液的可能为1或13 D、将的盐酸与醋酸各分别稀释至 , 所得醋酸的略大
-
20、下列关于离子方程式书写正确的是( )A、用溶液检测: B、溶于水后发生微弱水解: C、用饱和溶液处理水垢: D、溶液中的电离: