相关试卷
-
1、采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇(CH3OH)方向取得重要进展,该反应历程如图所示。下列说法错误的是( )
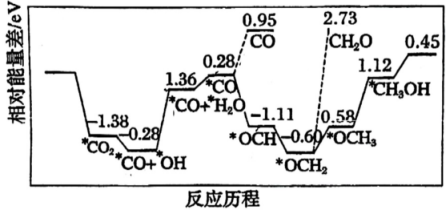 A、总反应焓变 B、上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低*CO+*OH→*CO+*H2O的能量
A、总反应焓变 B、上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低*CO+*OH→*CO+*H2O的能量变化。
C、该催化剂可有效提高反应物的平衡转化率 D、容易得到的副产物有CO和CH2O,其中相对较多的副产物为CO -
2、实验测得0.5 mol·L-1CH3COONa溶液、0.5 mol·L-1CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是( )
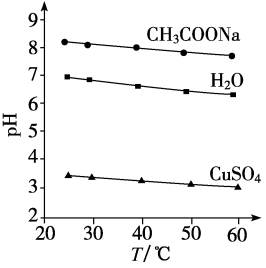 A、随温度升高,纯水中c(H+)>c(OH-) B、随温度升高,CH3COONa溶液的pH降低,是因为CH3COO-水解平衡向逆反应方向移动 C、随温度升高,CH3COONa溶液的c(OH-)减小 D、随温度升高,CuSO4溶液的pH减小是水的电离平衡和水解平衡向正反应方向移动的结果
A、随温度升高,纯水中c(H+)>c(OH-) B、随温度升高,CH3COONa溶液的pH降低,是因为CH3COO-水解平衡向逆反应方向移动 C、随温度升高,CH3COONa溶液的c(OH-)减小 D、随温度升高,CuSO4溶液的pH减小是水的电离平衡和水解平衡向正反应方向移动的结果 -
3、下列关于中和滴定的说法正确的是( )A、用标准浓度HCl溶液滴定弱碱MOH溶液来测定其浓度,选择酚酞为指示剂 B、除去碱式滴定管胶管内气泡的方法是将尖嘴垂直向下,挤压胶管内的玻璃球将气泡排出 C、滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 D、用稀NaOH滴定盐酸,用酚酞作指示剂,当锥形瓶中溶液由红色变无色时立即停止滴定
-
4、部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
Ka1=1.77×10-4
Ka1=4.9×10-10
Ka1=4.3×10-7 ; Ka2=5.6×10-11
下列选项错误的是( )
A、向NaCN溶液中通入少量CO2气体:CN-+H2O+CO2=HCN+HCO B、相同浓度的HCN和NaHCO3的导电能力:HCN>NaHCO3 C、中和等体积、等pH的HCOOH和HCN消耗NaOH的量,前者小于后者 D、等pH的HCOOH和HCN稀释相同的倍数后,pH前者大于后者 -
5、常温下0.1 mol·L-1 ①CH3COOH、②NaOH、③CH3COONa,下列叙述正确的是( )A、①中c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) B、①②等体积混合后,醋酸根离子浓度小于③的二分之一 C、①③等体积混合以后,溶液呈酸性,则c(Na+)>c(CH3COO-)>c(H+) D、①②等体积混合以后,水的电离程度比①③等体积混合后水的电离程度小
-
6、广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别离解成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法不正确的是( )A、BaO2的水解产物是Ba(OH)2和H2O2 B、PCl3的水解产物是HClO和H3PO4 C、Al4C3的水解产物是Al(OH)3和CH4 D、CH3COCl的水解产物是两种酸
-
7、化学是以实验为基础的科学。下列实验操作或做法正确且能达到目的的是( )
选项
操作或做法
目的
A
向两只盛有2mL5%双氧水的试管中,分别滴加5滴饱和溶液和5滴饱和溶液,观察实验现象
探究催化剂对反应速率的影响
B
取5mL0.1mol/LKI溶液于试管中,加入溶液,充分反应后滴入5滴15%KSCN溶液,观察实验现象
探究KI与反应是可逆反应
C
用玻璃棒蘸取NaClO溶液点到干燥的pH试纸中间
测NaClO溶液的pH值
D
在50mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶
取20.00mL盐酸
A、A B、B C、C D、D -
8、常温下,下列各组离子在指定溶液中因完全双水解而不能大量共存的是( )A、pH=1的溶液中:Fe2+、、、Na+ B、H+、NH4+、CH3COO-、 C、由水电离的c(H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、 D、K+、Al3+、、AlO2-
-
9、铅蓄电池的两极分别为Pb、PbO2 , 电解质溶液为H2SO4溶液,工作时的电池反应为:
Pb+ PbO2+2H2SO4 =2PbSO4+2H2O,下列结论正确的是( )
A、Pb为正极,被氧化 B、电池工作时,电解质溶液的pH不断减小 C、向PbO2极移动 D、电池工作时,电解质溶液的pH不断增大 -
10、室温下,对于1L 0.1mol·L-1醋酸溶液,下列判断正确的是( )A、该溶液中CH3COO- 的粒子数为6.02×1022 B、适当升高溶液温度,溶液中导电粒子数目减小 C、滴加NaOH溶液过程中,n(CH3COO-)与n(CH3COOH)之和始终为0.1 mol D、若该醋酸溶液的电离度为1%,则该醋酸溶液的电离平衡常数为10-4
-
11、已知:X(g)+2Y(g) 3Z(g) △H= - akJ·mol-1 (a>0),下列说法不正确的是( )A、0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol B、达到化学平衡状态时,X、Y、Z的浓度不再发生变化 C、密闭容器中,恒温,缩小体积,X的转化率不变 D、升高反应温度,逆反应速率增大,正反应速率减小
-
12、下列各组物质中,都是弱电解质的是( )A、盐酸、、 B、HClO、、 C、NaOH、、 D、、、
-
13、化学与社会、科学、技术、环境密切相关,下列说法错误的是( )A、医用硝酸铵速冷冰袋是利用硝酸铵溶于水吸热的性质 B、夏天面粉的发酵速率与冬天面粉的发酵速率相同 C、合理利用太阳能、风能和氢能等能源有利于实现“低碳经济” D、铁触媒的使用有利于提高合成氨的生产效率
-
14、氮是地球上含量丰富的一种元素,氮及其化合物是科学研究的重点内容。
回答下列问题:
(1)、Ⅰ.已知NO和经反应Ⅰ和反应Ⅱ转化为 , 其能量变化如图所示:
Ⅰ. , 平衡常数;
Ⅱ.____ , 平衡常数;
写出第Ⅱ步反应的化学方程式:。(2)、反应的(填“>”或“<”)0,平衡常数K=(用含、的代数式表示)。下列措施既能提高该反应的平衡转化率,又能加快生成的反应速率的是(填字母)。a.升高温度 b.缩小容器体积 c.加入催化剂
(3)、由实验测得反应Ⅱ的~的关系如图所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为(填字母)。 (4)、Ⅱ.在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应: , 其化学平衡常数K与温度T的关系如下表:
(4)、Ⅱ.在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应: , 其化学平衡常数K与温度T的关系如下表:T/℃
200
300
400
K
0.5
请回答下列问题:
试比较、的大小,(填“>”、“=”或“<”)。
(5)、400℃时,反应的平衡常数K=。当测得、、的浓度分别为3、2、1时,则该反应的(填“>”、“=”或“<”)。(6)、下图为一定温度下,和以1∶3进行反应,平衡时,的体积分数随压强的变化示意图
①随压强增大,的体积分数增大的原因是。
②比较b点和a点:平衡常数 (填“>”、“=”或“<”,下同),的浓度。
③计算b点的平衡常数(用分压表示的平衡常数,结果保留2位有效数字)
-
15、滴定实验是化学学科中重要的定量实验。(1)、Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴甲基橙指示剂;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
该酸碱中和滴定(题干中②③④步)所需仪器有____(填字母)。滴定序号
待测体积(mL)
消耗盐酸标准的体积(mL)
滴定前
滴定后
1
25.00
0.50
20.60
2
25.00
6.00
26.00
3
25.00
1.10
21.00
A、酸式滴定管(50mL) B、碱式滴定管(50mL) C、量筒(10mL) D、铁架台 E、滴定管夹 F、玻璃棒(2)、排去碱式滴定管中气泡的方法应采用操作。
甲 乙 丙
(3)、滴定达到终点的现象是。(4)、试样中NaOH的质量分数为。(5)、若出现下列情况,测定结果偏高的是。a.滴定前用蒸馏水冲洗锥形瓶
b.酸式滴定管滴至终点时,俯视读数
c.酸式滴定管用蒸馏水洗后,未用标准液润洗
d.酸式滴定管尖嘴部分有气泡,滴定后消失
(6)、Ⅱ.氧化还原滴定——取草酸( , 弱酸)溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1的高锰酸钾溶液滴定。
发生反应的离子方程式为。(7)、滴定时,溶液应装在滴定管中(填“酸式”或“碱式”)。 -
16、某学习小组设计研究醋酸的性质。(1)、研究稀释过程导电能力变化。

冰醋酸稀释过程,溶液导电能力变化如图所示,则a、b、c三点对应溶液中,醋酸电离程度由大到小的顺序是(填字母)。用湿润的pH试纸测定b点pH,结果(填“偏大”、“偏小”或“准确”)。
(2)、研究稀释过程pH变化。25℃时,用pH计测定不同浓度醋酸溶液的pH,结果如下:
序号
①
②
③
④
⑤
醋酸浓度(mol/L)
0.0010
0.01000
0.0200
0.1000
0.2000
pH
3.88
3.38
3.23
2.88
2.83
根据表中数据,稀释醋酸溶液,电离平衡(填“正”或“逆”)向移动;结合表中数据得出判断理由是
(3)、对比强、弱酸的性质。构建模型可帮助理解问题。盐酸和醋酸的“冰山”理解模型如下图,回答问题:

①模型1表示的是(填序号)。
A.等浓度的盐酸和醋酸 B.等pH的盐酸和醋酸溶液
②等体积,pH均为1的盐酸和醋酸溶液,中和NaOH的能力比较:盐酸 . 醋酸(填“>”、“<”或“=”)。
③模型2表示的两种溶液中分别加水,醋酸溶液中 , (填“增大”、“减小”或“不变”)
④过量镁粉分别与2mL 2mol/L盐酸、2mL 2mol/L醋酸溶液反应,测得铁粉与盐酸反应生成气体体积随时间变化如图,在图中画出镁粉与醋酸溶液反应的图像。
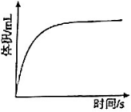
-
17、物质在水中存在电离平衡、水解平衡。请根据所学知识回答:
①0.1 溶液
②0.1 混合溶液
(1)、盐碱地(含较多、NaCl)不利于植物生长,盐碱地呈碱性的主要原因:(用离子方程式说明);(2)、溶液①中微粒的电荷守恒关系式是;离子浓度大小关系。(3)、溶液②中微粒的物料守恒关系式是。(4)、溶液的pH<7,则溶液中(5)、①把溶液蒸干、灼烧,最后得到的主要固体是。②配制溶液时需向溶液中加少量的(填化学式)以抑制水解。
(6)、泡沫灭火器有效成分为与 , 泡沫灭火使用时发生反应(用离子方程式表示)。(7)、25℃时,有pH=4的盐酸和pH=4的溶液中由水电离出的之比为。 -
18、在常温下,有关下列4种溶液的叙述中错误的是( )
编号
①
②
③
④
溶液
氨水
NaOH溶液
氢氟酸
盐酸
pH
11
11
3
3
A、在溶液①、②中分别加入适量的氯化铵晶体后,两种溶液的pH均减小 B、分别加水稀释10倍,四种溶液的pH:①>②>④>③ C、将a L溶液④与b L溶液②混合后,若所得溶液的pH=4,则a∶b=11∶9 D、将溶液①、④等体积混合,所得溶液中: -
19、常温下,向20mL 0.01 溶液中逐滴加入0.01的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法正确的是( )
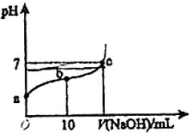 A、a点的pH=2 B、可以选甲基橙指示滴定终点 C、反应过程中,的值不断增大 D、c点时,
A、a点的pH=2 B、可以选甲基橙指示滴定终点 C、反应过程中,的值不断增大 D、c点时, -
20、向浓度为0.1 溶液中加入少量固体,下列各量减小的是( )A、 B、 C、 D、