相关试卷
-
1、奥培米芬是一种雌激素受体调节剂,下列说法正确的是( )
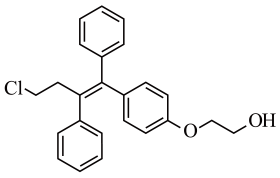 A、属于芳香烃 B、存在3种官能团 C、含有-OH等亲水基团,具有较好的水溶性 D、在KOH醇溶液或浓硫酸中加热均能发生消去反应
A、属于芳香烃 B、存在3种官能团 C、含有-OH等亲水基团,具有较好的水溶性 D、在KOH醇溶液或浓硫酸中加热均能发生消去反应 -
2、下列离子方程式书写正确的是( )A、MgSO4与Ba(OH)2溶液反应:Ba2++=BaSO4↓ B、FeCl3溶液刻蚀电路铜板:2Fe3++3Cu=2Fe+3Cu2+ C、在Ca(HCO3)2溶液中加入过量澄清石灰水:Ca2+++OH-=CaCO3↓+H2O D、向苯酚钠溶液中通入少量CO2:2
 +CO2+H2O→2
+CO2+H2O→2 +
+
-
3、下列说法正确的是( )A、如果苯酚浓溶液沾到皮肤,应立即用酒精洗 B、糖类都能发生水解反应,但各自水解的产物不相同 C、汽油和植物油都属于烃类,所以汽油和植物油都可以燃烧 D、向2mL蛋白质溶液中加入适量饱和硫酸铵溶液,产生沉淀,说明蛋白质发生了变性
-
4、设NA为阿伏加德罗常数的值,下列说法正确的是( )A、1molCH3COOH中含有的σ键数目为8NA B、0.01mol/LBaCl2溶液含有的Ba2+数目为0.01NA C、加热条件下,3.2g铜与足量浓硫酸充分反应生成的SO2分子数目为0.05NA D、0.1molFeCl3加入沸水中充分反应,生成的Fe(OH)3胶体粒子的数目为0.1NA
-
5、硼氢化钾制备纳米铜粉的反应方程式为:Cu2++2+6H2O=Cu+2HBO3+7H2↑,已知反应前后B元素价态不变。下列说法不正确的是( )A、还原剂是KBH4 B、还原产物是H2 C、生成3.2g铜时共转移0.4mol电子 D、若用Ag+替换Cu2+参加反应,可能制得纳米银粉
-
6、下列说法不正确的是( )
 A、图①装置可用于加热分解NaHCO3固体 B、图②装置可通过喷泉现象证明氨气极易溶于水 C、图③装置可用于探究温度对化学平衡移动的影响 D、图④装置可用于测定中和反应的反应热
A、图①装置可用于加热分解NaHCO3固体 B、图②装置可通过喷泉现象证明氨气极易溶于水 C、图③装置可用于探究温度对化学平衡移动的影响 D、图④装置可用于测定中和反应的反应热 -
7、物质的性质决定用途,下列两者对应关系不正确的是( )A、Al(OH)3有弱碱性,可用于治疗胃酸过多 B、生铁硬度大、抗压性强,可用于铸造机器底座 C、稀硝酸有强氧化性,可清洗附着在试管内壁的银镜 D、单晶硅是良好的半导体材料,常用于制备光导纤维
-
8、过氧化钠是一种常用的化工试剂,下列说法不正确的是( )A、过氧化钠属于氧化物 B、过氧化钠可由钠和氧气反应制得 C、过氧化钠可用作呼吸面具中的氧气来源 D、过氧化钠在工业上常用于制备氢氧化钠
-
9、下列化学用语表示正确的是( )A、HClO的结构式:H-Cl-O B、有机物(CH3CH2)2CHCH3的名称:3-甲基戊烷 C、乙二酸的实验式:C2H2O4 D、基态氧原子的轨道表示式:

-
10、电解质对维持人体健康具有诸多作用,下列物质属于电解质的是( )A、SiO2 B、C2H5OH C、KCl D、Cu
-
11、三氧化碳的回收及综合利用越来越受到国际社会的重视,将二氧化碳转化为高附加值化学品是目前研究的热点之一。利用和合成甲醇,在催化剂作用下可发生如下两个平行反应。
反应I:
反应Ⅱ:
请回答:
(1)、有利于提高甲醇平衡产率的条件是____。A、低温低压 B、低温高压 C、高温低压 D、高温高压(2)、反应的(3)、我国科研人员研究了在催化剂上加氢制甲醇过程中水的作用机理,其主反应历程如图(),下列说法正确的是____。 A、使用更高效的催化剂能提高甲醇的平衡产率 B、第④步的反应式为 C、加氢制甲醇符合绿色化学理念 D、若实验前用少量水对催化剂进行预处理,可能提升甲醇产率(4)、在催化剂下,向恒容密闭容器充入一定量及 , 起始和平衡时各组分的量如下:
A、使用更高效的催化剂能提高甲醇的平衡产率 B、第④步的反应式为 C、加氢制甲醇符合绿色化学理念 D、若实验前用少量水对催化剂进行预处理,可能提升甲醇产率(4)、在催化剂下,向恒容密闭容器充入一定量及 , 起始和平衡时各组分的量如下:总压/
起始/
10
3.0
0
0
0
平衡/
p
若反应均达平衡时, , 则表中;若此时 , 则反应I的平衡常数(无需带单位,用含总压p的式子表示)。
(5)、一定比例的合成气在装有催化剂的反应器中反应 , 体系中甲醇的产率和催化剂的催化活性与温度的关系如下图所示,此温度范围内,催化剂活性不受影响
①当温度高于后,甲醇产率减小的原因可能是。
②请在图中画出甲醇平衡产率随温度变化的曲线图。
-
12、工业上纳米的制备过程是以为载体,用和水蒸气反应生成 , 再控制温度生成纳米 , 测定产物组成的方法如下:
步骤一:取样品用稀硫酸充分溶解得到溶液,再用足量铝将还原为 , 过滤并洗涤,将所得滤液和洗涤液混合并注入容量瓶,定容得到待测液。
步骤二:取待测液于锥形瓶中,加入几滴指示剂,用的标准溶液滴定,将氧化为 , 三次滴定测得数据记录如下:
实验编号
待测溶液的体积/mL
滴定前标准液的体积读数/mL
滴定后标准液的体积读数/mL
1
25.00
0.20
24.22
2
25.00
1.21
29.21
3
25.00
150
25.48
回答下列问题:
(1)、若对步骤一所得的溶液加水稀释,溶液中会产生少量偏钛酸沉淀,写出该反应的离子方程式。(2)、上述滴定实验中,可选择为指示剂,判断到达滴定终点的方法是。(3)、下列关于滴定分析的操作,错误的是____。A、滴定时要适当控制滴定速率 B、用量筒量取待测液转移至锥形瓶 C、滴定时应一直观察滴定管中溶液体积的变化 D、平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下 E、在接近终点时,滴加药品应慢慢控制滴定管,使滴定管尖嘴悬挂一滴液体,用锥形瓶内壁将其靠下,并用蒸馏水将其冲入锥形瓶内。(4)、通过分析、计算,该样品的组成为;若滴定前滴定管尖端有气泡,滴定过程中气泡消失,则测得比实际值(填“偏大”、“偏小”或“无影响”)。 -
13、工业合成氨是20世纪的伟大成就之一,但化肥的过度使用、硝酸工业废气和动车尾气的排放,给水体和大气带来了一定程度的污染,需要进行综合处理。(1)、工业合成氨反应为: kJ·mol , 下列说法正确的是____。A、采用高温以提高反应的平衡转化率 B、采用高压以加快反应速率,提高的产量 C、为提高转化率,可适当增大的浓度 D、生产过程中将液化分离,有利于氨的合成(2)、一种电化学合成氨的原理如图所示。产生的电极反应式是。
 (3)、Ⅱ.含氮污染的处理
(3)、Ⅱ.含氮污染的处理水体中氨氮处理:在微生物作用下,废水中经两步反应被氧化成:
kJ·mol
kJ·mol
则全部氧化成的热化学方程式是。
(4)、大气中NO处理:电解NaCl溶液(调节起始pH约为9)获得NaClO溶液,可用于去除大气中NO。其他条件相同,电解所得溶液中相关成分的浓度与电流强度的关系如图所示。
①用电解所得NaClO溶液氧化NO生成和 , 其离子方程式为。
②电流强度大于4A,随着电流强度增大,电解所得溶液对NO去除率下降,其原因是。
-
14、雄黄(As4S4)、雌黄(As2S3)均可入药,具有解毒、杀菌、去燥湿的功效,也是中国画主要的黄色矿物质颜料。回答下列问题:(1)、基态硫原子核外电子的空间运动状态有种;其核外电子运动最高能级的电子云轮廓图的形状为。(2)、基态砷原子的价层电子的轨道表示式为。(3)、第一电离能AsSe(填“>”或“<”)。(4)、基态原子的N能层有1个未成对电子,M能层未成对电子数最多的元素是(填元素符号,下同),其价层电子排布式为。该元素处于周期表的区。
-
15、下列实验操作、现象及结论均正确是( )
选项
操作和现象
结论
A
常温下,用pH计分别测定等体积溶液和溶液的pH,pH均为7
两种溶液中水的电离程度相同
B
向2mL的KI溶液中滴加2mL的溶液,充分反应后加入2mL , 取上层溶液滴加KSCN溶液,溶液变红色
与KI的反应存在限度
C
向溶有的的溶液中通入气体X,出现白色沉淀
X具有强氧化性
D
向2mL溶液中滴入3滴NaOH溶液,再滴入4滴溶液,先产生白色沉淀,后产生红褐色沉淀
同温度下的:
A、A B、B C、C D、D -
16、我国科学家研究化合物催化氢化生成甲酸的机理,其中由化合物生成化合物过程的机理和相对能量曲线如下图所示。均为过渡态。下列说法正确的是( )
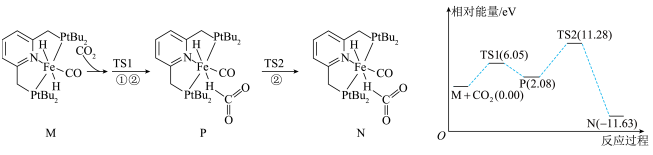 A、过渡态TS1比化合物Р更稳定 B、过程M→P为化合物M生成化合物N的决速步骤 C、化合物M催化氢化生成甲酸的反应过程中一定有键的生成和断裂 D、由生成的热化学方程式:
A、过渡态TS1比化合物Р更稳定 B、过程M→P为化合物M生成化合物N的决速步骤 C、化合物M催化氢化生成甲酸的反应过程中一定有键的生成和断裂 D、由生成的热化学方程式: -
17、已知:T℃时,Ksp(CaSO4)=4.0×10-6、Ksp(CaCO3)=4.0×10-9、Ksp(PbCO3)=8.4×10-14 , 三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是( )
 A、a线是CaSO4沉淀溶解平衡曲线 B、T℃时,向0.001mol CaCO3沉淀中加入Na2SO4溶液(反应后溶液为1L),使CaCO3沉淀会转化为CaSO4沉淀,所需Na2SO4的物质的量至少为1.001mol C、T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中= D、若d点表示CaCO3的饱和溶液加入CaSO4饱和溶液等体积混合则:c()<c(Ca2+)<c(SO)
A、a线是CaSO4沉淀溶解平衡曲线 B、T℃时,向0.001mol CaCO3沉淀中加入Na2SO4溶液(反应后溶液为1L),使CaCO3沉淀会转化为CaSO4沉淀,所需Na2SO4的物质的量至少为1.001mol C、T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中= D、若d点表示CaCO3的饱和溶液加入CaSO4饱和溶液等体积混合则:c()<c(Ca2+)<c(SO) -
18、“类比”是预测物质性质与化学反应的重要方法之一,但“类比”不能违背客观事实,下列“类比”合理的是( )A、Na2O2与CO2反应生成Na2CO3和O2 , 则Na2O2与SO2反应生成Na2SO3和O2 B、Na在空气中燃烧生成Na2O2 , 则同族的Li在空气中燃烧也生成Li2O2 C、Al(OH)3溶于NaOH溶液生成Na[Al(OH)4],则Be(OH)2也能溶于NaOH溶液生成Na2[Be(OH)4] D、Al3+与S2﹣在水溶液中因水解无法大量共存,则Fe3+与S2﹣在水溶液中也因水解无法大量共存
-
19、NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质的称量以及用NaOH溶液滴定等操作。下列有关说法中正确的是( )
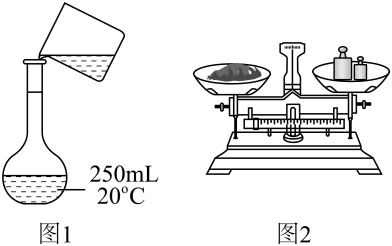
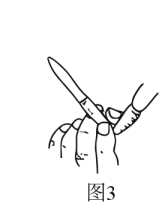
 A、用图1所示操作转移NaOH溶液到容量瓶中 B、用图2所示装置准确称得固体 C、用图3所示操作排出碱式滴定管中的气泡 D、用图4所示装置以NaOH待测液滴定
A、用图1所示操作转移NaOH溶液到容量瓶中 B、用图2所示装置准确称得固体 C、用图3所示操作排出碱式滴定管中的气泡 D、用图4所示装置以NaOH待测液滴定 -
20、相同金属在其不同浓度盐溶液中可形成浓差电池。如图所示装置是利用浓差电池电解Na2SO4溶液(a、b电极均为石墨电极),可以制得O2、H2、H2SO4和NaOH.下列说法正确的是( )
 A、电池放电过程中,Cu(2)作正极,电极反应为Cu2++2e-═Cu B、c、d离子交换膜依次为阳离子交换膜和阴离子交换膜 C、b为电解池的阴极,电极反应为2H2O+2e-═H2↑+2OH- D、电池从开始工作到停止放电,电解池理论上可制得80gNaOH
A、电池放电过程中,Cu(2)作正极,电极反应为Cu2++2e-═Cu B、c、d离子交换膜依次为阳离子交换膜和阴离子交换膜 C、b为电解池的阴极,电极反应为2H2O+2e-═H2↑+2OH- D、电池从开始工作到停止放电,电解池理论上可制得80gNaOH