相关试卷
-
1、某种离子液体的结构如图所示,X、Y、Z、M、Q为原子序数依次增大的短周期元素,Z的原子序数等于X、Y原子序数之和,Q为非金属性最强的元素。
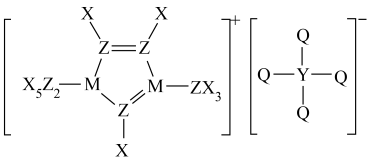
下列说法正确的是( )
A、氢化物的沸点: B、基态原子未成对电子数: C、简单离子半径: D、基态原子第一电离能由大到小的顺序为: -
2、下列说法一定正确的是( )A、25℃时,向溶液中加入的NaOH溶液,当水电离出的时,滴加氢氧化钠溶液的体积可能出现两种情况,则HA为弱酸 B、常温下,将pH=2的一元酸HA溶液与pH=12的一元碱BOH溶液等体积混合,所得溶液pH=7 C、相同温度下,的NaCl溶液和的NaCN溶液中的离子总数相等 D、将冰醋酸加水稀释,冰醋酸的电离度逐渐增加,但电离常数Ka不变,逐渐增大,导电性逐渐增强
-
3、根据杂化轨道理论和价层电子对互斥模型判断,下列说法不正确的是( )
选项
粒子
中心原子杂化方式
VSEPR模型
空间结构
A
直线形
直线形
B
四面体形
三角锥形
C
四面体形
平面三角形
D
四面体形
三角锥形
A、A B、B C、C D、D -
4、下列依据热化学方程式得出的结论正确的是( )A、已知 , 则氢气的燃烧热为 B、在一定温度和压强下,将和置于密闭容器中充分反应生成 , 放出热量19.3kJ,则其热化学方程式为 C、已知酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 D、已知 , 虽然该反应为可逆反应,但该反应的焓变仍可通过一定的实验方法直接测得
-
5、下列说法正确的是( )A、恒温恒容下, , 当混合气体的密度不再发生变化时,能表明该反应达到平衡状态 B、恒温恒容下,达到平衡,移走部分N,平衡向正反应方向移动 C、 , 反应达至平衡后,升温,则反应速率和的平衡转化率均增大 D、实验室制氢气,为了加快反应速率,可在稀硫酸中加少量固体
-
6、下列各组分子或离子中所有原子都可能处于同一平面的是( )A、、、 B、、、 C、、、 D、、、+
-
7、下列有关比较正确的是( )A、熔点: B、熔、沸点:NaBr>NaCl>MgO C、酸性: D、热稳定性:
-
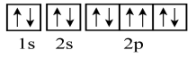
8、下列说法或有关化学用语的表达正确的是( )A、能级能量大小关系: B、基态铜原子(29Cu)的价层电子排布式: C、处于激发态的电子排布式可能为: D、基态的轨道表示式:
-
9、有5种元素X、Y、Z、Q、T。X原子M电子层上p能级有2个未成对电子且无空轨道;Y原子的价层电子排布式为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )A、元素Y和Q可形成化合物Y2Q3 B、简单离子半径:T>X>Q C、的中心原子价层电子对数为3 D、XQ2的空间结构是V形
-
10、下列物质的水溶液在空气中小心加热蒸干至质量不再减少,能得到较纯净的原溶质的是( )
① ② ③ ④ ⑤ ⑥
A、全部 B、仅①② C、仅①⑤ D、仅① -
11、下列离子方程式书写正确的是( )A、NaHCO3溶液的水解: B、向溶液中通入少量SO2: C、向溶液中滴加Na2CO3溶液: D、向CaCl2溶液中通入CO2:
-
12、下列说法错误的是( )A、下列离子在溶液中能大量共存:Al3+、Na+、S2﹣、NO B、为保存FeCl3溶液,要在溶液中加入少量盐酸 C、实验室盛放Na2CO3 , Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞 D、相同浓度的NaX、NaY、NaZ的溶液,其pH依次增大则HX、HY、HZ的酸性依次减弱
-
13、下列生活中常用的方法,其原理与盐类的水解反应有关的是( )A、用草木灰去除油污 B、用氢氢化铝中和过多胃酸 C、用食盐腌制腊肉 D、用白醋清洗水壶中的水垢
-
14、下列说法正确的是( )A、铜元素位于元素周期表的d区 B、中子数为32的铁原子: C、的空间结构为三角锥形 D、Cl-Cl的键电子云图形为:

-
15、下列粒子对水的电离没有影响的是( )A、CH3COOH B、
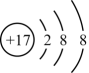 C、M3+:1s22s22p6
D、
C、M3+:1s22s22p6
D、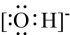
-
16、利伐沙班是一种新型抗凝血药物,其合成路线如下:
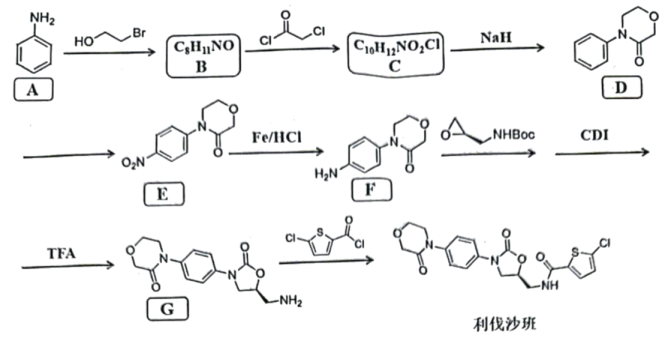
已知:
回答下列问题:
(1)、化合物A含有的官能团的名称是。(2)、下列说法不正确的是____。A、D→E的反应条件是浓硝酸、浓硫酸、加热 B、F的分子式为 C、G中含有2个手性碳原子 D、G→利伐沙班的反应类型为加成反应,(3)、写出B的结构简式。(4)、写出C→D的化学方程式。(5)、利用以上合成路线中的信息,设计以苯和乙烯为原料合成 的路线(用流程图表示,无机试剂任选)。 (6)、写出符合下列条件的D的同分异构体。
的路线(用流程图表示,无机试剂任选)。 (6)、写出符合下列条件的D的同分异构体。①分子中含有苯环,且与N原子直接相连;
②能发生银镜反应;
③谱和IR光谱表明:分子中共有4种不同化学环境的氢原子,不存在
 结构。
结构。 -
17、配合物乙二胺四乙酸铁钠可溶于水,常用于铁强化盐某实验小组按如下流程制备 (Y表示乙二胺四乙酸根):

已知:①
②在250℃时完全分解,其溶解度20℃时为、80℃时为
③;;;
请回答:
(1)、步骤Ⅱ所得固体的化学式为。步骤Ⅲ采用如图实验装置,其中仪器③的名称是; (2)、下列说法不正确的是____。A、步骤Ⅰ中氨水应当分批加入,避免沉淀中裹入过多杂质 B、步骤Ⅳ中为得到更多产品,应加入过量饱和溶液 C、步骤Ⅴ中结晶时应将溶液浓缩至溶液表面出现晶膜,停止加热,冷却结晶 D、步骤Ⅴ中为使产品干燥充分,应当采用酒精灯加热烘干(3)、判断步骤Ⅱ中沉淀是否洗涤干净的实验操作为。(4)、市售铁强化盐中含有 , 其中。称取mg样品,加稀硫酸溶解后配成溶液。取出 , 加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用标准溶液滴定,重复操作2~3次,消耗标准溶液的平均值为VmL。
(2)、下列说法不正确的是____。A、步骤Ⅰ中氨水应当分批加入,避免沉淀中裹入过多杂质 B、步骤Ⅳ中为得到更多产品,应加入过量饱和溶液 C、步骤Ⅴ中结晶时应将溶液浓缩至溶液表面出现晶膜,停止加热,冷却结晶 D、步骤Ⅴ中为使产品干燥充分,应当采用酒精灯加热烘干(3)、判断步骤Ⅱ中沉淀是否洗涤干净的实验操作为。(4)、市售铁强化盐中含有 , 其中。称取mg样品,加稀硫酸溶解后配成溶液。取出 , 加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用标准溶液滴定,重复操作2~3次,消耗标准溶液的平均值为VmL。①滴定终点的现象为。
②样品中铁元素的质量分数为。
-
18、环境保护与绿色发展是新时代人们关心的共同话题。NO是大气主要污染物,因此对工业烟气脱硝是工业生产中的重要一环。煤燃烧排放的烟气含有NO,脱除的方法有多种。(1)、目前常见方法是采用溶液液相氧化法脱除烟气中的NO,其主要过程如下:
Ⅰ.
Ⅱ.
①NO(aq)转化为HNO3(aq)的热化学方程式。
②为提高NO脱除率,工业上常向NaClO溶液中加入稀硫酸调节 , 溶液初始与NO的脱除率如下表所示。
初始
3.5
4.5
5.5
6.5
7.5
NO脱除率
91%
88%
83%
65%
51%
影响NO脱除率的原因是。
(2)、理论上可采用加热使NO分解的方法处理:。①该反应的平衡常数表达式为;
②已知该反应的正反应活化能为 , 逆反应的活化能为;正反应熵变为。实际反应时发现加热至600℃时NO仍没有明显分解,请结合上述数据解释原因。
(3)、近期科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C-OH,其电离平衡可表示为),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):预氧化:
预氧化:
预氧化:
吸附:
NO吸附实验在25℃下进行,将一定比例的与NO混合气体在恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图像中“原始-C”表示未经处理的活性炭),获得“NO捕获率-通气时间”的变化图:

已知:
①下列描述正确的是。
A.25℃下原始-C在通气约175分钟后吸附效果超过了
B.若其他条件不变,增大混合气体中物质的量分数,吸附平衡会正向移动
C.在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
D.升高温度,等量活性炭催化剂吸附的NO分子总数会减少
②相比其他预氧化试剂处理的活性炭,吸附效果更佳,有研究者认为可能是引入了 , 增强了活性炭的表面活性。试利用勒夏特列原理予以解释。
-
19、高氯酸三碳酰肼合镍(GTN)的组成可表示为 , 其中CHZ为碳酰肼(结构简式为:
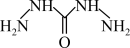 )。已知(羟胺)具有类似于的碱性。
)。已知(羟胺)具有类似于的碱性。
请回答:
(1)、请用方程式解释羟胺水溶液呈碱性。工业上常用尿素和溶液反应实现转化2得到和两种常见钠盐,反应的化学方程式为。(2)、下列有关说法正确的是____。A、均只含极性键 B、与过量硫酸溶液反应形成酸式盐的化学式为 C、的碱性依次减弱 D、是一种无机酸酯,转化3发生的是取代反应(3)、酸性强弱:( )(
)( )(填“>”“=”或“<”),请从结构角度解释原因。 (4)、与反应生成固体产物中除了尿素还有另外一种盐,设计实验证明该固体产物中的N元素。
)(填“>”“=”或“<”),请从结构角度解释原因。 (4)、与反应生成固体产物中除了尿素还有另外一种盐,设计实验证明该固体产物中的N元素。 -
20、Li、B、C、Ga等元素的单质或化合物在很多领域有广泛的应用。请回答:(1)、基态原子的价电子排布式为。(2)、一种含B化合物可用作吸附材料,其化学式为 , 部分晶体结构如图1所示,其中为平面结构。

下列说法不正确的是____。
A、基态原子的第一电离能: B、基态原子未成对电子数: C、该晶体中存在的化学键有离子键、共价键、配位键、氢键 D、晶体中B、C、N和O原子轨道的杂化类型分别为(3)、比较键角大小:(填“>”“=”或“<”),并说明理由。(4)、一种锂离子电池负极材料为两层石墨层中嵌入 , 形成如图2所示的晶胞结构。该物质的化学式可以表示为 , 的配位数为。