相关试卷
-
1、探究硫及其化合物的性质,下列实验操作、现象和结论或解释均正确的是( )
选项
实验方案
现象
结论或解释
A
用试纸测定等物质的量浓度的和溶液的
前者大
非金属性:
B
将溶于水,进行导电性实验
溶液可导电
由此可证明中含有离子键
C
浓硫酸与过量Cu充分反应后,加入固体
Cu继续溶解并产生红棕色气体
硫酸有剩余
D
将足量通入溶液中,逸出的气体依次通入足量酸性溶液、澄清石灰水
酸性溶液颜色变浅,澄清石灰水变浑浊
A、A B、B C、C D、D -
2、25℃下,在含一定质量Mg(OH)2的悬浊液中,分6次快速注入等量盐酸,体系pH变化曲线如图。下列说法不正确的是( )
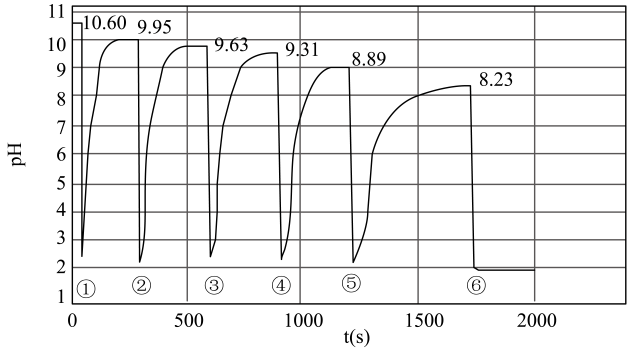 A、由图可知,酸碱中和反应速率大于Mg(OH)2沉淀溶解速率 B、第6次加入盐酸时,Mg(OH)2沉淀消耗完全 C、由图可知Ksp[Mg(OH)2]=5×10-32.8 D、上述过程中Mg(OH)2沉淀溶解平衡常数保持不变
A、由图可知,酸碱中和反应速率大于Mg(OH)2沉淀溶解速率 B、第6次加入盐酸时,Mg(OH)2沉淀消耗完全 C、由图可知Ksp[Mg(OH)2]=5×10-32.8 D、上述过程中Mg(OH)2沉淀溶解平衡常数保持不变 -
3、与反应能高选择性地生成甲醇。下图表示分别与反应体系的能量随反应进程的变化示意图(两者历程相似,图中以示例)。已知:直接参与化学键变化的元素被替换为更重的元素时,反应速率会变慢。下列说法正确的是( )
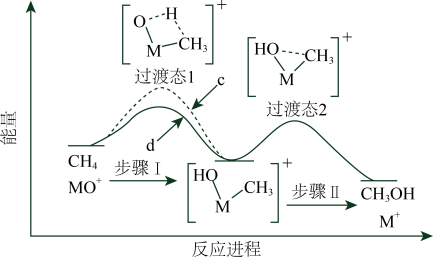 A、与反应的能量变化应为图中曲线d B、步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是Ⅱ C、与反应,氘代甲醇的产量: D、若与反应,生成的氘代甲醇有2种
A、与反应的能量变化应为图中曲线d B、步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是Ⅱ C、与反应,氘代甲醇的产量: D、若与反应,生成的氘代甲醇有2种 -
4、一种三室微生物燃料电池的工作原理如图所示,该电池能同时去除有机物、脱氮形成无害气体和水。下列说法不正确的是( )
 A、X、Y交换膜均为质子交换膜 B、电极室C中溶液经灭菌后通入电极室A C、b电极反应式: D、电极室C中仅发生还原反应
A、X、Y交换膜均为质子交换膜 B、电极室C中溶液经灭菌后通入电极室A C、b电极反应式: D、电极室C中仅发生还原反应 -
5、从海带中提取碘的实验过程如下图所示。下列说法不正确的是( )
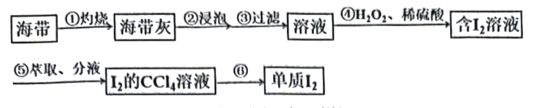 A、第①步会用到酒精灯、三脚架、泥三角、坩埚 B、第③步实现了海带灰中的可溶性硫酸盐、碳酸盐等与碘的分离 C、第④步发生反应的离子方程式为 D、第⑤步振荡萃取后上层溶液依然显黄色,可能的原因是第④步用量不足
A、第①步会用到酒精灯、三脚架、泥三角、坩埚 B、第③步实现了海带灰中的可溶性硫酸盐、碳酸盐等与碘的分离 C、第④步发生反应的离子方程式为 D、第⑤步振荡萃取后上层溶液依然显黄色,可能的原因是第④步用量不足 -
6、前四周期元素的原子序数依次增大,且都不在同一周期。X的s能级电子数比p能级电子数多1,Y的最高能级的单电子数是W的3倍,Z与W中的单电子数和最外层电子数均相同,但两者族序数不同。下列说法正确的是( )A、电负性: B、W与Z可以形成1:1型化合物 C、Z元素在周期表中的位置可能为第四周期VIB族 D、在同周期元素形成的最简单离子中,Y离子的半径最小
-
7、布洛芬为解热镇痛类非甾体抗炎药,其结构如图所示,下列说法正确的是( )
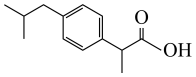 A、布洛芬属于芳香烃 B、1mol布洛芬最多可与加成 C、布洛芬分子中最多有12个碳原子共平面 D、布洛芬能使酸性高锰酸钾溶液褪色
A、布洛芬属于芳香烃 B、1mol布洛芬最多可与加成 C、布洛芬分子中最多有12个碳原子共平面 D、布洛芬能使酸性高锰酸钾溶液褪色 -
8、能正确表示下列反应的离子方程式是( )A、溶于HI溶液中: B、与等物质的量的反应: C、往苯酚钠溶液中通入少量:2
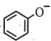 +CO2+H2O→2
+CO2+H2O→2 +CO
D、用溶解
+CO
D、用溶解
-
9、下列说法不正确的是( )A、实验室宜用饱和食盐水代替水与电石反应制取乙炔 B、牺牲阳极法是利用原电池原理保护设备 C、可用溶液鉴别苯、乙醇、乙酸 D、红外光谱可以测定有机物的元素组成及含量
-
10、蛋白质的四级结构如图所示,下列说法不正确的是( )
 A、氨基酸脱水缩合形成酰胺键得到肽链 B、肽链之间存在氢键,使肽链盘绕或折叠成特定空间结构 C、蛋白质也具有两性,既能与酸反应,又能与碱反应 D、向蛋白质溶液中加入稀溶液,能使蛋白质溶解度降低而析出
A、氨基酸脱水缩合形成酰胺键得到肽链 B、肽链之间存在氢键,使肽链盘绕或折叠成特定空间结构 C、蛋白质也具有两性,既能与酸反应,又能与碱反应 D、向蛋白质溶液中加入稀溶液,能使蛋白质溶解度降低而析出 -
11、已知为阿伏加德罗常数的值,下列说法正确的是( )A、固体溶于稀醋酸至溶液呈中性,的数目为 B、
 中含有键的数目为
C、0.1mol/L的溶液中
D、溶液中加入足量稀硫酸,生成的数目为
中含有键的数目为
C、0.1mol/L的溶液中
D、溶液中加入足量稀硫酸,生成的数目为
-
12、下述实验装置或试剂不正确的是( )

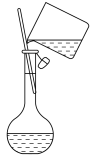
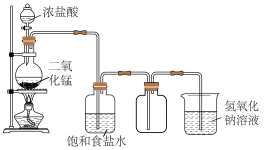
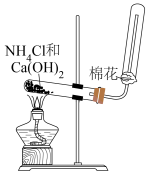
A.分离、
B.向容量瓶中转移溶液
C.制备干燥纯净的
D.实验室制取
A、A B、B C、C D、D -
13、物质的性质决定用途和保存方式,下列两者对应关系不正确的是( )A、见光易分解,浓硝酸用棕色瓶保存 B、具有强氧化性,可用于杀菌消毒 C、具有还原性,可用于漂白纸浆 D、难溶于稀盐酸,医学上常用作“钡餐”
-
14、是一种常见盐,下列说法不正确的是( )A、属于弱电解质 B、焰色试验显黄色 C、溶液呈碱性 D、属于离子晶体
-
15、下列化学用语表示正确的是( )A、HClO的电子式:
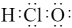 B、激发态N原子的价层电子轨道表示式:
B、激发态N原子的价层电子轨道表示式: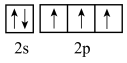 C、的价层电子对互斥模型:
C、的价层电子对互斥模型: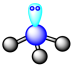 D、
D、 的名称:1,4-戊二烯
的名称:1,4-戊二烯
-
16、高分子材料是当代生产生活的重要物质基础。下列高分子材料通过加聚反应得到的是( )A、顺丁橡胶 B、聚酯纤维 C、酚醛树脂 D、聚酰胺纤维
-
17、某研究小组按下列路线合成镇静催眠药扎来普隆。
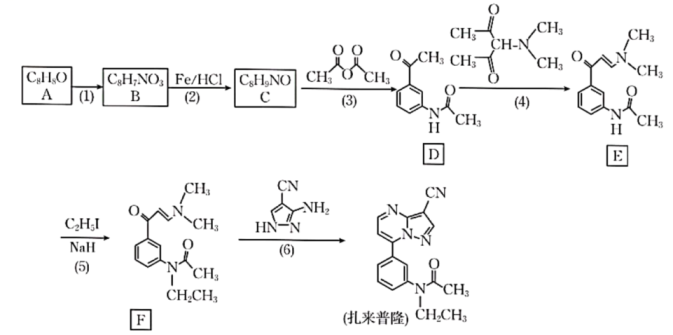
请回答:
(1)、下列说法不正确的是____。A、第(1)步中加入混酸试剂的顺序是浓硝酸、浓硫酸 B、化合物D中的含氧官能团是酮基和乙氧基 C、第(2)步反应类型是还原反应 D、1mol扎来普隆最多能消耗7mol氢气(2)、化合物A的结构简式是;扎来普隆的分子式是;化合物F生成扎来普隆的过程涉及多步反应,其反应类型有。(3)、写出E→F的化学方程式:。(4)、设计以苯和乙酸酐为原料合成止痛、退热药 的路线(用流程图表示,无机试剂任选):。 (5)、写出同时符合下列条件的化合物C的同分异构体的结构简式:。
的路线(用流程图表示,无机试剂任选):。 (5)、写出同时符合下列条件的化合物C的同分异构体的结构简式:。①谱和IR谱检测表明:分子结构苯环上只有2种不同化学环境的氢原子;
②分子中含有结构;
③能发生银镜反应。
-
18、亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,熔点:-64.5℃,沸点:-5.5℃,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可用下图装置由氯气与一氧化氮在常温常压下合成。
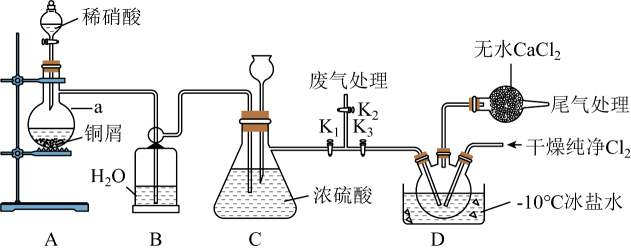
简要步骤如下:实验开始时,关闭 , 打开、 , 通入一段时间的氯气,直至三颈烧瓶中充满黄绿色气体,关闭 , 打开 , 打开分液漏斗塞子,向装置a中滴入适量稀硝酸。待装置C中某一现象发生时,关闭 , 打开 , 在三颈烧瓶中制备亚硝酰氯。
请回答:
(1)、写出铜与稀硝酸反应的离子方程式:。(2)、写出亚硝酰氯与NaOH溶液反应生成亚硝酸钠的化学方程式:。(3)、仪器a的名称是 , 装置B的作用是。(4)、步骤划线处,装置C出现的现象是。(5)、下列说法不正确的是____。A、从安全或避免环境污染方面考虑,宜在通风橱内进行实验 B、若不慎亚硝酰氯接触到皮肤,及时用流动清水反复冲洗 C、浓硫酸和无水仅起阻止水蒸气进入,避免亚硝酰氯水解的作用 D、冰盐水温度可达-10℃,装置D三颈烧瓶中充满黄色气体NOCl(6)、若制得的NOCl中含有少量杂质,为测定产品纯度进行如下实验:称取1.6625g样品溶于50.00mLNaOH溶液中,加入几滴溶液作指示剂,用足量硝酸酸化的溶液滴定至产生砖红色沉淀,消耗溶液50.00mL。则样品的纯度为%(保留1位小数)。 -
19、我国力争于2030年前完成碳达峰。2060年前实现碳中和,含碳化合物的合成与转化具有重要的研究价值和现实意义。(1)、Ⅰ.甲烷化反应是碳循环利用的重要路径之一。
甲烷化主反应:。
副反应:a.;
b.;
c.。
副反应b所生成的CO也能发生甲烷化反应,则化学方程式为。(2)、催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下,反应时间相同测得转化率和生成选择性随温度变化的影响如下图所示。
提示:甲烷的选择性是指转化为甲烷的在全部反应物中所占的比例。
高于320℃后,以为催化剂转化率略有下降,而以Ni为催化剂转化率仍在上升,其原因是。
(3)、二氧化碳甲烷化反应在某催化剂催化下的反应机理如图所示。下列叙述不正确的是。
A.氢气在Pd表面被吸附解离成氢原子
B.MgO是反应的中间体
C.图中碳元素的价态有多种
D.浊液加热生成
(4)、Ⅱ.甲醚()是重要的化工原料,可用CO和制得,热化学方程式为;。生产甲醚过程中存在副反应:。将反应物混合气按进料比通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别为如图1、图2所示。
图1中,温度一定,压强增大,甲醚选择性增大的原因是。 (5)、图2中,温度高于265℃后,甲醚选择性降低的原因是。(6)、向容积可变的密闭容器中充入mmolCO和在恒温恒压条件下发生反应: , 在图中画出CO的平衡转化率随温度、压强()的变化图。
(5)、图2中,温度高于265℃后,甲醚选择性降低的原因是。(6)、向容积可变的密闭容器中充入mmolCO和在恒温恒压条件下发生反应: , 在图中画出CO的平衡转化率随温度、压强()的变化图。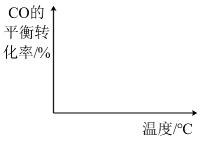
-
20、化合物X由三种元素组成,某实验小组按如下流程进行相关实验。
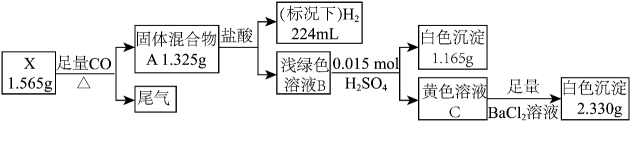 ;
;请回答:
(1)、组成X的三种元素为;X的化学式为。(2)、溶液B的溶质组成为(用化学式表示)。(3)、①写出由X转化为A的化学方程式:。②写出由B转化为C的离子方程式:。
(4)、设计简单实验,写出检验尾气中气体成分的方法:。