相关试卷
-
1、下列说法不正确的是( )A、科学家在盐碱地培育出优质水稻,稻米中含有的淀粉、蛋白质和脂肪都是高分子化合物 B、酶是一类由生物细胞产生的蛋白质或核酸,酶对生物体内的化学反应具有高效催化作用 C、寡糖中的十糖()不能被人体直接消化吸收,十糖可以作为糖尿病患者的甜味剂 D、氨基酸分子间能形成肽键,肽键中的氧原子与氢原子之间的氢键可形成蛋白质二级结构
-
2、化学与科学、社会、历史密切相关,下列叙述正确的是( )A、中国空间站核心舱有砷化镓半导体材料:位于周期表金属与非金属交界处 B、三星堆遗址出土大量铜器玉石,可通过断代法测玉石中含量来推测古蜀年代 C、明矾在一定条件下水解可生成胶体或浊液两种分散系,两种分散系互为同系物 D、螺环化合物(
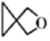 )可用于制造生物检测机器人,其二氯代物有4种(不考虑空间异构)
)可用于制造生物检测机器人,其二氯代物有4种(不考虑空间异构)
-
3、某些诗词中蕴含着丰富的化学知识,下列论述不正确的是( )A、“以曾青涂铁,铁赤色如铜”,涉及颜色变化和回收铜工艺 B、“东风扑酒香,吹醒殊乡愁”,涉及液体挥发并蕴涵酯化反应 C、“布衾(麻葛)多年冷似铁,娇儿恶卧踏里裂”,推测唐朝没有普及棉花种植 D、“五金(金银铜铁锡)元造化,九炼更精新”,自然界五金只能以化合态存在
-
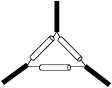
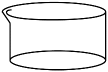
4、下列仪器的名称不正确的是( )
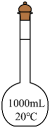

A容量瓶
B三脚架
C坩埚钳
D结晶皿
A、A B、B C、C D、D -
5、下列物质属于非电解质的是( )A、氯化镁 B、二氧化碳 C、碳酸氢钠 D、福尔马林
-
6、含有非极性键的离子化合物是( )A、 B、 C、 D、KOH
-
7、实验室以活性炭为催化剂,用CoCl2制取三氯化六氨合钴(Ⅲ){[Co(NH3)6]Cl3},装置如图所示。
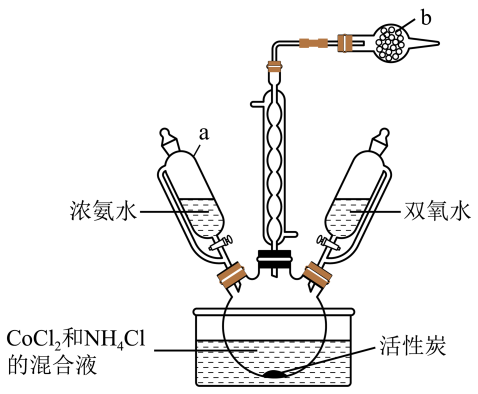
已知:
①[Co(NH3)6]2+具有较强还原性;溶液呈棕色
②。
回答下列问题:
(1)、仪器a使用恒压滴液漏斗的原因是;仪器b中的试剂是。(2)、产品制备:检查装置气密性并将CoCl2、NH4Cl和活性炭在三颈烧瓶中混合,滴加浓氨水,溶液变为棕色,NH4Cl的作用是;充分反应后缓慢滴加双氧水,水浴加热20min,该过程发生反应的离子方程式为。(3)、产品分离提纯:将反应后的混合物趁热过滤,待滤液冷却后加入适量浓盐酸,过滤、洗涤、干燥,得到[Co(NH3)6]Cl3晶体。该过程中趁热过滤的目的是。(4)、测定产品中NH3的含量。实验如下:①蒸氨:取0.5000g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热,蒸出的NH3通入含有V1mL c1mol·L-1 H2SO4标准溶液的锥形瓶中。
②滴定:用c2mol·L-1 NaOH溶液滴定剩余的H2SO4 , 消耗V2mL NaOH溶液。滴定时选用的指示剂为 , NH3的质量分数为;
③误差分析:下列操作使得NH3的质量分数偏大的有。
A.用 H2SO4吸收NH3操作缓慢,导致部分NH3外溢到空气中
B.NaOH溶液使用前敞口放置于空气中一段时间
C.滴定后读数,先平视后俯视
D.滴定读数后,发现滴定管尖嘴处还悬有一滴氢氧化钠溶液
-
8、2020年9月22日,中国政府在联合国大会上提出:“二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。”为了早日实现碳中和,CO2的综合利用也成为了我国科研的研究热点。(1)、Ⅰ. 目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步: ΔH>0
第二步: ΔH<0
定义:在热力学标准状态下,由指定单质生成1mol化合物的反应焓称为该化合物的标准摩尔生成焓,简称生成焓,符号为。已知:;;。在热力学标准状态下,CO2加氢合成乙烯的热化学方程式为。(2)、有利于提高乙烯平衡产率的条件是____(填标号)。A、高温高压 B、低温高压 C、高温低压 D、低温低压(3)、已知上述两步反应的平衡常数与T的关系如图一所示,则第二步反应的平衡常数为(填“K1”或“K2”) (4)、Ⅱ. CO2加氢合成甲醇也是化学固碳的一种有效途径,不仅可以有效减少空气中的CO2排放,而且还能制备出甲醇清洁能源。反应如下:
(4)、Ⅱ. CO2加氢合成甲醇也是化学固碳的一种有效途径,不仅可以有效减少空气中的CO2排放,而且还能制备出甲醇清洁能源。反应如下:主反应: ΔH1=-49 kJ⋅mol-1
副反应: ΔH2=+41kJ⋅mol-1
向刚性容器中充入投料比为1:3的CO2和H2 , 图二中横坐标为在催化剂TiO2条件下反应相同的时间,CO2转化率随温度升高而升高。纵坐标为在该时间内CH3OH选择性和CO选择性(CH3OH的选择性、CO的选择性)随CO2转化率的变化。
图二中CO2的转化率是否为对应温度下的平衡转化率(填“是”或“否”或“不一定”)。 (5)、若图二中CO2的转化率为对应温度下的平衡转化率,则CH3OH选择性降低的原因是。(6)、若图二中M点时[初始投料n(CO2)=1mol,n(H2)=3mol,容器体积为1L],整个体系已经达到平衡,此时CO2的转化率为50%,CH3OH的选择性为15%,则氢气的转化率α(H2)= (计算结果保留一位小数)。(7)、已知速率方程v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响,其对数lgk与温度的关系如图三所示,直线(填“A”或“B”)表示的是lgk正与温度的关系。
(5)、若图二中CO2的转化率为对应温度下的平衡转化率,则CH3OH选择性降低的原因是。(6)、若图二中M点时[初始投料n(CO2)=1mol,n(H2)=3mol,容器体积为1L],整个体系已经达到平衡,此时CO2的转化率为50%,CH3OH的选择性为15%,则氢气的转化率α(H2)= (计算结果保留一位小数)。(7)、已知速率方程v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响,其对数lgk与温度的关系如图三所示,直线(填“A”或“B”)表示的是lgk正与温度的关系。
-
9、已知:锂钴电池总反应:。过程如图:
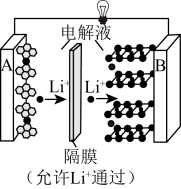 (1)、中,Co元素的化合价为。锂电池发生火灾时,和氧气发生反应的主要物质是(填“正”或“负”)极材料。充电时阳极的反应方程式是。(2)、锂电池成本高昂,废弃后需回收其中的锂和钴元素。先将上述锂电池进行放电处理,拆卸后,再将正极材料涂覆在铝箔上,进行电解,浸出和。装置如图所示,该条件下副反应忽略不计。
(1)、中,Co元素的化合价为。锂电池发生火灾时,和氧气发生反应的主要物质是(填“正”或“负”)极材料。充电时阳极的反应方程式是。(2)、锂电池成本高昂,废弃后需回收其中的锂和钴元素。先将上述锂电池进行放电处理,拆卸后,再将正极材料涂覆在铝箔上,进行电解,浸出和。装置如图所示,该条件下副反应忽略不计。
①拆卸前,将锂电池放电处理有利于锂在正极的回收,其原因是。
②石墨电极连接电源的极(填“正”或“负”)。
③结合电极反应,指出阴极室的pH变化并解释原因:。
(3)、当前,三元正极材料——镍钴锰酸锂应用广泛,其化学式可写作。可用、、、与空气混合加热烧结制得。写出制备的化学方程式:(设的计量系数为1)。 -
10、下列离子反应方程式正确的是( )A、Na与水反应: B、氢氧化钡溶液中加入少量碳酸氢钠溶液: C、醋酸除水垢: D、CuO与稀盐酸反应:
-
11、我国科学家成功合成了世界上首个含五氮阴离子的盐,局部结构如图,其中含有两种10e-离子、一种18e-离子。X、Y、Z、M为原子序数依次增大的短周期元素,且均不在同一族。下列说法不正确的是( )
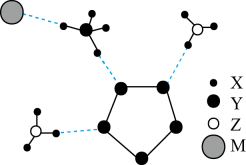 A、该物质中存在离子键、极性共价键和非极性共价键 B、X、Y、M与Z均至少能形成两种化合物 C、Y的最简单氢化物与其最高价氧化物的水化物反应生成的化合物属于离子化合物 D、Y、Z、M对应的最简单氢化物中沸点最高的是M
A、该物质中存在离子键、极性共价键和非极性共价键 B、X、Y、M与Z均至少能形成两种化合物 C、Y的最简单氢化物与其最高价氧化物的水化物反应生成的化合物属于离子化合物 D、Y、Z、M对应的最简单氢化物中沸点最高的是M -
12、由下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向某溶液中滴加几滴新制氯水,再滴加少量KSCN溶液,溶液变红
溶液中含有Fe2+
B
室温下,测得NaX和NaY溶液的pH分别为8和9
酸性:HX>HY
C
蔗糖溶液中加入少量稀硫酸,水浴加热5min,加氢氧化钠溶液至溶液呈碱性,再加入少量新制Cu(OH)2 , 继续加热5min,生成砖红色沉淀
蔗糖完全水解
D
向等体积等浓度的稀硫酸中分别加入少量等物质的量的ZnS和CuS固体,ZnS溶解而CuS不溶解
Ksp(ZnS)>Ksp(CuS)
A、A B、B C、C D、D -
13、硼碳氮(BCN)材料可用作耐磨涂层。下列说法正确的是( )A、原子半径: B、第一电离能: C、酸性强弱: D、硼、石墨、固态氮的晶体类型相同
-
14、设NA为阿伏加德罗常数的值。下列说法正确的是( )A、9.2g甲苯分子中含有碳碳双键的数目为0.3NA B、5.8g由NO和CO组成的混合气体中,原子总数为0.4NA C、标准状况下,22.4LO2与足量金属镁反应,转移的电子数为4NA D、0.1mol/L的CH3COONa溶液中CH3COO-和Na+的数目之和大于0.1NA
-
15、下列反应过程对应的离子方程式书写正确的是( )A、向NaClO溶液中通入过量SO2:SO2+ClO-+H2O=+HClO B、向氯化铝溶液中加入小苏打溶液:3+Al3+=Al(OH)3↓+3CO2↑ C、向NaHSO4溶液中加入NaHSO3溶液:+=+SO2↑+H2O D、向稀硝酸中加入FeCl2溶液:Fe2++2H++=Fe3++NO2↑+H2O
-
16、为克服传统的甲烷水蒸气重整制氢工艺中产生积碳和过多CO的缺点,科学家提出将传统的甲烷水蒸气重整分两步进行,即CH4催化裂解和催化剂消碳再生交替进行的循环制氢工艺(原理如图所示)。下列说法错误的是( )
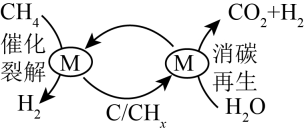 A、消碳再生过程涉及的反应之一为C+2H2OCO2+2H2 B、更换合适的催化剂,降低反应焓变,效果更好 C、每消耗1molCH4最多可产生4molH2 D、CHx为中间产物
A、消碳再生过程涉及的反应之一为C+2H2OCO2+2H2 B、更换合适的催化剂,降低反应焓变,效果更好 C、每消耗1molCH4最多可产生4molH2 D、CHx为中间产物 -
17、《本草述》冲记载了“芳草、山草”,其成分之一的结构简式如图。下列叙述错误的是( )
 A、该物质只含有三种官能团 B、该物质的分子式为C16H18O9 C、该物质能发生加成反应和取代反应 D、1mol该物质最多能消耗6molNa
A、该物质只含有三种官能团 B、该物质的分子式为C16H18O9 C、该物质能发生加成反应和取代反应 D、1mol该物质最多能消耗6molNa -
18、部分含氯物质的分类与相应化合价的关系如图所示。下列推理错误的是( )
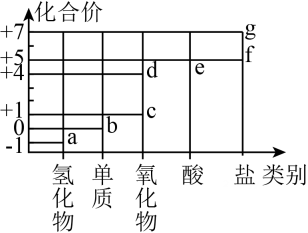 A、a与e反应可生成b B、d为酸性氧化物 C、c溶于水可生成HClO D、f、g中阴离子的VSEPR模型相同
A、a与e反应可生成b B、d为酸性氧化物 C、c溶于水可生成HClO D、f、g中阴离子的VSEPR模型相同 -
19、下列叙述正确的是( )。
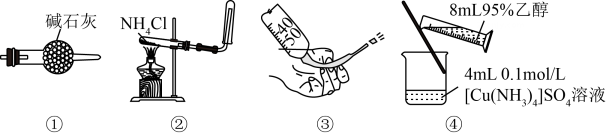 A、图①装置可用于干燥氯气 B、图②装置可用于制取氨气 C、图③操作可排出盛有溶液滴定管尖嘴内的气泡 D、图④装置可用于制备晶体
A、图①装置可用于干燥氯气 B、图②装置可用于制取氨气 C、图③操作可排出盛有溶液滴定管尖嘴内的气泡 D、图④装置可用于制备晶体 -
20、下列叙述正确的是( )。A、沸点: B、和的空间构型均为V形 C、分子中所有原子都满足8电子稳定结构 D、是含有极性键的非极性分子