相关试卷
-
1、南粤大地,岭南风情.下列岭南文化内容中蕴含的化学知识叙述错误的是( )
选项
A
B
C
D
文化类别
饮食文化
建筑文化
服饰文化
节日文化
文化内容
顺德姜汁撞奶(姜汁与牛奶混合使牛奶凝固)
珠海菉猗堂蚝壳墙
粤绣色彩富丽夺目,绣线种类繁多,独具匠心
揭阳烟花舞龙气势宏伟,景象壮观
化学知识
制作方法包含了胶体聚沉的原理
蚝壳的主要成分是
制作粤绣用的孔雀毛和马尾的主要成分都是纤维素
烟花利用了“焰色试验”原理,该变化属于物理变化
A、A B、B C、C D、D -
2、我国自主设计建造的亚洲第一深水导管架“海基一号”在广东珠海建造完工,开创了我国深海油气资源开发的新模式.下列有关说法正确的是( )A、“海基一号”成功从深海开采石油和天然气水合物,天然气属于新能源 B、深海开采勘察船采用的新型钛合金材料硬度大、韧性好,具有良好的抗压性能 C、石油的分馏和裂解都是化学变化 D、导管架海水浸泡区可采用镶嵌铜块的方法从而保障钢材不易被腐蚀
-
3、广东是岭南文化中心地、海上丝绸之路发祥地、中国近代民主革命策源地,拥有丰富的文化遗产资源.下列在广东发掘的珍贵文物中不是由硅酸盐材料制成的是( )
选项
A
B
C
D
文物




名称
台山红绿彩瓷片
南海Ⅰ号印花陶罐
博罗横岭山青铜鼎
五华狮雄山琉璃瓦当
A、A B、B C、C D、D -
4、某兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜的精炼原理,如图所示,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
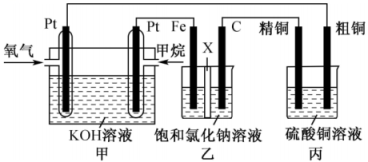 (1)、甲装置中通入氧气的电极是极(填“正”或“负”),丙装置中精铜电极发生的电极反应式为。(2)、乙装置中电解的总反应的离子方程式为 , 阳极产物为。(3)、如果粗铜中含有锌、银等杂质,反应一段时间后,丙装置中硫酸铜溶液浓度将(填“增大”、“减小”或“不变”)。(4)、丙装置中精铜电极的质量增加了6.4g,则甲装置中消耗的的质量为g,乙装置中铁电极上生成的气体在标准状况下体积为L。
(1)、甲装置中通入氧气的电极是极(填“正”或“负”),丙装置中精铜电极发生的电极反应式为。(2)、乙装置中电解的总反应的离子方程式为 , 阳极产物为。(3)、如果粗铜中含有锌、银等杂质,反应一段时间后,丙装置中硫酸铜溶液浓度将(填“增大”、“减小”或“不变”)。(4)、丙装置中精铜电极的质量增加了6.4g,则甲装置中消耗的的质量为g,乙装置中铁电极上生成的气体在标准状况下体积为L。 -
5、恒温下在2L密闭容器中,X、Y、Z三种气态物质的量随时间变化曲线如图。
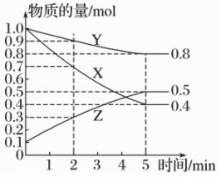 (1)、该反应的化学方程式为。(2)、从开始至5min,Y的平均反应速率为;平衡时,Z的物质的量浓度为 , X的转化率为。(3)、反应达平衡时体系的压强是开始时的倍。(4)、下列描述中能表明反应已达到平衡状态的是(填序号)。
(1)、该反应的化学方程式为。(2)、从开始至5min,Y的平均反应速率为;平衡时,Z的物质的量浓度为 , X的转化率为。(3)、反应达平衡时体系的压强是开始时的倍。(4)、下列描述中能表明反应已达到平衡状态的是(填序号)。①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤Z的物质的量浓度不变
⑥容器内X、Y、Z三种气体的浓度之比为3:1:2
⑦某时刻且不等于零 ⑧单位时间内生成2nmolZ,同时生成3nmolX
(5)、在某一时刻采取下列措施能加快反应速率的是____。A、加催化剂 B、降低温度 C、体积不变,充入X D、体积不变,从容器中分离出Y -
6、氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
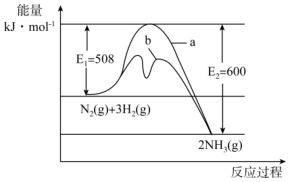 (1)、 根据图提供的信息,写出该反应的热化学方程式 , 在图中曲线(填“a”或“b”)表示加入铁触媒的能量变化曲线,判断理由是。(2)、在恒容容器中,下列描述中能说明上述反应已达平衡的是____。A、 B、单位时间内生成的同时生成 C、混合气体的密度不再改变 D、容器内压强不随时间的变化而变化(3)、一定温度下,向2L密闭容器中充入和 , 保持体积不变,0.5min后达到平衡,测得容器中有 , 则平均反应速率 , 该温度下的平衡常数。(小数点后保留3位有效数字)(4)、保持温度和体积不变,向上述平衡体系中再加入、、后该反应的速率大小关系为(填“大于”、“小于”或“等于”)。
(1)、 根据图提供的信息,写出该反应的热化学方程式 , 在图中曲线(填“a”或“b”)表示加入铁触媒的能量变化曲线,判断理由是。(2)、在恒容容器中,下列描述中能说明上述反应已达平衡的是____。A、 B、单位时间内生成的同时生成 C、混合气体的密度不再改变 D、容器内压强不随时间的变化而变化(3)、一定温度下,向2L密闭容器中充入和 , 保持体积不变,0.5min后达到平衡,测得容器中有 , 则平均反应速率 , 该温度下的平衡常数。(小数点后保留3位有效数字)(4)、保持温度和体积不变,向上述平衡体系中再加入、、后该反应的速率大小关系为(填“大于”、“小于”或“等于”)。 -
7、已知 键的键能约为413kJ/mol,键的键能约为463kJ/mol,键的键能约为436kJ/mol,则中键的键能约为( )A、797.5kJ/mol B、900.5kJ/mol C、962.5kJ/mol D、1595kJ/mol
-
8、将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )
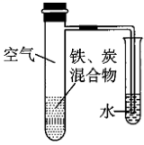 A、铁被氧化的电极反应式为 B、铁腐蚀过程中化学能全部转化为电能 C、活性炭的存在会加速铁的腐蚀 D、以水代替NaCl溶液,铁不能发生吸氧腐蚀
A、铁被氧化的电极反应式为 B、铁腐蚀过程中化学能全部转化为电能 C、活性炭的存在会加速铁的腐蚀 D、以水代替NaCl溶液,铁不能发生吸氧腐蚀 -
9、在如图所示的电解装置中,通电一段时间后向石墨电极II附近滴加石蕊溶液,出现蓝色,下列判断正确的是( )
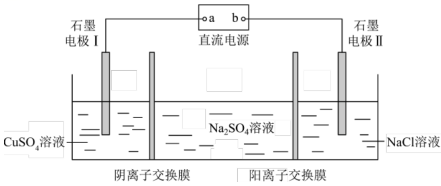 A、a是电源的正极 B、通电一段时间后,石墨电极I上有铜析出 C、石墨电极II附近溶液pH减小 D、通电一段时间后,溶液浓度增大
A、a是电源的正极 B、通电一段时间后,石墨电极I上有铜析出 C、石墨电极II附近溶液pH减小 D、通电一段时间后,溶液浓度增大 -
10、双极膜(BP)是阴、阳复合膜,在直流电作用下,阴、阳膜复合层间的解离成和。利用双极膜电渗析法和惰性电极电解食盐水可获得淡水、NaOH溶液和盐酸,其工作原理如下图所示,M、N为离子交换膜。下列说法错误的是( )
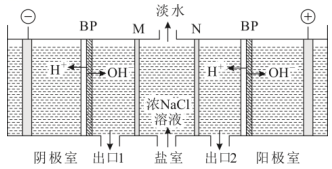 A、M膜为阳离子交换膜 B、出口2的产物是盐酸 C、若去掉双极膜(BP),阳极室会有生成 D、电路中每转移1mol电子,两极共得到0.5mol气体
A、M膜为阳离子交换膜 B、出口2的产物是盐酸 C、若去掉双极膜(BP),阳极室会有生成 D、电路中每转移1mol电子,两极共得到0.5mol气体 -
11、一种采用和为原料制备的装置示意图如下。
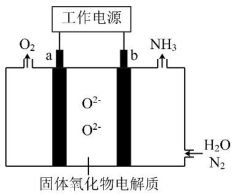
下列有关说法正确的是( )
A、在b电极上,被还原 B、金属Ag可作为a电极的材料 C、改变工作电源电压,反应速率不变 D、电解过程中,固体氧化物电解质中不断减少 -
12、中学阶级介绍的电解原理的应用主要有三种:一是氯碱工业、二是电解精炼铜、三是电解冶金。下列关于这三个工业生产的描述中正确的是( )A、电解精炼铜时,负极反应式: B、氯碱工业和电解精炼铜中,阳极都是氯离子放电放出氯气 C、在氯碱工业中,电解池中的阴极产生的是 , NaOH在阳极附近产生 D、电解精炼铜时,应用粗铜作阳极、精铜作阴极,可溶性铜盐作电解质溶液
-
13、下列热化学方程式书写正确的是( )A、燃烧的热化学方程式: B、 C、一定条件下,与充分反应生成放热 , 其热化学方程式为: D、已知:与反应生成时,放出184.6kJ的热量,则有:
-
14、利用下列实验装置不能达到实验目的的是( )
选项
A
B
C
D
目的
探究生铁在不同条件下的电化学腐蚀
测定中和反应的反应热
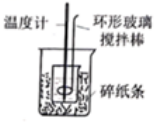
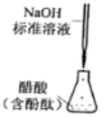
测定醋酸溶液的浓度
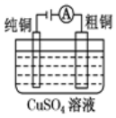
铜的电解精炼
实验装置
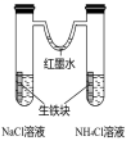
 A、A B、B C、C D、D
A、A B、B C、C D、D -
15、正丁烷催化裂解为乙烷和乙烯的反应历程如下(*代表催化剂):
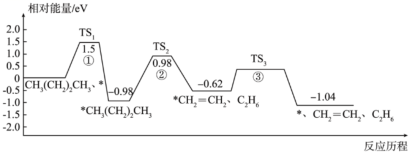
下列说法正确的是( )
A、使用催化剂能降低该反应的 B、过渡态、、中稳定性最强的是 C、正丁烷裂解生成乙烷和乙烯的反应为放热反应 D、正丁烷裂解生成乙烷和乙烯的决速步骤是反应① -
16、已知I容器恒压,II容器恒容,其它条件相同时,在I、II中分别加入3molZ,起始时容积相同,发生反应并达平衡.下列说法正确的是( )
 A、从起始到平衡所需时间: B、平衡后若在I中再加入2molZ,则新平衡时Z的体积分数变小 C、平衡时Z的转化率: D、平衡后若在I中再加入0.1molY,则X的物质的量将减少
A、从起始到平衡所需时间: B、平衡后若在I中再加入2molZ,则新平衡时Z的体积分数变小 C、平衡时Z的转化率: D、平衡后若在I中再加入0.1molY,则X的物质的量将减少 -
17、向体积均为1L的两个恒容密闭容器中分别充入2molX和1molY发生反应: , 其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示,下列说法正确的是( )
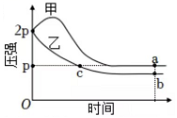 A、 B、气体总物质的量: C、a点平衡常数: D、反应速率:
A、 B、气体总物质的量: C、a点平衡常数: D、反应速率: -
18、对于可近反应: , 下列各图正确的是( )A、
 B、
B、 C、
C、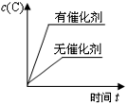 D、
D、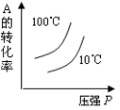
-
19、C和在生产、生活、科技中是非常重要的燃料。已知:① ②
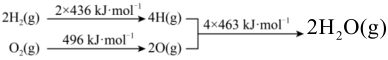
下列推断正确的是( )
A、C的燃烧热为 B、 , , 该反应是非自发反应 C、 D、将分解成和 , 至少需要提供的热量 -
20、羰基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害。在一定温度下的容积不变的密闭容器中发生反应:。下列叙述中,不能说明反应达到化学平衡状态的是( )A、的生成速率与的生成速率相等 B、单位时间内消耗amolCO,同时消耗 C、容器内气体的总压强不再变化 D、CO的浓度不再变化