相关试卷
-
1、煤的间接液化可先转化为一氧化碳和氢气,后在催化剂作用下合成甲醇,其中一氧化碳与氢气的反应历程如下图所示,吸附在催化剂表面上的物种用*标注。下列说法正确的是( )
 A、煤中含有苯和甲苯,可以通过分馏的方式将它们分离出来 B、该反应历程中决速步骤的活化能为1.6eV C、石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 D、虚线框内发生的化学反应方程式可能为H3CO*+H2=CH3OH*
A、煤中含有苯和甲苯,可以通过分馏的方式将它们分离出来 B、该反应历程中决速步骤的活化能为1.6eV C、石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 D、虚线框内发生的化学反应方程式可能为H3CO*+H2=CH3OH* -
2、在如图装置中,观察到图1装置铜电极上产生大量无色气泡,而图2装置中铜电极上无气泡产生,铬电极上产生大量有色气泡。下列叙述不正确的是( )
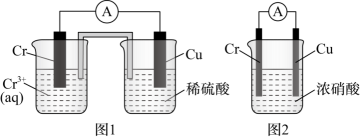 A、图1装置中 Cu 电极上电极反应式是 B、图2装置中 Cu 电极上发生的电极反应为 C、图2装置中 Cr电极上电极反应式为 D、两个装置中,电子均由 Cr电极经导线流向 Cu 电极
A、图1装置中 Cu 电极上电极反应式是 B、图2装置中 Cu 电极上发生的电极反应为 C、图2装置中 Cr电极上电极反应式为 D、两个装置中,电子均由 Cr电极经导线流向 Cu 电极 -
3、可逆反应aA(g)+bB(g) cC(g)+dD(g)△H同时符合下列两图中各曲线的是( )
 A、a+b>c+d T1>T2 △H>0 B、a+b>c+d T1<T2 △H<0 C、a+b<c+d T1>T2 △H>0 D、a+b<c+d T1<T2 △H<0
A、a+b>c+d T1>T2 △H>0 B、a+b>c+d T1<T2 △H<0 C、a+b<c+d T1>T2 △H>0 D、a+b<c+d T1<T2 △H<0 -
4、室温下,下列离子组在给定条件下能大量共存的是( )A、的溶液中: , 、、 B、pH=1的溶液中:、、、 C、的溶液中: , , 、 D、由水电离的的溶液中: , , 、
-
5、关于常温下pH为2的盐酸,下列叙述正确的是( )A、将10mL该溶液稀释至100mL后, B、向该溶液中加入等体积pH为12的氨水恰好完全中和 C、该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1 D、该溶液中由水电离出的 (H+)
-
6、对饱和AgCl溶液(有AgCl固体存在)进行下列操作后,c(Ag+)保持不变的是( )A、加少量水稀释 B、加热 C、加入少量浓盐酸 D、加入少量固体AgNO3
-
7、下列有关热化学方程式的叙述不正确的是( )A、在稀溶液中:H+(aq)+OH-(aq)=H2O(1) △H=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.3 kJ B、已知正丁烷(g)→异丁烷(g) △H<0,则异丁烷比正丁烷稳定 C、2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1 , 则H2的燃烧热为285.8 kJ·mol-1 D、已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2 , 则△H1>△H2
-
8、下列现象能用勒夏特列原理解释的是( )
①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②棕红色NO2加压后颜色先变深后变浅
③SO2与O2生成SO3的反应,往往需要用催化剂
④H2、I2、HI平衡混和气加压后颜色变深
A、①和② B、①和④ C、②和③ D、①②④ -
9、下列关于水的说法正确的是( )A、水的离子积仅适用于纯水 B、水的电离需要通电 C、升高温度一定使水的离子积增大 D、加入电解质一定会破坏水的电离平衡
-
10、反应C(s)+H2O(g)=CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C(s)的量 ②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A、①③ B、②③ C、①④ D、②④ -
11、化学与生产、生活紧密相关,下列说法不正确的是( )A、镀铜铁器的镀层破损后,铁的腐蚀速度不会加快 B、燃烧煤炭时将煤炭碾碎并吹入炉膛的目的是为了让煤炭充分燃烧 C、泡沫灭火器的使用是利用了盐类水解的原理 D、用浓的碳酸钠溶液除去锅炉水垢中的硫酸钙利用了沉淀转化原理
-
12、下列有关能量的说法不正确的是( )A、化学能可转变为电能 B、化学反应伴随能量变化是化学反应基本特征之一 C、化学反应能量转换遵守能量守恒定律 D、化学变化时断裂化学键需放出能量
-
13、充分加热 NaHCO3和 Na2CO3的混合物 30.5 克,加热至恒重,固体减轻 9.3 克,求:(1)、原混合物中 Na2CO3的质量是克;(2)、往加热后的固体中加入足量盐酸,可得到 CO2克。
-
14、氯气、漂白液等是含氯消毒剂,某化学兴趣小组利用如图装置制备漂白液,并收集纯净干燥的氯气。回答下列问题:
 (1)、盛装浓盐酸的仪器的名称为 , 装置丁用来收集纯净且干燥的氯气,进气口为(填标号);装置乙和丙盛装的试剂分别是、。(2)、写出装置甲中反应的化学方程式并用双线桥法表示该反应中电子转移的方向和数目。(3)、将氯气通入装置戊中制备漂白液,则装置戊中发生反应的离子方程式为 , 有同学认为装置戊还有一个作用,该作用为。
(1)、盛装浓盐酸的仪器的名称为 , 装置丁用来收集纯净且干燥的氯气,进气口为(填标号);装置乙和丙盛装的试剂分别是、。(2)、写出装置甲中反应的化学方程式并用双线桥法表示该反应中电子转移的方向和数目。(3)、将氯气通入装置戊中制备漂白液,则装置戊中发生反应的离子方程式为 , 有同学认为装置戊还有一个作用,该作用为。 -
15、Na2CO3在轻工、建材、纺织、国防、医药等工业中有重要的应用。工业碳酸钠(纯度约为 98%)中含有 Ca2+、Mg2+、Fe3+、Cl-和 SO等杂质,提纯工艺线路如下:

已知:碳酸镁微溶,氢氧化镁难溶,碳酸钠的饱和溶液在不同温度下析出的溶质如下所示:

请回答下列问题:
(1)、工业上常用煅烧 NaHCO3 的方法得到碳酸钠,该反应的化学方程式为:。(2)、试剂 A 是 , “母液”中除了含有 Na+、CO、OH-外,还含有等离子,过滤要“趁热”的目的是。(3)、检验试剂级 Na2CO3中 Cl-和 SO 是否除尽,可先将样品配成溶液,然后选用试剂及加入的先后顺序合理的是____(填字母)。A、HCl、BaCl2、AgNO3 B、AgNO3、HNO3、BaCl2 C、HNO3、Ba(NO3)2、AgNO3 D、AgNO3、HCl、BaCl2 -
16、现有下列物质:①NaHCO3固体、② KHSO4固体、③稀HNO3、④铜、⑤CO2、⑥熔融MgCl2、⑦石墨、⑧蔗糖晶体、⑨Ba(OH)2固体 。请填空:(1)、上述状态下可导电的物质是(填标号,下同),属于电解质的是(2)、①溶于水时的电离方程式为(3)、②与⑨
 水溶液混合后,溶液恰好呈中性,发生反应的离子方程式为 (4)、③可与④发生反应,请将方程式配平
水溶液混合后,溶液恰好呈中性,发生反应的离子方程式为 (4)、③可与④发生反应,请将方程式配平该反应的氧化产物是 , 做氧化剂的硝酸占参加反应硝酸的比例为(用分数表示)。
-
17、化学是一门以实验为基础的学科。下列实验方案操作正确且能够达到实验目的的是( )
选项
实验目的
实验方案
A
除去Cl2中的少量HCl
将混合气体通过盛有氢氧化钠溶液的洗气瓶
B
证明Na2O2与H2O反应是放热反应
用棉花包裹Na2O2粉末后,滴加几滴水,棉花燃烧说明该反应是放热反应
C
观察钠与水反应的现象
用镊子从煤油中取出金属钠,直接放入装有适量水的烧杯中
D
检验NaCl溶液中的金属阳离子
用玻璃棒蘸取溶液,在酒精灯外焰上灼烧,观察火焰的颜色
A、A B、B C、C D、D -
18、将 7.8 克 Na2O2与 16.8 克 NaHCO3 固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )A、Na2CO3 B、NaOH、Na2CO3 C、Na2O2、Na2CO3 D、Na2O2、NaOH、Na2CO3
-
19、生活处处存在氧化还原反应,研究氧化还原反应,对人类的进步具有极其重要的意义。在强碱性条件下,发生反应: , 中X的化合价为( )A、+4 B、+5 C、+6 D、+7
-
20、汽车剧烈碰撞时,安全气囊中发生反应对于该反应,下列判断正确的是( )A、NaN3中氮元素的化合价为-3 价 B、氧化剂和还原剂是同一物质 C、反应中每转移 10 个电子,产生 16 个 N2 D、氧化产物与还原产物分子个数之比为 1∶1