相关试卷
-
1、设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、足量Cl2与2.8 g Fe充分反应,转移的电子数为0.1NA B、常温常压,1.6 g的氧气和臭氧混合气体中,含有氧原子的数目为0.1NA C、22.4L CO2中含有原子数为3NA D、100 mL 0.1 mol·L-1的H2SO4溶液中含有的氧原子数为0.04NA
-
2、化学是以实验为基础的科学。下列实验操作能达到实验预期目的的是( )
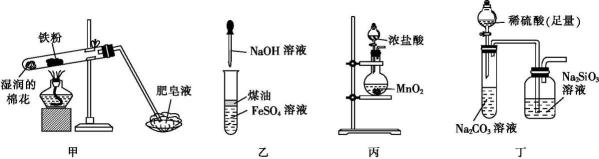 A、图甲:验证铁粉与水蒸气反应 B、图乙:制取Fe(OH)2沉淀并长时间观察其颜色 C、图丙:制取少量氯气 D、图丁:验证C和Si的非金属性强弱
A、图甲:验证铁粉与水蒸气反应 B、图乙:制取Fe(OH)2沉淀并长时间观察其颜色 C、图丙:制取少量氯气 D、图丁:验证C和Si的非金属性强弱 -
3、如图中a、b、c、d、e、f为含Cl元素的物质。下列说法不正确的是
 A、a溶液的酸性比d强 B、b、c均能用于自来水消毒 C、f露置于空气中会转化成d D、实验室可利用e的固体制备氧气,每生成1 mol O2转移2mol e-
A、a溶液的酸性比d强 B、b、c均能用于自来水消毒 C、f露置于空气中会转化成d D、实验室可利用e的固体制备氧气,每生成1 mol O2转移2mol e- -
4、配制100mL1.00mol/LNaCl溶液,部分实验操作示意图如下。

下列说法不正确的是( )
A、该实验中用到的玻璃仪器有:烧杯、玻璃棒、100mL容量瓶、胶头滴管等 B、上述实验操作步骤的正确顺序为②①④③ C、容量瓶用蒸馏水洗涤后,不必经过干燥即可使用 D、定容时,俯视观察刻度线,会引起溶液的浓度偏低 -
5、NaCl是一种化工原料,可以制备一系列物质,如图所示。下列说法中正确的是( )
 A、25℃时,NaHCO3在水中的溶解度比Na2CO3的大 B、工业上可用石灰乳与Cl2反应制取漂粉精 C、Cl2和H2在点燃的条件下安静燃烧,产生淡蓝色火焰 D、如图所示转化反应都是氧化还原反应
A、25℃时,NaHCO3在水中的溶解度比Na2CO3的大 B、工业上可用石灰乳与Cl2反应制取漂粉精 C、Cl2和H2在点燃的条件下安静燃烧,产生淡蓝色火焰 D、如图所示转化反应都是氧化还原反应 -
6、下列有关物质的性质与用途不具有对应关系的是( )A、铁粉能与O2反应,可用作食品保存的吸氧剂 B、纳米Fe3O4能与酸反应,可用作铁磁性材料 C、FeCl3具有氧化性,可用于腐蚀印刷电路板上的Cu D、聚合硫酸铁能水解并形成胶体,可用于净水
-
7、下表中对“陈述”的解释错误的是( )
选项
陈述
解释
A
NaHCO3用于治疗胃酸过多
NaHCO3可与盐酸反应
B
向Na2O2与H2O反应后的溶液中滴入MgCl2溶液,产生白色沉淀
Na2O2与水反应生成氢氧化钠,OH-与Mg2+反应生成Mg(OH)2
C
金属钠应保存在煤油中隔绝空气
常温下,金属钠露置在空气中会生成过氧化钠
D
过氧化钠可用作航天员的供氧剂
能和、反应生成
A、A B、B C、C D、D -
8、下列选项不能用来证明Cl的非金属性比I的非金属性强的是( )A、ICl中I是+1价,Cl是-1价 B、稳定性:HCl > HI C、酸性:HCl < HI D、Fe3+可以氧化I- , 但不能氧化Cl-
-
9、下列离子方程式中,正确的是( )A、铁与稀盐酸的反应:2Fe+6H+=2Fe3+ +3H2↑ B、硫酸铜与氢氧化钡的反应:Ba2++SO42-=BaSO4↓ C、石灰石与盐酸的反应:CO32- +2H+ =H2O+CO2↑ D、硝酸银与氯化钠的反应:Ag+ + Cl- =AgCl↓
-
10、实验安全是保证科学研究的前提,下列操作符合实验室安全要求的是( )A、钠着火可用干粉泡沫灭火器进行灭火 B、实验后将多余的固体钾扔在有水的废液缸里 C、未佩戴防护眼镜,近距离俯视观察金属钠与水的反应 D、大量氯气泄漏,应迅速离开现场,向高处去。
-
11、生活中处处是化学,下列说法错误的是( )
选项
A
B
C
D
生活中
的化学

树林中的丁达尔效应

维生素C片

节日烟火

氢氧化钠片
化学原理
(或用途)
树林中存在分散质粒子直径介于1 nm~100 nm的分散系
能将人体中摄取的不易吸收的铁离子转化为易吸收的亚铁离子,是因其具有还原性
属于金属元素的焰色试验
常用来治疗胃酸过多
A、A B、B C、C D、D -
12、杭州亚运会主火炬用了一种全球大型赛事中从未使用过的燃料—“零碳甲醇”,甲醇(CH3OH)是太阳能的最佳载体,也被成为“液态阳光”。当H2O经太阳光光解制成H2 , 空气中的CO2加H2又能生成CH3OH。在这一过程中,实现了零污染零排放,并可以循环使用,是迄今为止人类制备CH3OH最清洁环保的方式之一。下列叙述不正确的是( )A、CO2是酸性氧化物 B、H2O既是氢化物也是氧化物 C、CH3OH、H2都属于非电解质 D、H2O光解制H2的反应属于氧化还原反应
-
13、辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2 , 以及少量SiO2、Fe2O3等杂质。研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰和碱式碳酸铜。主要工艺流程如下:已知:①MnO2有较强的氧化性,能将Cu+氧化成Cu2+
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4。
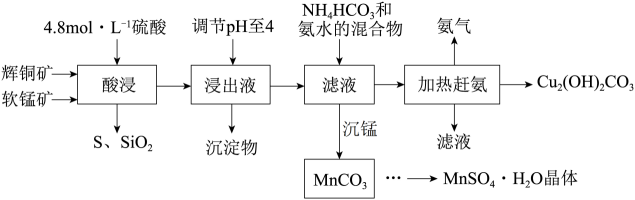 (1)、实验室配制250mL4.8mol/L的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要。(2)、酸浸时,为了提高浸取率可采取的措施有(任写一点)。(3)、酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式。(4)、调节浸出液pH=4的作用是。(5)、本工艺中可循环使用的物质是(写化学式)。(6)、获得的MnSO4·H2O晶体后常用酒精洗涤,优点是。(7)、用标准的BaCl2溶液测定样品中MnSO4·H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略)其可能原因有(任写一种)。
(1)、实验室配制250mL4.8mol/L的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要。(2)、酸浸时,为了提高浸取率可采取的措施有(任写一点)。(3)、酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式。(4)、调节浸出液pH=4的作用是。(5)、本工艺中可循环使用的物质是(写化学式)。(6)、获得的MnSO4·H2O晶体后常用酒精洗涤,优点是。(7)、用标准的BaCl2溶液测定样品中MnSO4·H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略)其可能原因有(任写一种)。 -
14、已知某烧碱样品中含有NaCl杂质,为测定该样品中NaOH的质量分数,进行如下实验:
①称量1.00g样品溶于水配成250mL溶液:
②用碱式滴定管准确量取25.00mL所配溶液于锥形瓶中,滴加2—3滴指示剂:
③用的标准盐酸滴定并重复三次,每次实验数据记录如下:
滴定序号
待测液体积/mL
消耗盐酸的体积/mL
滴定前
滴定后
1
2
3
25.00
25.00
25.00
0.50
6.00
1.10
20.60
26.00
21.00
请回答下列问题:
(1)、实验步骤②中所滴加的指示剂是。(2)、排除碱式滴定管胶管中气泡的方法是(填字母)。 (3)、在该实验的滴定过程中用左手控制。(填仪器及部位),眼睛 , 直至滴定终点。(4)、判断达到滴定终点时的现象为。(5)、若出现下列情况,导致测定结果偏高的是(填序号)。
(3)、在该实验的滴定过程中用左手控制。(填仪器及部位),眼睛 , 直至滴定终点。(4)、判断达到滴定终点时的现象为。(5)、若出现下列情况,导致测定结果偏高的是(填序号)。a.滴定前用蒸水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎使瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在链形瓶外
d.酸式滴定管中在滴定前有气泡,滴定后气泡消失
e.滴定前仰视读数,滴定后俯视读数
f.酸式滴定管在使用前没有用标准液润洗
(6)、通过计算可知该烧碱样品的纯度为。 -
15、25℃时,有关物质的电离平衡常数如下,回答下列问题:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
(1)、常温下,醋酸钠的溶液呈性,原因是(写离子方程式)(2)、物质的量浓度为的下列四种溶液,pH由大到小的顺序是(填编号)。
A.Na2CO3
B.NaClO
C.CH3COONa
D.NaHCO3(3)、体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。则HX的电离平衡常数(填“大于”、“等于”或“小于”)醋酸的电离平衡常数,HX是酸(填“强”或“弱”)。 (4)、25℃时,若测得CH3COOH与CH3COONa的混合溶液pH=6,则溶液中c(CH3COO-) - c(Na+)=(填计算式,不用求具体值)(5)、在室温下,0.175 mol·L-1醋酸钠溶液的pH约为(6)、标准状况下,将1.12L CO 2通入100mL 0.75mol·L -1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序
(4)、25℃时,若测得CH3COOH与CH3COONa的混合溶液pH=6,则溶液中c(CH3COO-) - c(Na+)=(填计算式,不用求具体值)(5)、在室温下,0.175 mol·L-1醋酸钠溶液的pH约为(6)、标准状况下,将1.12L CO 2通入100mL 0.75mol·L -1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序 -
16、绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等废气的处理对建设美丽中国具有重要意义。(1)、用CO2可以生产燃料甲醇。
已知: △H= - a kJ/mol
△H= - b kJ/mol
则表示燃烧的热化学方程式为。
(2)、某温度下,将6 mol CO2和8 molH2充入一容积为2 L的密闭容器中发生 △H<0反应,测得H2的物质的量随时间变化如图实线所示。
请回答下列问题:
①前分钟内,H2的平均反应速率为(保留两位小数)。
②下列表述能表示该反应已达平衡的是(填序号)。
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体的平均摩尔质量不再改变 d.容器内各物质的物质的量相等
③在温度时,该反应的化学平衡常数为。
④仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,改变条件的方式可能是。
(3)、二氧化硫一空气质子交换膜燃料电池将化学能转变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示。
在该燃料电池中,负极的电极方程式为。
-
17、常温下,向0.1mol·L1H3PO4溶液中加入NaOH的过程中各微粒的物质的量分数(δ)随pH的变化关系如图所示(H3PO4的三级电离常数依次为Ka1、Ka2、Ka3)。下列叙述错误的是( )
 A、Ka2=10-7.2 , HPO42-的水解平衡常数为10-6.8 B、为获得尽可能纯的NaH2PO4 , pH应控制在4~5 C、反应H2PO4-+H2O
A、Ka2=10-7.2 , HPO42-的水解平衡常数为10-6.8 B、为获得尽可能纯的NaH2PO4 , pH应控制在4~5 C、反应H2PO4-+H2O H3PO4+OH- 的K=10-11.9
D、Na2HPO4溶液中存在c(OH-)+c(PO43-)=c(H+)+c(H2PO4-)+c(H3PO4)
H3PO4+OH- 的K=10-11.9
D、Na2HPO4溶液中存在c(OH-)+c(PO43-)=c(H+)+c(H2PO4-)+c(H3PO4)
-
18、下,三种硫酸盐、、的沉淀溶解平衡曲线如下图所示。已知。下列说法正确的是( )
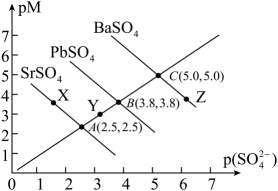 A、溶度积: B、点对是不饱和溶液,能继续溶解 C、点对应的溶液中 , 二者的浓度积等于 D、不可能转化成
A、溶度积: B、点对是不饱和溶液,能继续溶解 C、点对应的溶液中 , 二者的浓度积等于 D、不可能转化成 -
19、下列说法错误的有几句( )
①NaHCO3溶液加水稀释,的比值保持增大
②浓度均为0.1mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO)+c(HCO)]
③在0.1mol·L-1氨水中滴加0.1mol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=10-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
A、4 B、3 C、2 D、1 -
20、根据下列实验操作,现象和结论都正确的是( )
实验操作
现象
结论
A
用pH试纸测定饱和新制氯水的pH
pH试纸变红色
饱和新制氯水呈酸性
B
向AgNO3溶液中依次滴加NaCl、KI溶液
依次出现白色、黄色沉淀
C
用pH试纸测定NaCl与NaF溶液的pH
前者小于后者
非金属性:F<Cl
D
等体积、pH=3的两种酸HA和HB,分别与足量Zn反应
HA放出的氢气多
酸性:HA<HB
A、A B、B C、C D、D