相关试卷
-
1、(1)、等质量的CO和CO2 , 物质的量之比为;氧原子个数之比为(2)、1.5 mol H2SO4的质量是g,其中含有mol H(3)、9.03×1023个氨分子含mol NH3 , mol电子
-
2、25 ℃时,将10 mL质量分数为50%(密度为1.4 g·cm-3)的硫酸稀释成100 mL。下列说法正确的是 ( )A、仰视容量瓶刻度线定容,所配溶液的浓度偏大 B、上述稀释过程所需要的蒸馏水为90 mL C、质量分数为50%的硫酸溶液的物质的量浓度约为7.14 mol·L-1 D、上述10 mL稀硫酸中含溶质14 g
-
3、已知:①;
②;③。
根据上述反应,判断下列结论错误的是( )
A、溶液中可发生反应: B、氧化性强弱顺序为: C、在反应①③中均为氧化剂 D、反应①中,是的还原产物 -
4、设NA表示阿伏加德罗常数的值,下列说法正确的是 ( )A、1 mol·L-1NaCl溶液中含有NA个Na+ B、18 g H2O中含有NA个H2、NA个O C、NA个 H2O分子在标准状况下的体积约为22.4 L D、2.3 gNa+中含有NA个电子
-
5、下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象的是( )A、加热时无气体放出 B、滴加盐酸时有气泡放出 C、溶于水后滴加BaCl2稀溶液有白色沉淀生成 D、溶于水后滴加澄清石灰水有白色沉淀生成
-
6、不能用于检验新制氯水和长期放置的氯水的试剂是( )A、干燥的有色布条 B、石蕊溶液 C、氯化亚铁溶液 D、硝酸银溶液
-
7、在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水中,石灰水变浑浊,由此判断该溶液中含有( )A、Cl-、SO42- B、Cl-、NO3- C、Cl-、CO32- D、Cl-、OH-
-
8、实验室需配制一种仅含五种离子的混合溶液,且在混合溶液中五种离子的物质的量浓度均为5 mol·L-1。下列四组离子能达到此实验目的的是( )A、Na+、K+、、、Cl- B、Ba2+、、、、Cl- C、Mg2+、K+、OH-、Cl-、 D、Al3+、Na+、Cl-、、
-
9、三个相同的恒温恒容密闭容器中分别盛有等质量的氢气、甲烷、氧气,下列说法正确的是( )A、三种气体的分子数目一定相等 B、三种气体物质的量之比为16∶2∶1 C、三种气体的密度之比为1∶2∶16 D、三种气体的压强一定相等
-
10、制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为:2FeCl3+Cu=2FeCl2+CuCl2。该反应利用了铜的( )A、氧化性 B、还原性 C、稳定性 D、导电性
-
11、下列离子方程式书写正确的是( )A、铁跟稀H2SO4反应:2Fe+6H+=2Fe3++3H2↑ B、向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- C、碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑ D、Cl2溶于水:Cl2+H2O=Cl-+2H++ClO-
-
12、等臂杠杆两端各系一只等质量的铁球,将杠杆调平衡后,将球分别浸没在等质量、等密度的稀硫酸和硫酸铜溶液里(如图所示),一段时间后杠杆将会( )
 A、左端上翘 B、右端上翘 C、仍然平衡 D、无法判断
A、左端上翘 B、右端上翘 C、仍然平衡 D、无法判断 -
13、下列物质能导电的是( )
①固体食盐 ②溴水 ③CuSO4·5H2O ④液溴 ⑤蔗糖 ⑥氯化氢气体 ⑦盐酸 ⑧液态氯化氢
A、①④⑤ B、②⑦ C、⑤⑥⑧ D、④⑧ -
14、下列有关铁及其化合物的说法正确的是( )A、在自然界中,不可能有游离态的铁存在 B、磁铁矿的主要成分是Fe2O3 C、铁是地壳中含量最多的金属元素,因此在日常生活中应用最广 D、人体内的血红蛋白中含有铁元素
-
15、某废镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体():
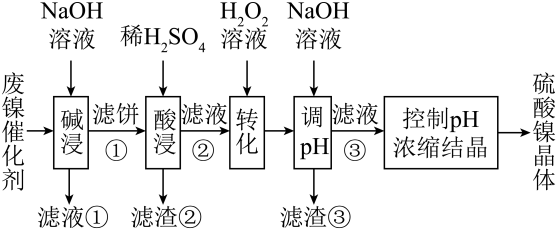
回答下列问题:
(1)、 “碱浸”中的两个作用分别是除去油脂和溶解Al和Al2O3 , 写出Al和NaOH溶液反应的化学方程式(2)、滤液②中含有的金属离子是(填离子符号)(3)、“转化”中可替代的最佳物质是____。(填字母)A、酸性溶液 B、 C、硝酸 D、新制氯水(4)、调pH范围为3.2~7.2,沉淀出滤渣③的成分是Fe(OH)3 , 调pH除去的杂质离子是(填离子符号)
(5)、滤液③的主要离子是Ni2+ , 检验滤液是否含有Fe3+的试剂是(填化学式)(6)、将分离出硫酸镍晶体后的母液收集、循环使用,其意义是。 -
16、钠是一种非常活泼、具有广泛应用的金属。(1)、钠的原子结构示意图为 , 钠在反应中容易电子(填“得到”或“失去”)。(2)、汽车安全气囊的气体发生剂可由金属钠生产。某汽车安全气囊内含、和等物质。
ⅰ.当汽车发生较严重的碰撞时,引发分解 , 从而为气囊充气。产生的Na立即与发生置换反应生成 , 化学方程式是。
ⅱ.是冷却剂,吸收产气过程释放的热量。起冷却作用时发生反应的化学方程式为。
ⅲ.一个安全气囊通常装有 , 其完全分解所释放的为mol。(保留两位小数)
(3)、工业通过电解NaCl生产金属钠: , 过程如下:
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入从而把熔点降至约580℃。
①把NaCl固体加热至熔融状态,目的是。
②粗钠中含有少量杂质Ca,过程Ⅱ除去Ca的化学方程式是。
-
17、海洋是资源的宝库,蕴藏着丰富的氯、溴、碘等元素。氯、溴、碘是典型的非金属元素,都能与大多数金属化合生成盐,故统称为卤素;卤素单质都具有氧化性。(1)、氯在元素周期表中的位置(2)、氯气是重要的化工产品,工业可以由电解氯化钠溶液得到,同时还生成NaOH和H2。写出该电解过程的离子方程式(3)、氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,它们阴离子的还原性强弱顺序为:。试写出:
在NaBr和KSCN的混合溶液中滴加少量(CN)2 , 请写出发生反应的离子方程式。
(4)、 NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:I.上述反应的还原剂是
II.根据上述反应,鉴别某白色固体是NaNO2还是NaCl。可选用的物质有:①水 ②淀粉碘化钾试纸 ③淀粉溶液 ④白酒 ⑤食醋(稀的醋酸溶液),你认为必须选用的物质有(填字母)。
A .③⑤ B.①②⑤ C.①②④
III.某厂废液中,含有2%~5%的NaNO2直接排放会造成污染,下列试剂能使NaNO2转化为N2防止污染的是。(填字母)
A.NaCl B. C. D.浓
-
18、氯元素可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,并比较其氧化性。
已知:氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl- , 在75℃以上和浓碱溶液中主要产物是ClO3-和Cl-

回答下列问题:
(1)、 甲中盛放浓盐酸的仪器名称是 , 甲中发生的反应的化学方程式是(2)、乙中的试剂为(3)、丙中发生反应的化学方程式是(4)、丁采用冰水浴冷却的目的是(5)、戊的作用是尾气吸收,可选用试剂 ____(填字母)。A、H2SO4 B、NaOH C、NaCl D、Ca(OH)2(6)、反应结束后,取出丙中试管,经冷却结晶、、洗涤、干燥,得到KClO3晶体。(7)、取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显紫色。可知该条件下KClO3的氧化能力NaClO(填“大于”或“小于”)。 -
19、下列实验操作、现象及结论均正确的是( )
选项
实验操作
现象
结论
A
取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液
溶液颜色变红
溶液X含有Fe3+
B
向饱和的Na2CO3溶液通入CO2
产生白色沉淀
溶解度:NaHCO3<Na2CO3
C
向Fe2O3、CuO、Fe的混合粉末中加入过量稀盐酸
析出红色固体
反应后溶液中阳离子只有H+和Fe2+
D
向煮沸的NaOH溶液中滴入几滴饱和FeCl3溶液,继续加热
溶液变成红褐色
制得Fe(OH)3胶体
A、A B、B C、C D、D -
20、实验室模拟以含铁废渣(主要成分为FeO、Fe2O3 , 杂质为Cu2(OH)2CO3、CuO)为原料制备七水硫酸亚铁(FeSO4·7H2O)的流程如图所示。下列说法错误的是( )
 A、“除铜”步骤的反应类型有置换反应和化合反应 B、含铁废渣中的FeO、Fe2O3、CuO均属于碱性氧化物 C、实验室需要500 mL0.1 mol•L-1FeSO4溶液,需要称取7.6 g FeSO4·7H2O配制 D、铜器生锈[主要成分为Cu2(OH)2CO3]的反应原理为:2Cu+O2+H2O+CO2=Cu2(OH)2CO3
A、“除铜”步骤的反应类型有置换反应和化合反应 B、含铁废渣中的FeO、Fe2O3、CuO均属于碱性氧化物 C、实验室需要500 mL0.1 mol•L-1FeSO4溶液,需要称取7.6 g FeSO4·7H2O配制 D、铜器生锈[主要成分为Cu2(OH)2CO3]的反应原理为:2Cu+O2+H2O+CO2=Cu2(OH)2CO3