相关试卷
-
1、铁及其化合物与生产、生活息息相关。回答下列问题:(1)、易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素 C。维生素 C 的作用是 。(2)、印刷电路板的制作原理是用足量的溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:。(3)、生铁是通过高炉冶炼而得到的,以赤铁矿为例用 CO将其还原的化学方程式为。(4)、某废料铁泥的主要成分为 Fe₂O₃、FeO、Fe 和杂质(杂质不与硫酸反应)。 现取 w g 废料铁泥提取设计实验流程如下:

①分离溶液 A 和沉淀C 的操作中使用到的玻璃仪器有烧杯、、。
②能检验溶液 A 中含有的试剂是(填字母)。
A. 铁粉
B. 酸性 溶液
C. KSCN 溶液③步骤Ⅱ中发生反应的离子方程式为。
④若最终获得 , 则废料铁泥中铁元素的质量分数为。
-
2、下图是一些单质及其化合物之间的转化关系图。 常温常压下,D、F、K 均为无色无刺激性气味的气体,B是最常见的无色液体,A 是由单质 C 在 D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)

回答下列问题:
(1)、物质 A、I的化学式为、。(2)、单质C的实验室保存方法是。(3)、反应③的化学方程式为。(4)、写出反应①的化学方程式并用双线桥法表示电子转移的方向和数目:。(5)、反应④的化学方程式为。(6)、现加热6.14 g H 和Ⅰ的混合物,使Ⅰ完全分解,混合物质量减少了0.31g,则原混合物中H 的物质的量为mol。 -
3、某离子反应涉及六种微粒,已知反应过程中浓度变化如图所示,下列说法正确的是( )
 A、中C r化合价是+7价 B、反应的氧化产物是 C、反应过程中氧化剂与转移电子数之比为1:3 D、随着反应的进行,溶液中的酸性逐渐增强
A、中C r化合价是+7价 B、反应的氧化产物是 C、反应过程中氧化剂与转移电子数之比为1:3 D、随着反应的进行,溶液中的酸性逐渐增强 -
4、根据下列实验操作和现象所得到的结论不正确的是( )
选项
实验操作和现象
结论
A
用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色
该溶液中一定含有钠元素
B
取少量氧化钠固体在空气中继续加热,固体变为淡黄色
氧化钠与氧气生成过氧化钠
C
取久置的 Na₂O₂粉末,向其中滴加过量的盐酸,产生无色气体
Na₂O₂ 没有变质
D
将金属钠在燃烧匙中点燃,迅速伸入集满 CO₂的集气瓶中,瓶中产生大量的烟和黑色颗粒
黑色颗粒是炭
A、A B、B C、C D、D -
5、还原铁粉与水蒸气反应的装置如图所示,下列有关该实验的说法不正确的是( )
 A、用燃着的火柴点燃肥皂泡,肥皂泡燃烧,说明该气体是氢气 B、不能将湿棉花换为干燥的棉花,因为湿棉花冷却试管防止试管炸裂 C、该反应的化学方程式为 D、不能用磁铁将剩余的铁粉与生成物分离
A、用燃着的火柴点燃肥皂泡,肥皂泡燃烧,说明该气体是氢气 B、不能将湿棉花换为干燥的棉花,因为湿棉花冷却试管防止试管炸裂 C、该反应的化学方程式为 D、不能用磁铁将剩余的铁粉与生成物分离 -
6、实验室配制的溶液,下列说法不正确的是( )A、称量时,若将固体置于托盘天平右盘,将导致所配溶液浓度偏小 B、称量过程中,有少量粘在称量纸上,导致所配溶液浓度偏小 C、定容摇匀后发现液面低于刻度线,应再滴加蒸馏水至刻度线 D、若取配制好的溶液 50 mL,将其稀释至则需要加水至 200 mL
-
7、将一定量的金属铁、铜投入一定浓度的溶液中充分反应,下列对反应情况推断正确的是( )A、当铁、铜均不剩余时,溶液中一定有一定无 B、当铁、铜均剩余时,溶液中一定有一定无 C、当铜剩余,铁不剩余时,溶液中一定有一定无 D、当铜剩余,铁不剩余时,溶液中一定有一定无可能含有
-
8、设为阿伏加德罗常数的值,下列说法正确的是( )A、中含有的电子数为9NA B、和O ₃混合气体中的氧原子数为0 .1NA C、1L1 mol/L 的盐酸中,所含 HCl分子数为 NA D、6.5 gZn 与足量稀硫酸反应,转移的电子数为0.2NA
-
9、ClO₂ 是一种广谱型的消毒剂,根据世界环保联盟的要求,(将逐渐取代成为生产自来水的消毒剂。工业上常用和溶液混合并加酸化后反应制得,在以上反应中氧化剂与还原剂的物质的量之比为( )A、2:1 B、1:2 C、3:1 D、1: 3
-
10、在探究新制氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )A、向氯水中滴加硝酸酸化的 AgNO₃溶液,产生白色沉淀,说明氯水中含有( B、新制氯水使红玫瑰变为白玫瑰,说明 Cl₂ 具有漂白性 C、向氯水中加入粉末,有气泡产生,说明氯水中含有 D、新制氯水呈浅黄绿色,说明氯水中有氯气分子
-
11、下列化学反应的离子方程式书写正确的是( )A、用小苏打治疗胃酸过多: B、石灰乳与盐酸反应: C、氢氧化钡溶液跟稀硫酸反应: D、溶液中加足量B a(OH)₂溶液:)
-
12、下列有关氯及其化合物的性质与用途不具有对应关系的是( )A、盐酸呈酸性,可用于除铁锈 B、Cl2 能溶于水,可用于工业制盐酸 C、NaClO具有强氧化性,可用作漂白剂 D、HClO具有强氧化性,可用作棉、麻的漂白剂
-
13、我国在春秋初年已掌握了冶铁技术。下列关于铁及其化合物的说法中不正确的是( )A、铁具有良好的导热性、导电性和延展性 B、FeO是一种红棕色粉末,俗称铁红,常用作红色染料 C、加热条件下,Fe 与 Cl2 发生反应生成氯化铁 D、FeO和 Fe2O3都是碱性氧化物
-
14、室温下,下列各组离子在指定溶液中能大量共存的是( )A、溶液: B、的溶液中: C、使酚酞变红色的溶液中: D、溶液:
-
15、下列物质在给定条件下的转化均能一步实现的是( )A、 B、 C、BaCl₂ 溶液BaCO₃CO₂ D、
-
16、我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为 1.3 nm)恢复了磁性。 下列关于“钴酞菁”分子的说法正确的是( )A、其在水中形成的分散系属于溶液 B、“钴酞菁”分子直径比 H⁺的直径小 C、其在水中形成的分散系能产生丁达尔效应 D、“钴酞菁”分子不能透过滤纸
-
17、世界上有名的“鬼谷”马沃山谷,每当下雨电闪雷鸣时,山谷中就会传出战场厮杀的声音,甚至还有人影。但是天晴之后,山谷中就不会出现这种现象。经过相关人员研究发现是山谷中存在大量的磁铁矿导致了这种异常现象的产生,磁铁的主要成分是( )A、FeO B、Fe₂O₃ C、Fe₃O₄ D、Fe
-
18、双酰胺类杀虫剂的中间体吡啶联噻唑(Ⅴ)合成路线如下:
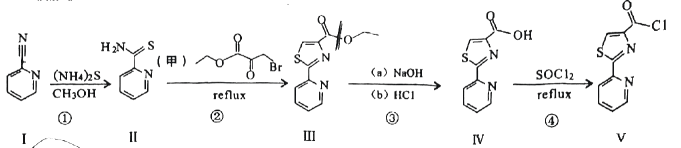
已知:

回答以下问题:
(1)、化合物Ⅰ的分子式为 .(2)、下列说法不正确的是____.A、化合物Ⅰ中所有原子共平面 B、Ⅳ→Ⅴ属于取代反应 C、化合物Ⅲ和Ⅴ分子中均含有羧基 D、化合物Ⅰ和Ⅱ分子中的C原子均为杂化(3)、写出Ⅲ→Ⅴ过程中步骤(a)的化学方程式 .(4)、根据化合物甲的同分异构体乙的结构特征,分析预测乙可能的化学性质,完成下表:序号
反应试剂、条件
反应形成的新结构
反应类型
①
消去反应
②
, 浓硫酸,加热
③
氧化反应
(5)、化合物Ⅰ与的加成产物X的同分异构体有多种,写出其中符合下列条件的有机物的结构简式 .a.红外光谱显示分子中含一个苯环 b.苯环上仅含两个取代基 c.核磁共振氢谱中峰面积之比为
(6)、双酰胺类杀虫剂 , 对粘虫的杀虫活性达100%,以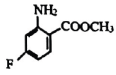 和中间体V为原料,合成的路线如图:
和中间体V为原料,合成的路线如图: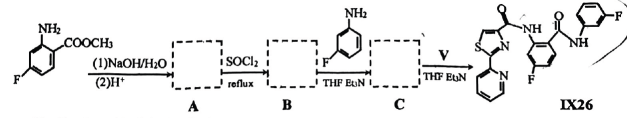
①物质C的结构简式为 .
②以物质A为原料合成有机高分子化合物的方程式为 .
-
19、“绿水青山就是金山银山”.的回收和利用有利于碳中和、碳达峰.回答下列问题:(1)、热化学循环还原制的原理如下图:
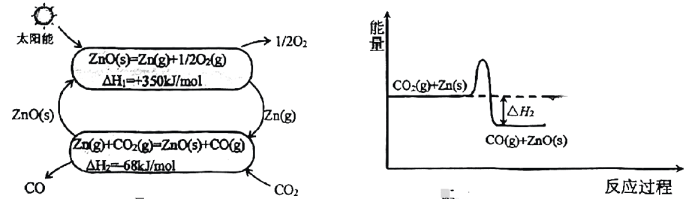
图3 图4
①晶体的模型为 .
②的反应过程如图3,在图4中仿照第一步反应画出第二步反应过程的能量变化示意图 .
③科研小组尝试利用固体表面催化工艺进行的分解.若用●、○和
 分别表示C原子、O原子和固体催化剂,在固体催化剂表面分解的过程如下图所示.下列有关说法中正确的是 .
分别表示C原子、O原子和固体催化剂,在固体催化剂表面分解的过程如下图所示.下列有关说法中正确的是 . 
A.固体催化剂降低了反应的 B.过程③体系能量降低
C.过程②有键的断裂 D.整个过程中形成了头碰头的键
(2)、二甲醚是重要的有机中间体,在一定条件下利用与可合成二甲醚:主反应Ⅰ:
副反应Ⅱ:
④一定条件下,的平衡转化率及平衡时的选择性(生成所消耗的与消耗总量的比值)随温度变化如图所示.下列说法不正确的是 .

A.增大压强,反应Ⅰ平衡正向移动,反应Ⅱ平衡不移动
B.当容器中不变时,两个反应均达到最大限度
C.
D.选用合适的催化剂可提高二甲醚的选择性
⑤图中后平衡转化率升高的原因为 .
⑥在下,将和通入刚性容器中发生反应Ⅰ、Ⅱ,时达到平衡,测得的转化率为60%,容器中的浓度为 , 则(用含t的式子表示),反应Ⅰ的平衡常数 .
-
20、金属铼广泛用于航空航天等领域.工业上用富铼渣(铼元素主要以形式存在,砷主要以形式存在)制取铼粉.工艺流程如下:

已知:常温下;为第四周期第ⅤA族元素;高铼酸铵微溶于冷水,易溶于热水.
回答下列问题:
(1)、的简化电子排布式为 .(2)、“氧化”时铼转化为强酸高铼酸 . “滤渣1”的主要成分是硫单质.写出“氧化”时发生反应的离子方程式: .(3)、综合考虑,富铼渣“氧化”中浸出温度选择为宜,原因是 .(4)、常温下,“反萃取”得到高铼酸铵溶液的 , 则溶液中(填“>”“<”或“=”).(5)、“析晶”得到的主要产品是 . 提纯粗高铼酸铵固体的方法是 , 图1是的X射线衍射图谱,则属于(填“晶体”或“非晶体”).
图1:高铼酸铵谱 图2
(6)、“热解”产生可再生循环利用的物质是 .(7)、已知的立方晶胞如图2,则在晶胞中的位置为;晶体中一个周围与其最近的O的个数为 .