相关试卷
-
1、某实验小组根据以下装置制备84消毒液,并探究84消毒液的性质.
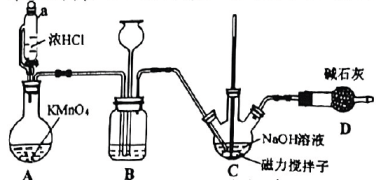
已知: , 若温度超过 , 会生成杂质.
回答下列问题:
(1)、Ⅰ.84消毒液的制备
仪器a的名称为 .(2)、装置A中反应的离子方程式为 .(3)、装置B的作用是(任写一个即可).(4)、制备溶液时,为减少杂质的产生,应采取的措施是(写两条).(5)、为探究性质,设计如右图所示装置,在A处通入未经于燥的氯气.当关闭K处弹簧夹时,C处红布条看不到明显现象;当打开K处的弹簧夹后,C处红布条逐渐褪色.则B瓶内液体可能是____. A、饱和溶液 B、溶液 C、 D、浓硫酸(6)、Ⅱ.探究84消毒液的性质
A、饱和溶液 B、溶液 C、 D、浓硫酸(6)、Ⅱ.探究84消毒液的性质84消毒液和医用酒精均为重要的消毒剂且二者不能混用,某小组对84消毒液与医用酒精的反应产物进行了探究.
【提出假设】医用酒精中的被氧化为
【实验方案】实验方案及现象如下:
实验操作
取样检测时间点
实验现象
常温下将医用酒精和84消毒液混合,在不同反应时间点,分别取反应后的溶液滴加到新制氢氧化铜悬浊液中加热
①
橙黄色沉淀
黑色沉淀
【实验结论1】产物中有乙醛,且乙醛会被转化为其它物质.补充①的实验现象: .
【查阅资料】混合体系中可能发生以下反应:
(卤化反应)
【实验设计】取2份84消毒液,缓慢滴加医用酒精或蒸馏水各 , 通过测定过程中变化判断是否发生卤化反应(忽略过程中的热效应对的影响).实验结果如图.

【实验结论2】数据表明,反应过程中增大,说明乙醛发生了卤化反应.
【查阅资料】某同学查阅资料后认为结论2不严谨,原因是工业上为了稳定 , 在84消毒液中添加了少量 , 且由于乙醇的“锁水”效应也会使增大(提示:乙醇与不反应).
【数据分析】②已知上述实验:84消毒液中 .
通过计算证明84消毒液中添加了少量 , 写出计算过程.
(7)、【优化实验】③该同学增加了对照实验,证明反应生成了 . 请简述方案和结果: .【实验总结】医用酒精中的乙醇能被84消毒液氧化为乙醛,乙醛能进一步发生卤化反应.
-
2、2023年我国首个兆瓦级铁铬液流电池储能项目在内蒙古成功运行.电池利用溶解在盐酸溶液中的铁、铬离子价态差异进行充放电,工作原理如图.有关叙述不正确的是( )
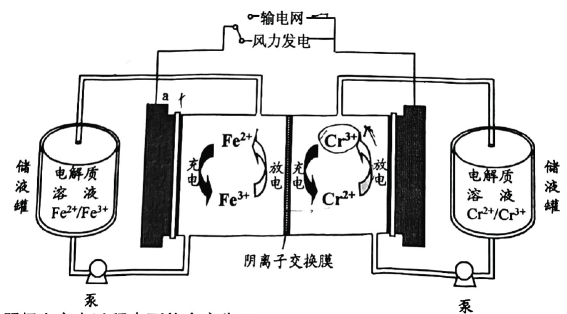 A、阴极在充电过程中可能会产生 B、接输电网时,a极的电极电势高于b C、充电时,阳极的电极反应为 D、放电时,每移向b极,减少
A、阴极在充电过程中可能会产生 B、接输电网时,a极的电极电势高于b C、充电时,阳极的电极反应为 D、放电时,每移向b极,减少 -
3、为减少对环境的污染,工业上常用电解法对煤进行脱硫处理.原理:利用电极反应先将变为再与煤中的含硫物质(主要为 , 结构如图)发生反应:(未配平).下列说法不正确的是( )
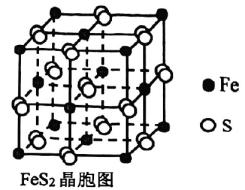 A、中存在非极性键 B、氧化性: C、还原剂与氧化剂的物质的量之比为 D、生成 , 转移电子的物质的量为
A、中存在非极性键 B、氧化性: C、还原剂与氧化剂的物质的量之比为 D、生成 , 转移电子的物质的量为 -
4、量子点的发现和合成掀开了元素周期表研究的新视角.W、X、Y、Z为原子序数依次增大的元素,W的一种同位素常用作测定文物年代,Y是地壳中含量最多的元素.血红素中的价电子排布式为 . 下列说法不正确的是( )
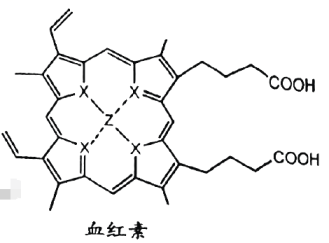 A、元素电负性: B、第一电离能: C、血红素能发生氧化反应、酯化反应 D、血红素的配位键中,由提供空轨道,X提供孤电子对
A、元素电负性: B、第一电离能: C、血红素能发生氧化反应、酯化反应 D、血红素的配位键中,由提供空轨道,X提供孤电子对 -
5、大约4000年前,埃及人会用硫燃烧产生的来漂白布匹.利用下列装置验证性质,有关说法不正确的是( )
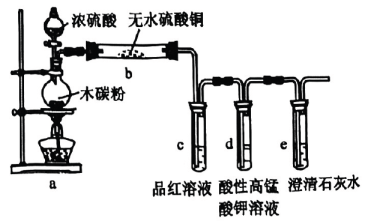 A、装置a中的反应体现了浓硫酸的强氧化性 B、装置b中白色粉末变蓝 C、品红和酸性溶液褪色原理相同 D、澄清石灰水变浑浊,气体产物中可能含
A、装置a中的反应体现了浓硫酸的强氧化性 B、装置b中白色粉末变蓝 C、品红和酸性溶液褪色原理相同 D、澄清石灰水变浑浊,气体产物中可能含 -
6、陈述Ⅰ和陈述Ⅱ均正确且具有因果关系的是( )
选项
陈述Ⅰ
陈述Ⅱ
A
装有的密闭烧瓶置于热水中颜色变深
B
在汽车尾气系统中安装催化器以减少尾气污染
和在催化剂作用下反应生成和
C
常温下,测定等物质的量浓度的和溶液的 , 前者的大
非金属性:
D
浓氨水可检验氯气管道是否泄漏
氨气是非电解质
A、A B、B C、C D、D -
7、海洋碳循环是影响全球气候变化的关键控制环节,下图为海洋中碳循环的原理图.设为阿伏加德罗常数的值.下列说法正确的是( )
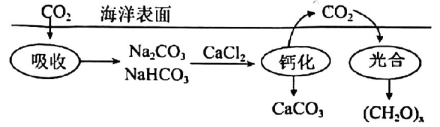 A、的溶液中,数目为 B、“钙化”时,消耗 , 生成 C、“光合”时,每生成转移电子数为 D、中含有共用电子对数为
A、的溶液中,数目为 B、“钙化”时,消耗 , 生成 C、“光合”时,每生成转移电子数为 D、中含有共用电子对数为 -
8、氮是组成氨基酸的基本元素之一,在生物体内有极大作用.部分含N物质的分类及相应化合价关系如图所示.下列说法不合理的是( )
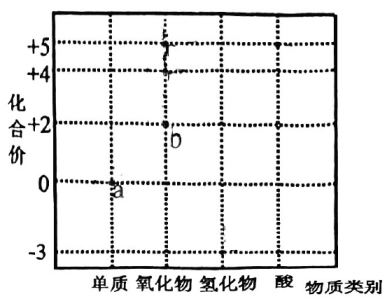 A、属于氮的固定 B、d可用作制冷剂 C、能与反应生成f的物质只有c D、f的浓溶液需要保存在棕色试剂瓶中
A、属于氮的固定 B、d可用作制冷剂 C、能与反应生成f的物质只有c D、f的浓溶液需要保存在棕色试剂瓶中 -
9、我国科学家发明一种新型电池,该电池以碳纳米管为正极、锌线为负极,放电时消耗二氧化碳,同时生成天然气.下列说法正确的是( )A、碳纳米管参与电极反应 B、负极发生还原反应 C、阳离子由正极移向负极 D、正极产物为
-
10、天津大学在存储信息方面取得重大突破,可让信息保存上万年.合成的脱氧核糖的结构如右图所示.下列说法不正确的是( )
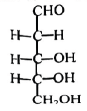 A、不能溶于水 B、含有手性碳 C、属于单糖 D、能发生加成反应
A、不能溶于水 B、含有手性碳 C、属于单糖 D、能发生加成反应 -
11、美好生活靠劳动创造.下列化学知识正确且与劳动项目有关联的是( )
选项
劳动项目
化学知识
A
使用复合肥料培育植物
复合肥含N、P、K三种元素中的两种或三种
B
用氢氟酸刻蚀玻璃生产磨砂玻璃
强酸制弱酸
C
用明矾处理含有悬浮微粒的水
具有吸附性
D
参观顺德糖厂制备蔗糖流程:提汁、清净、蒸发、结晶、分蜜、干燥
其中蒸发、结晶属于化学变化
A、A B、B C、C D、D -
12、从微观角度探析化学反应时,我们感受到一个神奇的微观世界.下列物质性质实验对应的化学方程式书写不正确的是( )A、过氧化钠放入水中: B、氯化铁溶液与铜反应: C、单质硫与铜反应: D、焦炭还原石英砂制粗硅:
-
13、实践是检验真理的唯一标准.下列实验操作或装置能达到目的的是( )
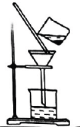
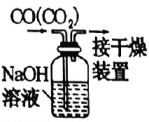
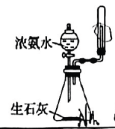
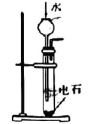
A.过滤
B.除去中的
C.制取并收集
D.实验室制取乙炔
A、A B、B C、C D、D -
14、化学处处呈现美.下列说法不正确的是( )A、漂亮的玛瑙是熔融态的快速冷却形成的 B、冰雪融化时需要破坏氢键和范德华力 C、乙烯分子呈现完美对称,呈正四面体形 D、云、雾、有色玻璃都属于胶体
-
15、生活处处皆化学.下列说法正确的是( )
A
B
C
D




节日燃放的焰火与电子跃迁有关
用于游泳池消毒的漂白粉的成分为
丹霞地貌的岩层因含而显红色
合金内原子层之间的相对滑动容易,故合金硬度比纯金属小
A、A B、B C、C D、D -
16、科技强国.下列说法不正确的是( )A、“北斗三号”导航卫星搭载铷原子钟,铷是碱金属元素 B、“弹性陶瓷塑料”具有很好的硬度和弹性,其中塑料的主要成分为有机物 C、量子计算机“悟空”即将面世,其传输信号的光纤主要成分为二氧化硅 D、的发现开启了碳纳米材料应用的新时代,属于混合型晶体
-
17、中华文化如长河,源远流长势不竭.下列国家级文物中,主要由硅酸盐材料制成的是( )



A.鎏金腰带
B.乘云绣绮
C.青瓷莲花尊
D.金漆木雕大神龛
A、A B、B C、C D、D -
18、某实验需要用1.0 mol·L-1 NaOH溶液450 mL。(1)、配制该溶液的实验操作步骤有:
a.在托盘天平上称量g NaOH固体放入烧杯中,加适量蒸馏水溶解,冷却至室温。
b.把烧杯中的溶液小心地注入中。
c.将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下1~2 cm处,改用加蒸馏水至液面与刻度线相切。
d.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液转入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
e.将瓶塞塞紧,充分摇匀。
(2)、操作步骤的正确顺序为。(3)、该配制过程中两次用到玻璃棒,其作用分别是、。(4)、在进行b步操作时,不慎有液体溅出,下列处理措施正确的是____(填序号)。A、继续进行实验 B、添加部分NaOH溶液 C、倒掉溶液,重新配制 D、倒掉溶液,洗净容量瓶后重新配制(5)、现有硫酸和硫酸钠溶液200 mL,其中硫酸的浓度是1 mol·L-1 , 硫酸钠的浓度是0.5 mol·L-1。要使硫酸和硫酸钠的浓度分别为2 mol·L-1和0.2 mol·L-1 , 应加入98%的硫酸(密度为1.84 g·cm-3)的体积是 , 再加入水配制后溶液的体积是。 -
19、已知无水FeCl3在空气中易潮解,加热易升华。实验室利用如图所示实验装置制取无水FeCl3(加热和夹持装置略去)。

回答下列问题:
(1)、装置A发生反应的化学方程式为 , 该反应氧化剂还原剂个数比 , 电子转移的总数为。(2)、装置D发生反应的化学方程式为。(3)、实验结束时,应先熄灭(填“A”或“D”)处酒精灯;E中冷水的作用是。(4)、装置F的作用是;装置G发生反应的离子方程式。 -
20、为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。
 (1)、往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色:A , B。(2)、写出上述过程中有关反应的离子方程式:
(1)、往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色:A , B。(2)、写出上述过程中有关反应的离子方程式:Fe2O3→A;
A→B。
(3)、B→C可看到的现象是。(4)、将A的饱和溶液滴入沸水中并不断加热,可制得;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为。