相关试卷
-
1、我国科学家设计了一种新型Zn-S可充电电池,该电池放电时硫电极发生两步反应,分别为:、 , 下列说法错误的是( )
 A、放电时锌电极发生的反应为 B、该电池充电时的浓度增大 C、该电池放电时电子从硫电极流出 D、每生成铜,外电路中通过电子
A、放电时锌电极发生的反应为 B、该电池充电时的浓度增大 C、该电池放电时电子从硫电极流出 D、每生成铜,外电路中通过电子 -
2、酒石酸是一种有机二元弱酸(记为)。25℃时,、和的分布分数(例如)与溶液关系如图,已知酒石酸的 , 下列说法错误的是( )
 A、任意下, B、酒石酸溶液中, C、从0到8,水的电离程度先增大后减小 D、时,
A、任意下, B、酒石酸溶液中, C、从0到8,水的电离程度先增大后减小 D、时, -
3、焦性没食子酸是一种优良的除氧剂。下列关于该物质的说法错误的是( )
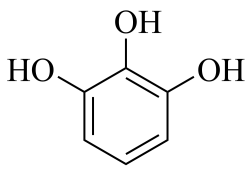 A、有酸性,是一种羧酸 B、有酚羟基,能溶解于水溶液 C、可以与反应制备特种墨水 D、可以与甲醛反应生成树脂
A、有酸性,是一种羧酸 B、有酚羟基,能溶解于水溶液 C、可以与反应制备特种墨水 D、可以与甲醛反应生成树脂 -
4、下列实验操作及现象与结论不一致的是( )
实验操作及现象
结论
A
测定不同温度下蒸馏水的 , 随温度升高而降低
水的电离程度随温度升高而增大
B
向新制的溶液中滴入少量蔗糖溶液并加热,不产生砖红色沉淀
蔗糖不属于还原糖
C
将少量乙酸乙酯加入溶液中,出现分层,静置一段时间后酯层消失
乙酸乙酯可在碱性条件下水解
D
向溶液()中滴加溶液,紫色褪去
具有还原性
A、A B、B C、C D、D -
5、下列实验操作合理的是( )
A
B
C
D
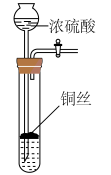
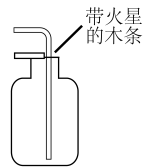
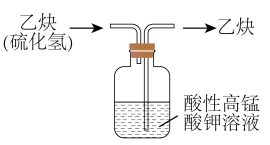
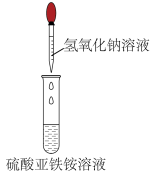
制备二氧化硫
检验氧气是否集满
乙炔除杂
制备氢氧化亚铁
A、A B、B C、C D、D -
6、下列说法正确的是( )A、空间结构模型
 B、基态Si的价层电子排布图
B、基态Si的价层电子排布图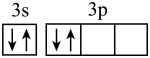 C、硫酸钾的电子式
C、硫酸钾的电子式 D、卤族元素电负性变化趋势
D、卤族元素电负性变化趋势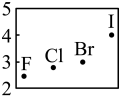
-
7、下列文物的材质属于天然有机高分子的是( )




A.铜奔马
B.汉竹简
C.莲花形玻璃托盏
D.垂鳞纹秦公铜鼎
A、A B、B C、C D、D -
8、为原子序数依次递增的短周期元素,最外层电子数均为奇数。只有X为金属元素,W的核外电子数等于Y的最外层电子数,且W、Y处在不同周期,Z的单质常温下为气体。下列说法错误的是( )A、X单质可与氢氧化钠溶液反应 B、分子与分子均为三角锥形 C、W的第一电离能比同周期相邻两元素的低 D、Z的最高价氧化物对应的水化物为强酸
-
9、室温下,下列离子在指定溶液中能大量共存的是( )A、在澄清的溶液中: B、溶液中: C、在稀氢氧化钠溶液中: D、在稀盐酸中:
-
10、含有未成对电子的物质具有顺磁性。下列物质具有顺磁性的是( )A、 B、 C、NO D、Be
-
11、下列关于物质的结构与性质描述错误的是( )A、石英的熔点、硬度比金刚石的小 B、分子中存在非极性共价键 C、既含有离子键又含有共价键 D、的熔点比的高,因为氨分子间存在氢键
-
12、为阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,金刚石含有4NA个共价键 B、的乙酸和盐酸混合溶液含0.1NA个 C、标准状态下,含有的质子数为10NA D、电解水生成氢气,外电路通过1NA个电子
-
13、生活中处处有化学,下列叙述错误的是( )A、合理施用化肥农药可以实现农作物增产 B、豆腐制作过程中可使用氯化镁作凝固剂 C、聚四氟乙烯可用作不粘锅内侧涂层材料 D、制白砂糖时用活性炭脱色属于化学变化
-
14、英菲替尼(化合物L)是治疗胆管癌的新型药物,其合成路线如下。
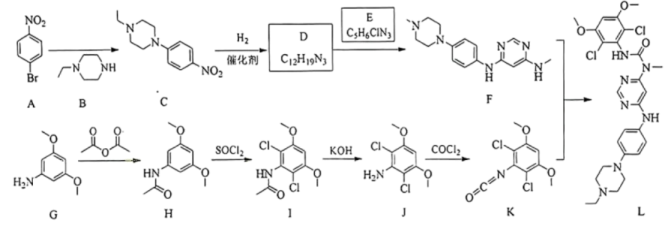
回答下列问题:
(1)、A的化学名称是。(2)、由A生成C的反应类型是。(3)、E的结构简式为。(4)、由G→J的转化过程可知,G转化为H的目的是(5)、符合下列条件的B的同分异构体共有种,其中一种的结构简式为。①分子中含环状结构 ②核磁共振氢谱显示2组峰
(6)、L中氮原子的杂化方式为。(7)、1,3-二苯基脲( )是某些药物分子的重要结构单元。参照上述合成路线,写出以苯为原料制备1,3-二苯基脲的合成路线(无机试剂任选)。
)是某些药物分子的重要结构单元。参照上述合成路线,写出以苯为原料制备1,3-二苯基脲的合成路线(无机试剂任选)。 -
15、铜(Ⅰ)配合物的制备及纯度分析步骤如下。
Ⅰ.制备
将乙腈、、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
Ⅱ.纯度分析
取mg产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成溶液。取溶液,加入指示剂后,再用标准溶液滴定至终点。平行滴定三次, 消耗EDTA溶液的平均体积为VmL。

已知:①沸点为81℃,酸性条件下遇水生成;
②较易被空气氧化;
③EDTA与形成1:1配合物;
④滴定需在弱碱性条件下进行。
回答下列问题:
(1)、图中仪器a的作用是;b中应加入作为最佳传热介质。(2)、加入过量铜粉能提高产物的纯度,可能的原因是。(3)、“一系列操作”依次为、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。(4)、与足量浓硝酸发生反应的离子方程式为。(5)、加入醋酸钠溶液的主要目的是。(6)、测得产品的纯度为(用含m、c、V的代数式表示)。(7)、下列情况会导致产品纯度测定结果偏高的有____。A、产品中含有 B、滴定终点时俯视读数 C、盛装EDTA溶液的滴定管未润洗 D、产品干燥不充分 -
16、工业尾气脱硝是减少空气污染的重要举措。回答下列问题:(1)、已知相关反应的热力学数据如下。
反应
①脱硝反应的。时,为了提高该反应中NO的平衡转化率,理论上可采取的措施是。
A.恒容时增大的压强 B.减小反应容器的容积
C.移去部分 D.选择合适的催化剂
②另一脱硝反应的。
(2)、模拟工业尾气脱硝:一定条件下,将的气体与Ar混合,匀速通过催化脱硝反应器,测得NO去除率和转化率随反应温度的变化如图。
当温度低于时,NO的去除率随温度升高而升高,可能原因是;高于时,NO的去除率随温度升高而降低,结合(1)的信息分析其可能原因是。
(3)、中国科学家利用Cu催化剂实现电化学脱硝。通过理论计算推测电解池阴极上NO可能的转化机理及转化步骤的活化能分别如下(*表示催化剂表面吸附位,如表示吸附于催化剂表面的NOH)。I.
Ⅱ.
Ⅲ.
Ⅳ.
V.
上述反应机理中,Ⅱ~V中速率最慢的步骤是。若电路中有电子流过,其中生成的选择性为95%,电解池阴极生成的的物质的量为mmol。
-
17、层状结构薄膜能用于制作电极材料。薄膜由辉钼矿(主要含及少量FeO、)制得后再与S经气相反应并沉积得到,其流程如下。
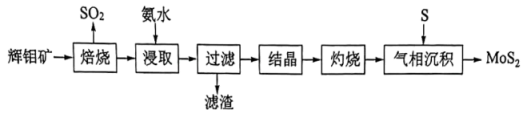
回答下列问题:
(1)、“焙烧”产生的用溶液吸收生成的离子方程式为。(2)、“焙烧”后的固体用氨水“浸取”得到重钼酸铵溶液,为提高“浸取”速率,可采用的措施是(举一例)。(3)、“灼烧”过程中需回收利用的气体是(填化学式)。(4)、在650℃下“气相沉积”生成的反应需在特定气流中进行,选用Ar而不选用形成该气流的原因是。(5)、层状晶体与石墨晶体结构类似,层状的晶体类型为。将嵌入层状充电后得到的可作电池负极,该负极放电时的电极反应式为。结合原子结构分析,能嵌入层间可能的原因是。 -
18、溶液滴定溶液时,、各含磷元素微粒的和的关系如图。下列说法中正确的是( )
 A、①为的与的关系 B、b点时,溶液中 C、的 D、d点时,溶液中存在着
A、①为的与的关系 B、b点时,溶液中 C、的 D、d点时,溶液中存在着 -
19、肼()是一种含氢量高的燃料。向恒容密闭容器内加入 , 一定条件下体系中存在以下平衡:I.Ⅱ.不同温度下达到平衡时,均几乎完全分解,分解产物的物质的量如图。下列说法正确的是( )
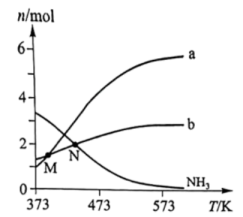 A、曲线a对应的物质是 B、低于M点对应温度时,以反应Ⅰ为主 C、体系中还存在 D、N点时,体系内为3:4
A、曲线a对应的物质是 B、低于M点对应温度时,以反应Ⅰ为主 C、体系中还存在 D、N点时,体系内为3:4 -
20、某镁镍合金储氢后所得晶体的立方晶胞如图1(为便于观察,省略了2个图2的结构),晶胞边长为apm。下列说法正确的是( )
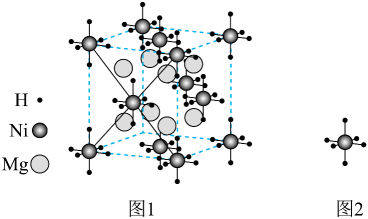 A、晶体的化学式为 B、晶胞中与1个Mg配位的Ni有6个 C、晶胞中2个Ni之间的最近距离为apm D、镁镍合金中Mg、Ni通过离子键结合
A、晶体的化学式为 B、晶胞中与1个Mg配位的Ni有6个 C、晶胞中2个Ni之间的最近距离为apm D、镁镍合金中Mg、Ni通过离子键结合