相关试卷
-
1、锡在材料、医药、化工等方面有广泛的应用,锡精矿中主要有、S、、、等杂质元素。下图为锡的冶炼工艺流程。

已知:性质稳定,难溶于酸。
回答下列问题:
(1)、锡的原子序数为50,其价层电子排布式为 , 在元素周期表中位于区。(2)、烟尘中的主要杂质元素是(填元素符号)。(3)、酸浸时,生成 , 该反应的离子方程式为 , 为了提高铅的浸出率,最宜添加 (填标号)。A. B. C. D.
(4)、还原时需加入过量的焦炭,写出该反应的化学方程式。(5)、电解精炼时,以和少量作为电解液,电源的负极与(填“粗锡”或“精锡”)相连;的作用是、。(6)、酸浸滤液中的可用沉淀,并通过与强碱反应获得 , 写出与熔融反应的化学方程式。 -
2、一定温度下,水溶液中、、的分布分数与的关系如下图。例如。向浓度为的氨水中通入气体。已知该温度下 , 下列说法正确的是( )
 A、通入时, B、当时, C、当时, D、P点时溶液的值为8.3
A、通入时, B、当时, C、当时, D、P点时溶液的值为8.3 -
3、朱砂(硫化汞)在众多先秦考古遗址中均有发现,其立方晶系型晶胞如下图所示,晶胞参数为anm,A原子的分数坐标为 , 阿伏加德罗常数的值为 , 下列说法正确的是( )
 A、S的配位数是6 B、晶胞中B原子分数坐标为 C、该晶体的密度是 D、相邻两个Hg的最短距离为
A、S的配位数是6 B、晶胞中B原子分数坐标为 C、该晶体的密度是 D、相邻两个Hg的最短距离为 -
4、马来酸依那普利(记为X,摩尔质量为M,)是一种心血管疾病防治药物,结构式为:

通常使用以下两种方法滴定分析样品中X的质量分数:
方法一:将mg样品溶于有机溶剂中,以的溶液滴定,终点消耗 , 计量关系为;
方法二:将mg样品溶于水中,以的溶液滴定,终点消耗 , 计量关系为。
下列说法正确的是( )
A、方法一滴定终点时, B、方法一 C、方法二滴定终点时, D、方法二 -
5、我国科学家成功利用CO还原NO,从源头上减少煤粉燃烧产生的大气污染。一定温度下,在1L的恒容密闭容器中,充入1molCO和1molNO,反应平衡时,测得c(N2)=0.2mol/L,下列说法正确的是( )A、升高温度,正、逆反应速率以相同倍数增大 B、加入催化剂使正反应速率加快,逆反应活化能增大 C、若往容器中再通入1molNO和1molCO2 , 则此时 D、若往容器中再通入2molCO和1molN2 , 则此时
-
6、光刻胶是芯片制造的关键材料。以下是一种光刻胶的酸解过程,下列说法正确的是( )
 A、X的单体属于碳酸酯 B、X在水中的溶解度大于Y C、Z中所有原子共平面 D、该酸解过程不含消去反应
A、X的单体属于碳酸酯 B、X在水中的溶解度大于Y C、Z中所有原子共平面 D、该酸解过程不含消去反应 -
7、配合物的制备步骤如下:
Ⅰ.称取 , 溶解于水中。
Ⅱ.称取 , 溶解于水中,80℃加热,得到砖红色溶液。
III.将步骤II配置的溶液加入到溶液中,加热搅拌约
IV.当溶液析出少量固体时,冷却,过滤,洗涤,烘干,称重。
下列说法错误的是( )
A、步骤II中可使用水浴加热 B、步骤III中为控制反应速率,应逐滴加入 C、步骤II中发生了水解 D、步骤IV中为提高纯度,可用热水洗涤 -
8、荜茇酰胺是从中药荜茇中提取的一种有抗癌活性的天然生物碱,结构如下图所示。下列说法正确的是( )
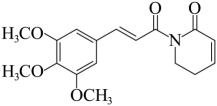 A、分子中有3种官能团 B、双键均为顺式结构 C、分子式为 D、不能使酸性高锰酸钾溶液褪色
A、分子中有3种官能团 B、双键均为顺式结构 C、分子式为 D、不能使酸性高锰酸钾溶液褪色 -
9、化合物是一种无机盐药物。已知为原子序数依次递增的短周期元素,同主族,同周期,基态原子轨道总电子数是轨道电子数的4倍,基态原子的未成对电子数相等。下列说法正确的是( )A、离子半径: B、电负性: C、简单氢化物沸点: D、难溶于水
-
10、水系电池在碳循环方面具有广阔的应用前景。该电池的示意图如下,其中双极膜在工作时催化解离为和 , 并在直流电场的作用下分别向两极迁移。下列说法正确的是( )
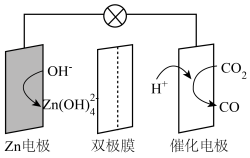 A、放电时,电极为负极,发生还原反应 B、充电时,从电极通过双极膜到达催化电极发生反应 C、放电时,催化电极上的反应为 D、充电时,电极上的反应为
A、放电时,电极为负极,发生还原反应 B、充电时,从电极通过双极膜到达催化电极发生反应 C、放电时,催化电极上的反应为 D、充电时,电极上的反应为 -
11、以下探究目的对应的实验方案最合适的是( )
实验方案
探究目的
A
向溶液中加入金属
比较和的还原能力
B
分别向稀硝酸和稀醋酸中加入铜粉
比较稀硝酸和稀醋酸的酸性强弱
C
将浓硫酸滴入乙醇中,加热至 , 生成的气体通入酸性重铬酸钾溶液
验证乙烯具有还原性
D
向溶液中同时通入和
比较和的氧化能力
A、A B、B C、C D、D -
12、火箭表面耐高温涂层的制备反应为。阿伏加德罗常数的值为 , 下列说法正确的是( )A、中共价键的数目为 B、中含有的中子数为 C、固体含有的数目为 D、消耗时,该反应中转移的电子数为
-
13、下图是一种改进的制备乙炔气体的装置。装置为自制仪器,下列仪器中与作用相同的是( )

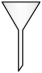

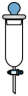
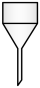
A.漏斗
B.分液漏斗
C.滴液漏斗
D.布氏漏斗
A、A B、B C、C D、D -
14、关于反应 , 下列说法正确的是( )A、分子中没有极性键 B、的模型和空间结构一致 C、的电子式为
 D、分子之间的范德华力强于氢键
D、分子之间的范德华力强于氢键
-
15、杭州亚运会首次实现亚运会“碳中和”,下列属于有机高分子材料的是( )A、“大莲花”场馆的主体结构材料——钢 B、场馆顶部的覆盖膜——聚四氟乙烯 C、场地的防滑涂层——石墨烯 D、主火炬使用的可再生燃料——甲醇
-
16、有机太阳能电池利用有机半导体将光能转换为电能。科学家设计了一种新型有机太阳能电池材料,其部分合成路线如下:
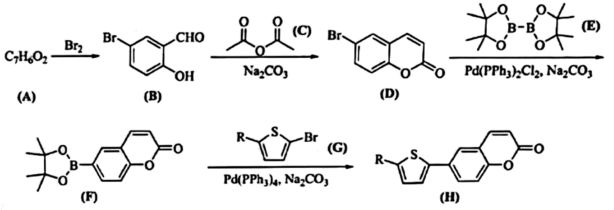 (1)、化合物A的含氧官能团有(填官能团名称)。(2)、化合物B的一种同分异构体能溶解于水溶液,遇不显色。核磁共振氢谱检测到三组峰(峰面积比为1:2:2),其结构简式为。(3)、化合物C的名称是 , 分子式是。(4)、由B到D的转化过程中涉及的反应类型有、和(5)、化合物E可通过频哪醇()和联硼酸()的脱水反应制备。频哪醇的结构简式是。(6)、某同学分析以上合成路线,发现制备化合物F和H的反应类型都属于反应。进而提出了化合物H的另外一种制备方法:首先在的催化下,化合物G与E反应合成新的化合物Ⅰ,其结构简式为。化合物Ⅰ在的催化下与化合物(写结构简式)反应即可生成化合物H。
(1)、化合物A的含氧官能团有(填官能团名称)。(2)、化合物B的一种同分异构体能溶解于水溶液,遇不显色。核磁共振氢谱检测到三组峰(峰面积比为1:2:2),其结构简式为。(3)、化合物C的名称是 , 分子式是。(4)、由B到D的转化过程中涉及的反应类型有、和(5)、化合物E可通过频哪醇()和联硼酸()的脱水反应制备。频哪醇的结构简式是。(6)、某同学分析以上合成路线,发现制备化合物F和H的反应类型都属于反应。进而提出了化合物H的另外一种制备方法:首先在的催化下,化合物G与E反应合成新的化合物Ⅰ,其结构简式为。化合物Ⅰ在的催化下与化合物(写结构简式)反应即可生成化合物H。 -
17、利用含锌废料(主要成分是氧化锌,含有少量铁、铝、铜、锰等金属氧化物或盐)制备氯化锌的一种工艺流程如下:
 (1)、为了提高盐酸浸取效率,可采取的措施有。(2)、浸取温度不宜超过60℃,原因是。(3)、为优化工艺流程,盐酸浸取后直接进行高锰酸钾氧化除杂。结合下列图表选择浸取工艺最佳范围为 , 理由是。
(1)、为了提高盐酸浸取效率,可采取的措施有。(2)、浸取温度不宜超过60℃,原因是。(3)、为优化工艺流程,盐酸浸取后直接进行高锰酸钾氧化除杂。结合下列图表选择浸取工艺最佳范围为 , 理由是。A.1.5~2.0 B.2.0~3.0 C.3.0~4.0 D.4.5~5.0

金属离子
开始沉淀的
沉淀完全的
6.8
8.3
3.7
4.7
1.8
2.8
5.2
6.7
8.6
10.1
6.7
8.2
(4)、滤渣的主要成分有、和 , 该工艺中去除锰的离子方程式为。(5)、最适宜使用的还原剂是 , 理由为。(6)、氯化锌溶液在蒸发浓缩过程中如操作不当将有碱式盐生成,该反应方程式为 , 产品中含量与蒸发温度关系如图所示,工艺要求含量不超过2.30%,降低产品中含量的方法有。
-
18、铜锈中含有和。有人提出腐蚀途径如下:
 (1)、上图所示晶体结构表示铜锈中物质(填写化学式)。(2)、过程①是典型的电化学腐蚀,其负极反应为(3)、过程③、④涉及的反应方程式包括:
(1)、上图所示晶体结构表示铜锈中物质(填写化学式)。(2)、过程①是典型的电化学腐蚀,其负极反应为(3)、过程③、④涉及的反应方程式包括:则的。
(4)、环境越潮湿、氧气含量越、气温越 , 铜的腐蚀越严重。(5)、铜锈还含有 , 其分解方程式为:。该反应的随温度的变化关系如图所示,分解的最低温度为K,当温度从升高到时,平衡向移动,判定理由是。 (6)、某温度下,在恒容密闭容器中的分解达平衡时,容器内压强为 , 则反应平衡常数。(7)、 分解过程中总压强随时间的变化关系如图所示,则在内,的平均生成速率。
(6)、某温度下,在恒容密闭容器中的分解达平衡时,容器内压强为 , 则反应平衡常数。(7)、 分解过程中总压强随时间的变化关系如图所示,则在内,的平均生成速率。
-
19、某兴趣小组利用氢离子交换树脂吸附溶液中其他阳离子,同时交换出氢离子的特性(如图所示),设计了测定溶度积常数的实验。准确量取饱和溶液于烧杯中,加入过量的阳离子交换树脂,充分搅拌,静置,过滤,使用蒸馏水洗涤离子交换树脂至洗涤液呈中性,合并滤液和洗涤液至锥形瓶,用滴定法测定锥形瓶中氢离子的物质的量,计算出溶度积常数。()
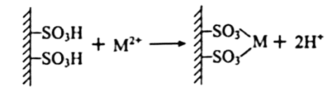 (1)、下列仪器中,本实验用不到的有(写名称)。
(1)、下列仪器中,本实验用不到的有(写名称)。 (2)、配制饱和溶液时需要使用煮沸后的蒸馏水,原因是。(3)、判断洗涤液已至中性的方法是。(4)、过滤后的溶液中发现有树脂小颗粒,此时应该。(5)、若实验使用的烧杯未干燥,测定结果(填“偏高”,“偏低”或“不变”)。(6)、为了测定锥形瓶中氢离子的物质的量,使用浓度为的氢氧化钠溶液进行滴定,可选用为指示剂,滴定终点现象为。到达滴定终点时,消耗溶液,则的(写出计算式)。(7)、兴趣小组对实验进行讨论,某同学提出可以利用该方法测定的 , 是否可行,原因是。
(2)、配制饱和溶液时需要使用煮沸后的蒸馏水,原因是。(3)、判断洗涤液已至中性的方法是。(4)、过滤后的溶液中发现有树脂小颗粒,此时应该。(5)、若实验使用的烧杯未干燥,测定结果(填“偏高”,“偏低”或“不变”)。(6)、为了测定锥形瓶中氢离子的物质的量,使用浓度为的氢氧化钠溶液进行滴定,可选用为指示剂,滴定终点现象为。到达滴定终点时,消耗溶液,则的(写出计算式)。(7)、兴趣小组对实验进行讨论,某同学提出可以利用该方法测定的 , 是否可行,原因是。 -
20、多组分反应可将多个原料分子一次性组合生成目标分子。我国科学家利用多组分反应合成了一种亲水亲脂分子车用于输送药物分子。下列说法正确的是( )
 A、该分子车含有四个肽键 B、是亲水基团 C、该分子车含酰胺官能团 D、该反应原子利用率可达100%
A、该分子车含有四个肽键 B、是亲水基团 C、该分子车含酰胺官能团 D、该反应原子利用率可达100%