相关试卷
-
1、实验是探究元素化合物性质的重要方法。利用下列实验装置和试剂能实现相应元素不同价态间转化的是( )

选项
试剂
元素不同价态间的转化
a
b
c
A
硫酸
亚硫酸钠
新制氯水
B
稀硫酸
硫化亚铁
氯化铁溶液
C
浓硝酸
铜片
水
D
浓盐酸
高锰酸钾
溴化钾溶液
A、A B、B C、C D、D -
2、烟气脱硫可有效减少引起的大气污染,同时还可得到有用产品。传统湿法脱硫多以碱性物质作吸收剂,新型脱硫方法选用离子液体(指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。已知时,几种酸的电离常数: , ; , ;(乳酸)。研究发现:乳酸和乙醇胺()作用得到的离子液体——乙醇胺乳酸盐(),既可脱硫,也可吸收CO2。下列说法错误的是( )A、液态时的导电性:乳酸 B、乳酸和乙醇胺中均含有键、键和氢键 C、是直线形非极性分子,是形极性分子 D、相同条件下,能吸收气体的体积:
-
3、烟气脱硫可有效减少引起的大气污染,同时还可得到有用产品。传统湿法脱硫多以碱性物质作吸收剂,新型脱硫方法选用离子液体(指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。已知时,几种酸的电离常数: , ; , ;(乳酸)。传统湿法脱硫涉及的下列离子方程式中,正确的是( )A、烟气与氧化镁浆液的反应: B、烟气与石灰石浆液反应得到石膏: C、烟气与氨水反应得到硫酸铵: D、烟气与海水中的反应:
-
4、聚富马酸丙二醇酯是一种医用高分子材料,可由如下反应制备:

下列说法错误的是( )
A、富马酰氯存在顺式异构体 B、丙二醇可由油脂水解得到 C、该反应为缩聚反应 D、聚富马酸丙二醇酯可降解 -
5、研究发现由铝原子构成的和团簇阴离子都能与水自发反应产生氢气。下列说法正确的是( )A、和互为同位素 B、与水反应时作还原剂 C、是由铝原子通过离子键结合而成 D、的含个电子
-
6、化学与生活联系紧密。下列说法正确的是( )A、白酒和食醋都可由淀粉发酵得到 B、氨基酸和核酸都是构成生命物质的生物大分子 C、二氧化氯和明矾用于水处理时的原理相同 D、供糖尿病患者食用的“无糖食品”专指不含蔗糖的食品
-
7、敦煌壁画是我国灿烂的艺术瑰宝,也是颜料应用的重要科技史料。下列有关我国传统颜料主要成分的变化,发生氧化还原反应的是( )A、骨白遇氟盐转化为 B、铅白遇得到黑色 C、石绿受热分解得到黑色 D、石黄(和)在地表逐渐转化为硫酸盐
-
8、抗疟疾药物阿莫地喹的合成路线如下图。

回答下列问题:
(1)、A中含氧官能团的名称为和。(2)、由A生成C的反应类型为。(3)、D的结构简式为。(4)、多聚甲醛可以用甲醛代替,则H、I和甲醛反应生成J的方程式为。(5)、H的同分异构体中,含羧基、苯环,不含氨基()的有种(不考虑立体异构)。(6)、抗癌药物乐伐替尼中间体的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为和。
-
9、天然气、石油钻探过程会释放出CO2、H2S等气体。某种将CO2和H2S共活化的工艺涉及反应如下:
①
②
③
④
恒压密闭容器中,反应物的平衡转化率、部分生成物的选择性与温度关系如图所示。
已知:i.CO2和H2S的初始物质的量相等:
ii.产率=转化率×选择性:
iii.COS的选择性 , H2O的选择性。
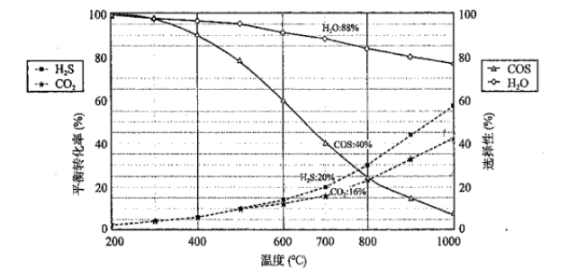
回答下列问题:
(1)、COS分子的空间结构为形。(2)、。(3)、以下温度,COS的产率最高的是____。A、 B、 C、 D、(4)、温度高于500℃时,H2S的转化率大于CO2 , 原因是。(5)、可提高S2平衡产率的方法为____。A、升高温度 B、增大压强 C、降低温度 D、充入氩气(6)、700℃时反应①的平衡常数K=(精确到0.01)。(7)、催化剂CeO2-MgO对反应②具有高选择性,通过理论计算得到反应的主要路径如下图所示。表示状态2的为____。 A、
A、 B、
B、 C、
C、
-
10、芳基亚胺酯是重要的有机反应中间体,受热易分解,可由腈在酸催化下与醇发生Pinner反应制各,原理如下图所示。
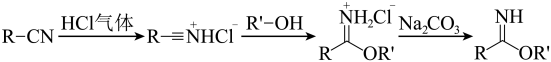
某实验小组以苯甲腈(
 , )和三氟乙醇( , ) 为原料合成苯甲亚胺三氟乙脂。步骤如下:
, )和三氟乙醇( , ) 为原料合成苯甲亚胺三氟乙脂。步骤如下:I.将苯甲腈与三氟乙醇置于容器中,冰浴降温至。
Ⅱ.向容器中持续通入气体4小时,密封容器。
Ⅲ.室温下在氛围中继续搅拌反应液24小时,冷却至 , 抽滤得白色固体,用乙腈洗涤。
IV.将洗涤后的白色固体加入饱和溶液中,低温下反应,有机溶剂萃取3次,合并有机相。
V.向有机相中加入无水 , 过滤,蒸去溶剂得产品。
回答下列问题:
(1)、实验室中可用浓盐酸和无水制备干燥气体,下列仪器中一定需要的为(填仪器名称)。 (2)、第Ⅱ步通气完毕后,容器密封的原因为。(3)、第Ⅲ步中得到的白色固体主要成分为。
(2)、第Ⅱ步通气完毕后,容器密封的原因为。(3)、第Ⅲ步中得到的白色固体主要成分为。 (4)、第IV步中选择低温的原因为。(5)、第IV步萃取时可选用的有机溶剂为____。A、丙酮 B、乙酸 C、乙酸乙酯 D、甲醇(6)、第V步中无水的作用为。(7)、本实验的产率为。
(4)、第IV步中选择低温的原因为。(5)、第IV步萃取时可选用的有机溶剂为____。A、丙酮 B、乙酸 C、乙酸乙酯 D、甲醇(6)、第V步中无水的作用为。(7)、本实验的产率为。 -
11、是一种重要的含锶化合物,广泛应用于许多领域。以天青石(主要成分为)为原料制备的一种工艺方法如下:

天青石主要元素质量分数如下:
元素
质量分数()
36.4
2.0
4.0
0.5
5.0
。
回答下列问题:
(1)、天青石与碳粉在一定投料比下“煅烧”生成和碳氧化物,据矿样成分分析结果计算得出,生成、时失重率分别为、 , 实际热重分析显示失重率为32.6%,则“煅烧”中主要生成的碳氧化物为(填“”或“”)。(2)、“煅烧”过程中还可能产生少量对环境有危害的气体,化学式为和。(3)、“水浸”后滤渣的主要成分除和C外,还有两种氧化物,化学式为和。(4)、“水浸”时需加热,与热水作用后的溶液呈碱性的主要原因为(用化学方程式表示)(5)、“水浸”后的滤液中 , “除杂”过程中(忽略溶液引起的体积变化),为使不沉淀,应控制溶液中 , 每升滤液中篇加入溶液的体积。(6)、“沉锶”过程中,可溶性发生反应的离子方程式为。 -
12、室温下,向、均为的混合溶液中持续通入气体,始终保持饱和(的物质的量浓度为),通过调节使、分别沉淀,溶液中与的关系如下图所示。其中,c表示、、和的物质的量浓度的数值,。下列说法错误的是( )
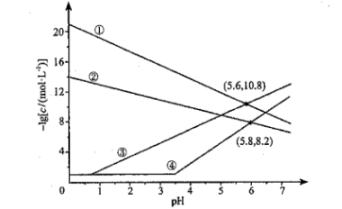 A、①代表与的关系曲线 B、逐渐增大时,溶液中优先析出的沉淀为 C、的 D、的平衡常数
A、①代表与的关系曲线 B、逐渐增大时,溶液中优先析出的沉淀为 C、的 D、的平衡常数 -
13、某生物质电池原理如下图所示,充、放电时分别得到高附加值的醇和羧酸。下列说法正确的是( )
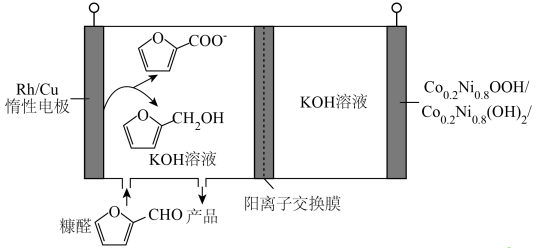 A、放电时,正极电极反应为:
A、放电时,正极电极反应为: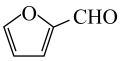 +H2O-2e-=
+H2O-2e-=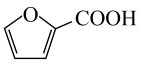 +2H+
B、放电时,转化为
C、充电时,通过交换膜从左室向右室迁移
D、充电时,阴极电极反应为:
+2H+
B、放电时,转化为
C、充电时,通过交换膜从左室向右室迁移
D、充电时,阴极电极反应为: +2H2O+2e-=
+2H2O+2e-=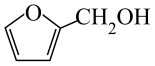 +2OH-
+2OH-
-
14、下列各组实验所得结论或推论正确的是( )
实验现象
结论或推论
A
向某有机物()中滴加溶液,显色
该有机物分子中含酚羟基
B
向酸性高锰酸钾溶液中加入甲苯,紫色褪去
甲苯同系物均有此性质
C
向银氨溶液中滴加某单糖溶液,形成银镜
该糖属于还原糖
D
测得两溶液导电能力相同
两溶液物质的量浓度相等
A、A B、B C、C D、D -
15、实验室合成高铁酸钾()的过程如下图所示。下列说法错误的是( )
 A、气体a的主要成分为 B、沉淀b的主要成分为 C、中的化合价为 D、反应2为
A、气体a的主要成分为 B、沉淀b的主要成分为 C、中的化合价为 D、反应2为 -
16、如图,b为标准氢电极,可发生还原反应()或氧化反应(),a、c分别为、电极。实验发现:1与2相连a电极质量减小,2与3相连c电极质量增大。下列说法正确的是( )
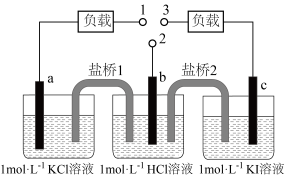 A、1与2相连,盐桥1中阳离子向b电极移动 B、2与3相连,电池反应为 C、1与3相连,a电极减小的质量等于c电极增大的质量 D、1与2、2与3相连,b电极均为流出极
A、1与2相连,盐桥1中阳离子向b电极移动 B、2与3相连,电池反应为 C、1与3相连,a电极减小的质量等于c电极增大的质量 D、1与2、2与3相连,b电极均为流出极 -
17、镍酸镧电催化剂立方晶胞如图所示,晶胞参数为a,具有催化活性的是 , 图①和图②是晶胞的不同切面。下列说法错误的是( )
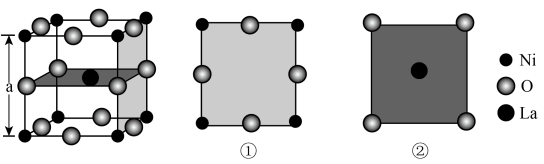 A、催化活性:①>② B、镍酸镧晶体的化学式为 C、周围紧邻的O有4个 D、和的最短距离为
A、催化活性:①>② B、镍酸镧晶体的化学式为 C、周围紧邻的O有4个 D、和的最短距离为 -
18、某离子液体结构如下图所示。W、X、Y、Z原子序数依次增大,W、X和Y的原子序数之和为14,X和Y基态原子的核外未成对电子数之和为5,Z是第四周期元素。下列说法错误的是( )
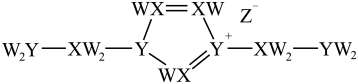 A、X、Z的简单氢化物均可溶于水 B、电负性: C、第一电离能: D、W、Y、Z可形成既含离子键又含共价键的化合物
A、X、Z的简单氢化物均可溶于水 B、电负性: C、第一电离能: D、W、Y、Z可形成既含离子键又含共价键的化合物 -
19、高分子的循环利用过程如下图所示。下列说法错误的是(不考虑立体异构)( )
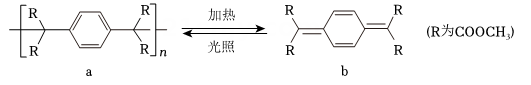 A、b生成a的反应属于加聚反应 B、a中碳原子杂化方式为和 C、a的链节与b分子中氢元素的质量分数不同 D、b与发生加成反应最多可生成4种二溴代物
A、b生成a的反应属于加聚反应 B、a中碳原子杂化方式为和 C、a的链节与b分子中氢元素的质量分数不同 D、b与发生加成反应最多可生成4种二溴代物 -
20、下列化学方程式或离子方程式正确的是( )A、氢氟酸溶蚀石英玻璃: B、盐酸除锅炉水垢: C、溶液吸收电石气中的: D、侯氏制碱法: