相关试卷
-
1、金属M在潮湿的空气中会形成一层致密稳定的3M(XY)2•MZX3 , X、Y、Z为短周期主族元素,X的原子序数是Y的8倍,基态X和Z的未成对电子数相同,M是人体必需的元素之一。1molMZX3 , 含有42mol质子,下列说法正确的是( )A、离子半径:M>X B、X、Y、Z的电负性大小为:X>Z>Y C、M的最高价氧化物对应水化物为强碱 D、第一电离能:Z>X
-
2、下列离子方程式书写正确的是( )A、白醋与次氯酸钠溶液混合产生黄绿色气体: B、四氧化三铁溶于足量稀硝酸: C、向溶液中通入过量: D、向氯化铝溶液中加入过量浓氨水:
-
3、下列根据实验现象得出结论不正确的是( )A、氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 B、向溴水中通入SO2 , 溶液褪色,说明SO2具有漂白性 C、向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D、向SO2水溶液中加入NaHCO3粉末,有气泡产生,说明H2SO3酸性强于H2CO3
-
4、下列说法不正确的是( )A、做“海带中碘元素的分离及检验”实验时,须用过量的氯气或双氧水氧化I- B、冷却结晶时,溶液冷却得越快,析出的晶体颗粒就越小 C、其他条件相同时,双氧水在碱性溶液中分解速率比在酸性溶液中快 D、如果酸液溅入眼内,用大量水冲洗后,立即送医院诊治
-
5、官能团决定有机物的化学特性。下列有机物中,既能使溴水褪色又能跟金属钠反应,还可以和碳酸钠溶液反应的是( )A、CH2=CHCH2OH B、CH2CHCHO C、CH2=CHCOOH D、CH2=CHCOOCH3
-
6、为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,中含有的氯原子数为 B、溶液中的数目为 C、密闭容器中,和在催化剂作用下充分反应后分子总数为 D、1molNa与足量反应生成和的混合物,转移的电子数为
-
7、下列有关说法正确的是( )A、钢铁发生电化学腐蚀的负极反应式: B、用Pt电极电解一定量的稀硫酸溶液,电解一段时间后溶液的pH值不变 C、电解精炼铜时,电解质溶液中均保持不变 D、金属Cu无论在酸性条件下,还是在碱性条件下发生的都是吸氧腐蚀
-
8、下列各组物质中,按沸点由低到高的顺序排列正确的是( )A、H2O、H2S、H2Se、H2Te B、CH4、CCl4、CBr4、CI4 C、金刚石、P4、O2 D、碳化硅、二氧化硅、晶体硅
-
9、胶体有别于其他分散系的本质区别是( )A、分散质粒子大小在1~100 nm B、能透过滤纸 C、电泳 D、丁达尔效应
-
10、非天然氨基酸AHPA是一种重要的药物中间体,其合成路线之一如下:
 (1)、A可由氧化得到,的化学名称是。(2)、C的结构简式为。(3)、D中手性碳原子数目为。(4)、E转化为AHPA的反应类型为。(5)、AHPA中酸性官能团名称为 , 碱性官能团名称为。(6)、写出同时满足下列条件的AHPA的同分异构体的结构简式。
(1)、A可由氧化得到,的化学名称是。(2)、C的结构简式为。(3)、D中手性碳原子数目为。(4)、E转化为AHPA的反应类型为。(5)、AHPA中酸性官能团名称为 , 碱性官能团名称为。(6)、写出同时满足下列条件的AHPA的同分异构体的结构简式。①含苯环且苯环只有一个取代基;
②红外光谱显示含氧官能团只有和;
③核磁共振氢谱显示有6组峰,峰面积比为4∶2∶2∶2∶2∶1。
(7)、参照上述合成路线,设计以苄基氯(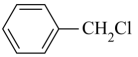 )为主要原料制备
)为主要原料制备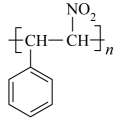 的合成路线(其他原料、试剂任选)。
的合成路线(其他原料、试剂任选)。 -
11、丙烷价格低廉且产量大,而丙烯及其衍生物具有较高的经济附加值,因此丙烷脱氢制丙烯具有重要的价值。回答下列问题:(1)、已知下列反应的热化学方程式:
①直接脱氢:
②
计算氧化丙烷脱氢反应③的。
(2)、已知下列键能数据,结合反应①数据,计算的键能是。化学键
键能
347.7
413.4
436.0
(3)、一定条件下,反应①中丙烷平衡转化率与平衡常数的关系可表示为: , 式中为系统总压。分别为和时,丙烷平衡转化率与温度的关系如图所示,其中表示下的关系曲线是(填“Ⅰ”或“Ⅱ”)。时,(保留2位有效数字)。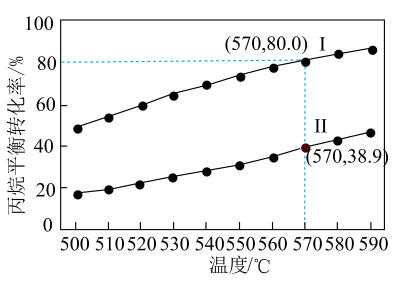 (4)、研究人员利用作催化剂,对反应③的机理开展研究。以和为原料,初期产物中没有检测到;以含有的和为原料,反应过程中没有检测到。下列推断合理的是____(填标号)。A、先吸附氧气,吸附的氧气直接与吸附的丙烷反应 B、直接氧化吸附的丙烷,吸附的氧气补充中反应掉的氧 C、催化丙烷脱氢过程中,碳氢键的断裂是可逆的(5)、研究人员尝试利用氧化丙烷脱氢制丙烯,与氧化丙烷脱氢制丙烯相比,使用的优点有(写出两点即可)。(6)、一种基于的锌基催化剂,可高效催化丙烷转化为丙烯。立方的晶胞如图,晶胞参数为与间的最小距离为 , 晶体密度为(列出计算式,阿伏加德罗常数的值为)。
(4)、研究人员利用作催化剂,对反应③的机理开展研究。以和为原料,初期产物中没有检测到;以含有的和为原料,反应过程中没有检测到。下列推断合理的是____(填标号)。A、先吸附氧气,吸附的氧气直接与吸附的丙烷反应 B、直接氧化吸附的丙烷,吸附的氧气补充中反应掉的氧 C、催化丙烷脱氢过程中,碳氢键的断裂是可逆的(5)、研究人员尝试利用氧化丙烷脱氢制丙烯,与氧化丙烷脱氢制丙烯相比,使用的优点有(写出两点即可)。(6)、一种基于的锌基催化剂,可高效催化丙烷转化为丙烯。立方的晶胞如图,晶胞参数为与间的最小距离为 , 晶体密度为(列出计算式,阿伏加德罗常数的值为)。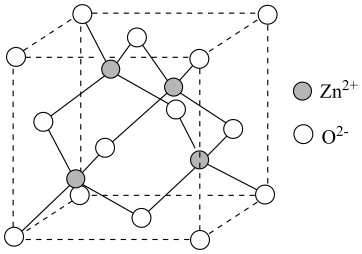
-
12、钼()及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以和形式存在,从镍钼矿中分离钼,并得到的一种工艺流程如下:
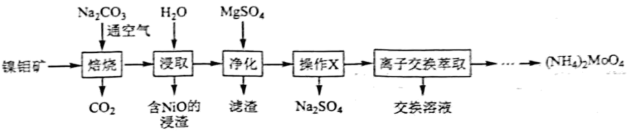
回答下列问题:
(1)、位于元素周期表第周期第族。中钼元素的化合价为。(2)、“焙烧”中生成的化学方程式为。(3)、用量对钼浸出率和浸取液中浓度的影响如图1所示,分析实际生产中选择用量为理论用量1.2倍的原因:。 (4)、的溶解度曲线如图2所示,为充分分离 , 工艺流程中的“操作”应为____(填标号)。
(4)、的溶解度曲线如图2所示,为充分分离 , 工艺流程中的“操作”应为____(填标号)。 A、蒸发结晶 B、低温结晶 C、蒸馏 D、萃取(5)、为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“”步骤。(6)、分解可得。高温下,用铝粉还原得到金属钼的化学方程式为。
A、蒸发结晶 B、低温结晶 C、蒸馏 D、萃取(5)、为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“”步骤。(6)、分解可得。高温下,用铝粉还原得到金属钼的化学方程式为。 -
13、是一种易溶于热水,难溶于乙醇的紫红色晶体。可通过如下实验步骤制备。
Ⅰ.将适量氯化铵溶于浓氨水中,搅拌下,分批次加入研细的 , 得到沉淀。
Ⅱ.边搅拌边慢慢滴入足量溶液,得到溶液。
Ⅲ.慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤。
Ⅳ.依次用不同试剂洗涤晶体,烘干,得到产品。
回答下列问题:
(1)、本实验涉及钴配合物的配体有(填化学式)。(2)、本实验应在通风橱中进行,原因是。(3)、步骤Ⅰ中分批次加入研细的 , 原因是。(4)、步骤Ⅱ发生反应的离子方程式是。(5)、步骤Ⅳ中使用的洗涤试剂有:①冷水 ②乙醇 ③冷的盐酸 ④丙酮。试剂使用的先后顺序是:①④(填序号)。(6)、已知:;。则在水溶液中的稳定性:(填“大于”或“小于”)。(7)、本实验的产率最接近于____(填标号)。A、 B、 C、 D、 -
14、科研人员利用高压气流将水微滴喷射到涂覆催化剂的石墨网上,研究常温制氨,其反应历程中微粒转化关系如图1,相对能量变化关系如图2,图中*表示催化剂表面吸附位。下列说法正确的是( )
 A、过程中发生非极性键的断裂与形成 B、Ⅰ转化为和的过程中会生成 C、Ⅱ表示的微粒符号是 D、反应历程中放热最多的反应是
A、过程中发生非极性键的断裂与形成 B、Ⅰ转化为和的过程中会生成 C、Ⅱ表示的微粒符号是 D、反应历程中放热最多的反应是 -
15、我国学者用氮气为氮源高效合成了活性氮物质 , 用于多种高附加值含氮化合物的合成。可与乙醇、有机卤代物等反应,其制备及转化为物质甲的过程如下:

下列说法错误的是( )
A、反应Ⅰ实现了氮的固定 B、的电子式为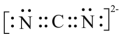 C、反应Ⅱ中的溶剂可为水
D、物质甲中碳原子的杂化轨道类型有和
C、反应Ⅱ中的溶剂可为水
D、物质甲中碳原子的杂化轨道类型有和
-
16、向溶液中滴加溶液,发生反应和。与的关系如下图所示(其中代表或)。下列说法错误的是( )
 A、时,溶液中 B、时,溶液中 C、的平衡常数的值为 D、用沉淀 , 溶液中浓度过大时,沉淀效果不好
A、时,溶液中 B、时,溶液中 C、的平衡常数的值为 D、用沉淀 , 溶液中浓度过大时,沉淀效果不好 -
17、我国学者研制了一种锌基电极,与涂覆氢氧化镍的镍基电极组成可充电电池,其示意图如下。放电时,转化为。下列说法错误的是( )
 A、放电时,正极反应为: B、放电时,若外电路有电子转移,则有向正极迁移 C、充电时,为外接电源负极 D、充电时,阴极反应为:
A、放电时,正极反应为: B、放电时,若外电路有电子转移,则有向正极迁移 C、充电时,为外接电源负极 D、充电时,阴极反应为: -
18、根据下列实验事实能得出相应结论的是( )
选项
实验事实
结论
A
常温下,分别向等体积的盐酸和硫酸中加入大小相同的铝片,前者反应速率更快
电离程度:盐酸>硫酸
B
常温下,分别向无水乙醇和冰醋酸中加入大小相同的金属钠,前者反应更剧烈
分子中氢氧键的极性:乙酸>乙醇
C
常温下,分别向浓度均为的和溶液中通入气体至饱和,仅后者生成沉淀
溶度积常数:
D
在和时,测得溶液的分别是9.66和9.37
水解常数:
A、A B、B C、C D、D -
19、稀土被称为新材料的宝库。稀土中的镧系离于可用离子交换法分离,其反应可表示为:。某温度时,随时间变化关系如图所示。下列说法正确的是( )
 A、时的正反应速率大于时的逆反应速率 B、时间段的平均反应速率为: C、时增大 , 该平衡左移,平衡常数减小 D、时离子交换反应停止
A、时的正反应速率大于时的逆反应速率 B、时间段的平均反应速率为: C、时增大 , 该平衡左移,平衡常数减小 D、时离子交换反应停止 -
20、某含铜催化剂的阴离子的结构如图所示。是原子序数依次增大的短周期元素,其中位于同一周期,基态原子的价电子排布式为。下列说法错误的是( )
 A、该阴离子中铜元素的化合价为 B、元素电负性: C、基态原子的第一电离能: D、均位于元素周期表的区
A、该阴离子中铜元素的化合价为 B、元素电负性: C、基态原子的第一电离能: D、均位于元素周期表的区