相关试卷
-
1、磷酸聚合可以生成链状多磷酸和环状多磷酸,三分子磷酸聚合形成的链状三磷酸结构如图所示。下列说法正确的是( )
 A、键能: B、元素的电负性: C、的空间构型:平面四边形 D、六元环状三磷酸的分子式:
A、键能: B、元素的电负性: C、的空间构型:平面四边形 D、六元环状三磷酸的分子式: -
2、某种快速充电器所使用的半导体材料是氮化镓(GaN),半导体材料还有GaY、GaZ、XW等。W、X、Y、Z在周期表中相对位置如下所示,其中W的一种同位素可用于文物年代测定。下列说法正确的是( )
W
X
Y
Ga
Z
A、原子半径:Z>Ga B、XW属于共价晶体 C、简单氢化物的稳定性:X>Y D、最高价氧化物对应水化物的酸性:Z>Y -
3、劳动创造美好生活。下列劳动者的工作内容所涉及化学知识错误的是( )
选项
工作内容
化学知识
A
工程师在船舶外壳安装锌块保护船体
此电化学保护中锌块作正极
B
医生为糖尿病患者开处方并叮嘱患者控制米饭类食物的摄入量
淀粉能水解生成葡萄糖
C
污水处理员利用硫酸铝、聚合氯化铝等混凝剂除去水体中的细小悬浮物
混凝剂遇水可形成胶体吸附悬浮物而聚沉
D
园艺师给花卉施肥时,草木灰和铵态氮肥不混合施用
碳酸钾和铵盐相互促进水解降低氮肥的肥效
A、A B、B C、C D、D -
4、苯甲酰胺是常见的酰胺类物质,可用于合成农药和医药,其结构简式如图所示。下列说法正确的是( )
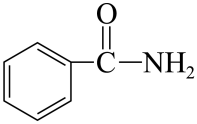 A、分子式为 B、分子中含有1个手性碳原子 C、分子中碳原子的杂化轨道类型是 D、在碱性条件下加热水解,可生成苯甲酸盐和氨
A、分子式为 B、分子中含有1个手性碳原子 C、分子中碳原子的杂化轨道类型是 D、在碱性条件下加热水解,可生成苯甲酸盐和氨 -
5、下列生产活动中对应的离子方程式正确的是( )A、用溶液蚀刻覆铜板制作印刷电路板: B、向冷的石灰乳中通入制漂白粉: C、用溶液除去锅炉水垢中的: D、用丙烯腈电合成己二腈,在阳极发生的电极反应:
-
6、根据实验目的,下列实验所采用的实验方法和主要仪器错误的是( )
实验目的
柑橘中有机酸含量的测定
菠菜中叶绿素的色谱分离
茶叶中钙离子的沉淀分离
海带提碘过程中碘单质的萃取分离
实验方法
酸碱滴定法
离子交换法
沉淀法
萃取法
主要仪器




选项
A
B
C
D
A、A B、B C、C D、D -
7、为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,含有的中子数为 B、常温下,中含有的孤电子对数为 C、溶液中含有的数为 D、和足量充分反应转移的电子数为
-
8、可用作白色颜料和阻燃剂,在实验室中可利用的水解反应制取,总反应可表示为。下列化学用语表示正确的是( )A、的电子式:
 B、基态原子价层电子排布图:
B、基态原子价层电子排布图: C、和互为同位素
D、的VSEPR模型:
C、和互为同位素
D、的VSEPR模型:
-
9、奋进中的贵州取得了举世瞩目的成就,对下列成就涉及的化学知识说法错误的是( )A、“中国天眼”所使用的钢铁结构圈梁属于金属合金材料 B、“大数据中心”的电子设备芯片使用的材料是二氧化硅 C、“中国桥梁看贵州”,建造桥梁的水泥属于硅酸盐材料 D、“县县通高速”,高速路面使用的改性沥青是有机材料
-
10、研究NO2、SO2、等大气污染气体的处理具有重要意义。(1)、NO2可用水吸收,相应的化学反应方程式为。
利用反应6NO2+8NH3 7N2+12H2O也可处理NO2 . 当转移6mol电子时,消耗的NO2在标准状况下是L。
(2)、已知:2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ•mol﹣12NO(g)+O2(g)⇌2NO2(g)△H=﹣113.0kJ•mol﹣1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g) 的△H=kJ•mol﹣1。
(3)、一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO2的体积比保持不变 d.每消耗1mol SO3的同时生成1molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=。
-
11、(1)、如图所示,某同学设计了一个燃料电池探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。(甲醚CH3OCH3)
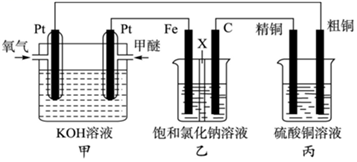
①写出甲装置中通入甲醚一极的电极反应式:。
②写出乙该装置中的总反应的化学方程式:。
③电解一段时间后,丙装置中精铜质量增加9.6g,则消耗甲醚(标准状况下)体积为mL。
(2)、用NaOH溶液吸收烟气中的SO2 , 将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4 , 其原理如图所示(电极材料为石墨)。(提示:放电顺序SO32﹣>OH﹣)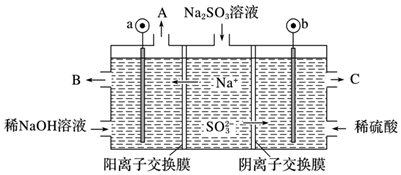
①图中b极要连接电源的 (填“正”或“负”)极。
②SO32﹣放电的电极反应式为 。
-
12、已知:I2+2S2O32═S4O62﹣+2I﹣ . 相关物质的溶度积常数见下表:
物质
Cu(OH)2
Fe(OH)3
CuCl
CuI
Ksp
2.2×10﹣20
2.6×10﹣39
1.7×10﹣7
1.3×10﹣12
(1)、某酸性CuCl2溶液中含有少量的FeCl3 , 为得到纯净的CuCl2•2H2O晶体,加入 , (填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= . 过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.(2)、由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是 .(3)、某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I﹣发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.①CuCl2溶液与KI反应的离子方程式为 .
②该试样中CuCl2•2H2O的质量百分数为 .
-
13、25℃时,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )
 A、点①所示溶液:c(CH3COO﹣)+c(CH3COOH)=c(Na+) B、点②所示溶液:c(Na+)=c(CH3COO﹣)>c(H+)=c(OH﹣) C、点③所示溶液:c(Na+)>c(OH﹣)>c(CH3COO﹣)>c(H+) D、滴定终点时:c(CH3COOH)+c(CH3COO﹣)=c(Na+)
A、点①所示溶液:c(CH3COO﹣)+c(CH3COOH)=c(Na+) B、点②所示溶液:c(Na+)=c(CH3COO﹣)>c(H+)=c(OH﹣) C、点③所示溶液:c(Na+)>c(OH﹣)>c(CH3COO﹣)>c(H+) D、滴定终点时:c(CH3COOH)+c(CH3COO﹣)=c(Na+) -
14、下列溶液肯定呈酸性的是( )A、含有H+的溶液 B、酚酞显无色的溶液 C、c(OH﹣)<c(H+)的溶液 D、pH小于7的溶液
-
15、已知:①某新型电源以铜片和放射性核素镍﹣63(6328Ni)作为电极材料,利用镍﹣63发生β裂变时释放电子,通过外电路流向铜片,从面提供电能.
②以石墨为阴极,铜片为阳极电解KI溶液可制取CuI白色沉淀(已知:2Cu2++4I﹣═2CuI↓+I2).若通电前向溶液中加入少量酚酞和淀粉溶液,电解开始不久阴极区溶液呈红色,而阳极区呈蓝色.
下列说法正确的是( )
A、①中铜片相当于原电池的负极 B、②中阳极的电极反应为:2I﹣﹣2e﹣═I2 , 生成的碘遇淀粉使阳极区呈蓝色 C、②中阳极的电极反应为:Cu﹣2e﹣═Cu2+ , 生成的Cu2+使阳极区呈蓝色 D、②中阴极的电极反应为:2H++2e﹣═H2↑,导致c(OH﹣)>c(H+),使阴极区呈红色 -
16、室温下,通过下列实验探究0.01000mol/LNa2C2O4溶液的性质:
实验1:实验测得0.01000mol/LNa2C2O4溶液pH为8.6
实验2:向溶液中滴加等体积0.01000mol/LHCl溶液,pH由8.6降为4.8
实验3:向溶液中加入等体积0.0200mol/LCaCl2溶液,出现白色沉淀
实验4:向稀硫酸酸化的KMnO4溶液中滴加Na2C2O4溶液至溶液褪色
下列说法不正确的是( )
A、0.0100mol•L﹣1Na2C2O4溶液中满足:c(Na+)>c(C2O42﹣)>c(OH﹣)>c(HC2O4﹣)>c(H+) B、实验2滴加盐酸过程中存在某一点满足:c(Na+)=2c(C2O42﹣)+c(HC2O4﹣)+c(Cl﹣) C、实验3所得上层清液中c(C2O42﹣)=5×10﹣5mol/L[已知室温时Ksp(CaC2O4)=2.5×10﹣9] D、实验4发生反应的离子方程式为:5C2O42﹣+2MnO4﹣+16H+═10CO2↑+2Mn2++8H2O -
17、室温下,下列说法中正确的是( )A、室温下,盐酸中c(Cl﹣)与醋酸溶液中c(CH3COO﹣)相等,则两溶液的pH相等 B、将amol•L﹣1的醋酸溶液与0.01mol•L﹣1的氢氧化钠溶液等体积混合,溶液中:c(Na+)═c(CH3COO﹣),则醋酸的电离常数Ka(用含a的代数式表示) C、向NH4Cl溶液中加入少量等物质的量浓度的稀盐酸,则的值减小 D、向Na[Al(OH)4]溶液中逐滴加入稀盐酸至沉淀恰好消失时:c(Cl﹣)═3c(Al3+)
-
18、鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl表示)。已知GHCl水溶液呈酸性,下列叙述正确的是( )A、0.001mol⋅L﹣1GHCl水溶液的pH=3 B、0.001mol⋅L﹣1GHCl水溶液加水稀释,pH升高 C、GHCl水溶液中:c(OH﹣)+c(Cl﹣)=c(H+)+c(GH+) D、GHCl在水中的电离方程式为:GHCl═G+HCl
-
19、下列措施不能促进水的电离的是( )A、升高温度 B、加入NaHSO4固体 C、加入金属钠 D、加入Na2CO3固体
-
20、下列方案能达到相应目的的是( )
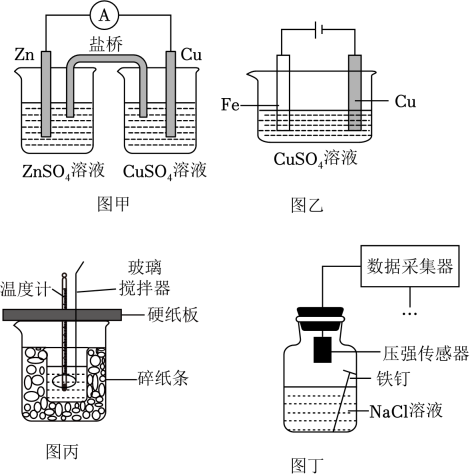 A、图甲,验证电能转化为化学能 B、图乙,可以在铁棒上镀铜 C、图丙,测定中和反应的反应热 D、图丁,用采集的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
A、图甲,验证电能转化为化学能 B、图乙,可以在铁棒上镀铜 C、图丙,测定中和反应的反应热 D、图丁,用采集的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀