相关试卷
-
1、利用如图所示装置模拟电解原理在工业生产上的应用,下列说法正确的是( )
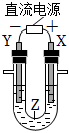 A、氯碱工业中,X电极上反应式是4OH﹣﹣4e﹣═2H2O+O2↑ B、电解精炼铜时,Z溶液中的Cu2+浓度不变 C、在铁片上镀铜时,Y是纯铜 D、制取金属镁时,Z是熔融的氯化镁
A、氯碱工业中,X电极上反应式是4OH﹣﹣4e﹣═2H2O+O2↑ B、电解精炼铜时,Z溶液中的Cu2+浓度不变 C、在铁片上镀铜时,Y是纯铜 D、制取金属镁时,Z是熔融的氯化镁 -
2、在一定条件下,将0.1mol A2、0.3mol B2充入到一个体积不变的10L密闭容器中,发生如下反应:A2(g)+3B2(g)⇌2AB3(g).不同温度下达到平衡时AB3的体积分数如图则下列有关推断正确的是( )
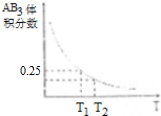 A、平衡常数:K(T1)<K(T2) B、反应焓变:△H>0 C、正反应速率:v(T1)<v(T2) D、T1时平衡浓度:c(AB3)=0.08 mol•L﹣1
A、平衡常数:K(T1)<K(T2) B、反应焓变:△H>0 C、正反应速率:v(T1)<v(T2) D、T1时平衡浓度:c(AB3)=0.08 mol•L﹣1 -
3、在容积一定的密闭容器中发生可逆反应X(g)+3Y(g)⇌nZ(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )
 A、a可能表示混合气体的密度 B、若n=3,p1>p2 , 则a可表示Y的质量分数 C、若n=3,p1>p2 , 则a可表示Y的转化率 D、a不可能表示混合气体的平均摩尔质量
A、a可能表示混合气体的密度 B、若n=3,p1>p2 , 则a可表示Y的质量分数 C、若n=3,p1>p2 , 则a可表示Y的转化率 D、a不可能表示混合气体的平均摩尔质量 -
4、已知:2H2(g)+O2(g)═2H2O(g)1molH2完全燃烧放出热量为241.8KJ有关键能数据如表:
化学键
H﹣O
O=O
键能/KJ▪mol﹣1
463.4
498
则H﹣H键键能为( )
A、413KJ/mol B、872KJ/mol C、221.6KJ/mol D、436KJ/mol -
5、依据图判断,下列说法不正确的是( )
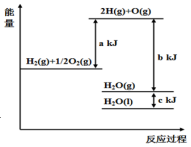 A、1molH2(g)与molO2(g)所具有的总能量比1molH2O(g)所具有的总能量高 B、H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 C、2molH(g)与1molO(g)生成1molH2O(g)所放出的热量是bkJ D、液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=2(b+c﹣a)kJ•mol﹣1
A、1molH2(g)与molO2(g)所具有的总能量比1molH2O(g)所具有的总能量高 B、H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 C、2molH(g)与1molO(g)生成1molH2O(g)所放出的热量是bkJ D、液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=2(b+c﹣a)kJ•mol﹣1 -
6、某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
Ni2+
Al3+
Fe3+
Fe2+
开始沉淀时的pH
沉淀完全时的pH
7.2
8.7
3.7
4.7
2.2
3.2
7.5
9.0
回答下列问题:
(1)、“碱浸”中NaOH的两个作用分别是和洗去油脂。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式。(2)、“滤液②”中含有的金属离子是Ni2+和。(3)、“转化”中可替代H2O2的物质是。若工艺流程改为先“调pH”后“转化”,即
“滤液③”中可能含有的杂质离子为。
(4)、硫酸镍溶液在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式。(5)、将分离出硫酸镍晶体后的母液收集、循环使用,其意义是。 -
7、可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是 , 还含有少量的、、)为原料生产的工艺流程如下:

25℃时,相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子
开始沉淀的pH
1.5
6.3
3.4
8.1
沉淀完全的pH
2.8
8.3
4.7
10.1
回答下列问题:
(1)、“酸浸、还原”时,软锰矿的成分中(填物质名称)没有发生反应。(2)、“酸浸、还原”后,溶液中含有的金属阳离子有、(填离子符号),铁屑、与反应的离子方程式为。(3)、“调节pH”时,加入溶液的目的是(用离子方程式表示)。(4)、“沉锰”时发生反应的离子方程式为。滤液2的用途是。 -
8、近期很多学校支原体肺炎频发,学校特地购买了“84消毒液”。包装说明如下,回答下列问题:
【产品名称】84消毒液
【有效成分】
【规格】
【物质的量浓度】
注:①按一定比例稀释后使用
②不得与酸性产品(如洁厕灵)同时使用
(1)、“84”消毒液可由与溶液反应制得,该反应的离子方程式为。(2)、一瓶该“84消毒液”中含有的有效成分NaClO为g。若用次氯酸钠固体配置一定物质的量浓度溶液的消毒液,下列操作正确的是。(填字母序号)a.
 b.
b. c.
c. (3)、欲将“84消毒液”原液稀释配制成的溶液。
(3)、欲将“84消毒液”原液稀释配制成的溶液。①配制过程中,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、。
②配制时,需要取用mL“84消毒液”原液。
③下列操作会使溶液中浓度偏高的是。(填字母序号)
a. 取用的“84消毒液”原液是久置的
b.定容操作时,俯视刻度线
c.量取“84消毒液”原液时,仰视读数
d.定容摇匀后,液面低于刻度线,再加水至刻度线
e.转移时没有洗涤烧杯和玻璃棒
(4)、利用如图装置探究84消毒液与洁厕灵(主要成分为盐酸)的反应。当注射器中的洁厕灵注入试管中时,装置内产生黄绿色气体,可观察到试纸的现象是。棉花团上蘸有的溶液A是(填写化学符号)溶液。
-
9、卤素是典型的非金属元素。为探究卤素中Cl、Br、I的性质,某同学依次设计了如下的实验。(1)、 某同学向无色的KI溶液中滴加少量氯水,发现无色溶液变为色,写出该反应的离子方程式。(2)、还需要再设计个类似于(1)的简单实验(填“1”、“2”或“3”,“4”),根据(1)、(2)所有的实验现象可以得到规律:氧化性Cl2>Br2>I2。(3)、根据(填写实验操作和现象或者化学性质),可以判断非金属性F>Cl。(4)、因此,非金属性F>Cl>Br>I。在元素周期表中,同主族元素从上到下,数不变,依次增多,逐渐增大,能力逐渐减弱。所以,非金属性逐渐减弱。
-
10、下列指定反应的离子方程式正确的是( )A、所有强酸强碱的中和反应:H++OH-=H2O B、向饱和苏打溶液中通入过量CO2:CO32-+CO2+H2O=2HCO3- C、利用覆铜板制作印刷电路板: D、漂白粉失效:Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓
-
11、将少量固体物质投入到下列溶液中,溶液的质量会增大的是(不考虑温度变化)( )A、氧化钠投入稀FeSO4溶液 B、过氧化钠投入稀NaCl溶液 C、钠投入饱和烧碱溶液 D、铁投入稀胆矾溶液
-
12、将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol/L稀盐酸。下列图象能正确表示加入盐酸的体积和生成的物质的量的关系的是( )A、
 B、
B、 C、
C、 D、
D、
-
13、实验室制备过程为:①高温下在熔融强碱性介质中用氧化制备;②水溶后冷却,调溶液至弱碱性,歧化生成和;③过滤,将滤液蒸发浓缩、冷却结晶,再过滤得。下列说法正确的是( )A、①中可以用氧化铝坩埚作反应器 B、①中用作强碱性介质 C、②中只体现氧化性 D、转化为的理论转化率约为66.7%
-
14、随着核电荷数的增大,下列关于碱金属元素的说法不正确的是( )A、原子半径增大 B、单质与水反应更剧烈,均产生氢气 C、单质与氧气反应更剧烈,且产物更复杂 D、单质密度均增大,熔沸点均降低
-
15、关于反应 , 下列说法正确的是( )A、发生还原反应 B、既是氧化剂又是还原剂 C、氧化、还原产物的物质的量之比为2∶1 D、发生反应,转移电子
-
16、对下列粒子组在溶液中能否大量共存的判断和分析均正确的是( )
粒子组
判断和分析
A
、、、
不能大量共存,因发生反应:
B
、、Cl-、
不能大量共存,H+和Cl-反应
C
、、、I-
不能大量共存,Fe3+和I-发生氧化还原反应
D
、、、
能大量共存,粒子间不反应
A、A B、B C、C D、D -
17、是重要的核工业原料,在自然界的丰度很低。的浓缩需要使用重水(D2O),一直为国际社会关注。下列有关说法正确的是( )A、原子核中含有92个中子 B、氘(D)原子核外有1个中子 C、1H与D互为同位素 D、H2O与D2O互称同素异形体
-
18、下列物质属于非电解质的是( )A、CO2 B、KI C、NaOH D、CH3COOH
-
19、室温下,下列各组离子一定能与指定溶液共存的是( )A、的溶液:、、、OH- B、的溶液:、、、 C、酸性溶液中:Na+、Ag+、Cl-、CO32- D、澄清溶液中:K+、、、MnO4-
-
20、设为阿伏加德罗常数的值。下列说法正确的是( )A、将0.2mL 5mol/L的氯化铁溶液滴入沸水中,所得胶体中约含有0.001NA个胶粒 B、的盐酸含有溶质分子总数为1NA C、标况下,28g混合气体(只含有CO和氮气)的分子数目为 D、与足量反应生成的分子数目为