相关试卷
-
1、将稀硫酸滴入锥形瓶中进行如图所示的探究实验(a-d均为浸有相应试液的棉花),下列分析不正确的是
 A、锥形瓶内的反应,只体现硫酸的酸性 B、a处棉花出现黄色,体现的还原性 C、b或c处褪色,均说明有漂白性 D、d处利用是酸性氧化物的性质
A、锥形瓶内的反应,只体现硫酸的酸性 B、a处棉花出现黄色,体现的还原性 C、b或c处褪色,均说明有漂白性 D、d处利用是酸性氧化物的性质 -
2、下列陈述Ⅰ和Ⅱ均正确,但不具有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
溶液的导电性比同浓度醋酸强
NaCl溶液的pH比醋酸的高
B
浓能吸收糖类化合物中的水分并使其炭化
浓硫酸具有脱水性
C
石油裂解气能使溴的溶液褪色
石油裂解可得到乙烯等不饱和烃
D
可用于腐蚀印刷电路板上的Cu
具有氧化性
A、A B、B C、C D、D -
3、七叶亭
 是一种植物抗菌素,适用于细菌性痢疾,下列说法中正确的是 A、该物质在常温下能与水以任意比例互溶 B、分子中所有碳原子可共平面 C、该物质可以发生取代反应、加成反应和消去反应 D、1mol该物质与足量NaOH溶液反应,最多可消耗3mol NaOH
是一种植物抗菌素,适用于细菌性痢疾,下列说法中正确的是 A、该物质在常温下能与水以任意比例互溶 B、分子中所有碳原子可共平面 C、该物质可以发生取代反应、加成反应和消去反应 D、1mol该物质与足量NaOH溶液反应,最多可消耗3mol NaOH -
4、某小组模拟工业制备 , 其原理是: , 其中不合理的是




A.制备氨气
B.观察氨气流速
C.制备
D.尾气处理
A、A B、B C、C D、D -
5、如图,某液态金属储能电池放电时产生金属化合物下列说法中正确的是
 A、放电时,电子从外电路进入M电极 B、放电时,由M电极向N电极移动 C、充电时,N电极反应为 D、可用LiCl和KCl水溶液代替熔融LiCl和KCl
A、放电时,电子从外电路进入M电极 B、放电时,由M电极向N电极移动 C、充电时,N电极反应为 D、可用LiCl和KCl水溶液代替熔融LiCl和KCl -
6、劳动开创未来,奋斗成就梦想。下列劳动项目与所涉及的化学知识没有关联的是
选项
劳动项目
化学知识
A
交警检查酒驾
检测仪中橙红色的与乙醇反应变为蓝绿色的
B
理发师给客人烫发
烫发药水能使头发中的二硫键(-S-S-)发生断裂和重组
C
园丁给树干涂石灰水
碱能使蛋白质变性
D
舞台师给舞台造“烟雾”缭绕
与水反应可生成碳酸
A、A B、B C、C D、D -
7、化学用语是学习化学的重要工具。下列化学用语表述不正确的是A、丙炔的键线式:≡ B、中子数为20的氯原子: C、的电子式为:
 D、用原子轨道描述氢原子形成氢分子的过程:
D、用原子轨道描述氢原子形成氢分子的过程:
-
8、化学是材料科学的基础。下列说法不正确的是A、制造5G芯片的氮化铝晶圆是复合材料 B、用作棉被的大豆蛋白纤维是一种可降解材料 C、航天员用的塑料面窗是有机高分子材料 D、科学家在嫦娥5号月壤中发现的玻璃纤维是无机非金属材料
-
9、含氮化合物在生产、生活中有着广泛的用途。回答下列问题:
已知:I.
Ⅱ.
Ⅲ.
(1)、若反应Ⅲ的逆反应活化能为 , 则正反应活化能为(用含的式子表示)。(2)、在恒容密闭容器中按投料比发生反应Ⅲ,不同催化剂条件下,反应相同时间时,测得转化率与温度的关系如图所示。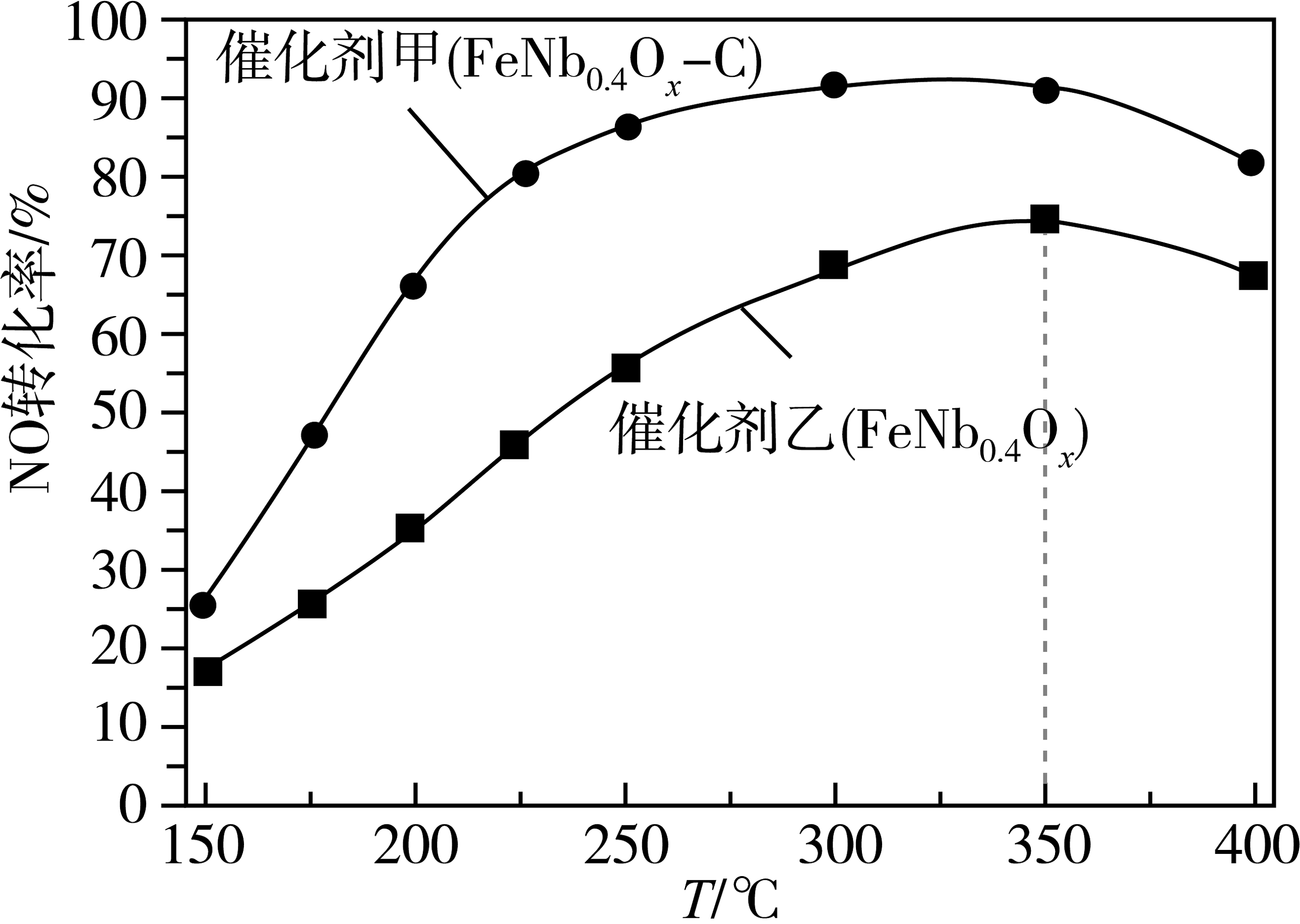
①下列能够说明反应Ⅲ在某种条件下已达到化学平衡状态的是(填标号)。
A.
B.混合气体的密度不再变化
C.200℃时,容器内气体总压强不再变化
D.混合气体的平均相对分子质量不再变化
②使用催化剂乙,温度高于350℃时,转化率降低,原因可能是。
③研究表明该反应速率 , 其中为速率常数,与温度、活化能有关。℃的初始速率为 , 当转化率为50%时,反应速率为 , 由此可知m=。
(3)、工业上常利用反应合成氨气,在、不同物质的量分数(75%的和25%的;67.5%的、22.5%的和10%的惰性气体)条件下进行实验,测得平衡时体积分数与温度的关系如图所示。
①物质的量分数为75%的和25%的所对应的曲线是(填“a”或“b”)。
②M点时,的转化率为。M点对应温度下,反应的压强平衡常数(用平衡分压代替平衡浓度,分压=总压×物质的量分数。保留两位有效数字)。
-
10、硒能增强人体免疫功能,抗氧化,延缓衰老,有效抑制肿瘤生长。实验室模拟工业上由含硒废料(主要含、、、、、等)制取硒的流程如下:

下列有关说法正确的是
A、“分离”前,将废料粉碎可以提高活化分子百分数,加快分离速率 B、“分离”、“酸溶”、“浸取”时都需要用到的玻璃仪器有:烧杯、玻璃棒、分液漏斗 C、“酸化”过程中发生的离子反应为 D、若向“酸溶”所得的滤液中滴入少量KSCN溶液,无明显现象 -
11、任何化学反应都伴随着能量的变化,通过化学反应化学能可转化为热能、电能等不同形式的能量。(1)、可用于工业合成氨气,已知常温常压下拆开键、键分别需要吸收的能量为436kJ、946kJ,形成键会放出391kJ能量。
①根据上述数据判断工业合成氨的反应是(填“吸热”或“放热”)反应。
②若消耗和 , 理论上放出或吸收热量为 , 则为kJ。
(2)、用图甲、乙所示装置进行实验,回答以下问题。
以下叙述中,正确的是___________。
A、甲中铜片是正极,乙中锌片是负极 B、两烧杯中溶液的pH均增大 C、两烧杯中铜片表面均有气泡产生 D、若反应过程中有0.2mol电子转移,生成的氢气在标况下的体积均为2.24L(3)、某同学利用生活或实验室中常用的物品,设计了一个原电池,如图所示。
实验原理:。
实验用品:电极(铁钉、铜钉)、稀硫酸、烧杯、导线、耳机(或电流表)。
①如果将装置中的耳机改为电流表,则铁钉应连接电流表的极,其电极反应式为;该电极上发生了(填“氧化”或“还原”)反应。
②反应结束后,测得铁钉质量减轻了2.8克,则转移电子的物质的量为。
-
12、高效净水剂聚合氯化铝铁(PAFC)的组成可表示为 , 该物质广泛应用于日常生活用水和工业废水的处理。回答下列问题:(1)、为检测PAFC中铝和铁元素的含量,采用如图所示流程进行。

①步骤中的A是。
②步骤中发生反应生成中溶液离子方程式为。
(2)、某工厂欲以工业废料(铁、铁和铝的氧化物)为原料制取PAFC,设计如下流程:
①铝元素在元素周期表的位置为 , 的电子式为。
②所得酸性溶液中,一定大量存在的离子有;可能存在的离子有 , 证明该离子确实存在,可采用的操作(必须指明所采用的试剂及观察到的现象)是。
③步骤中发生反应的离子方程式为。
-
13、
()为无色、有强烈刺激性气味的气体,是大气主要污染物之一、某学习小组的同学为了探究的某些性质,进行了如下实验,并检验能否与氯化钡反应生成沉淀。

(1)仪器a的名称是 , 装置A中生成的离子方程式为;加入碳酸钠粉末的目的是。
(2)装置B会观察到 , 证明有漂白性。实验时,C出现白色沉淀,请写出相应化学方程式:。
(3)结合实验目的,分析装置中采用澄清石灰水而不采用氢氧化钠溶液的原因:。
()氮肥厂的废水直接排放会造成环境污染。目前氨氮废水的处理方法主要有吹脱法、化学沉淀法、硝化反硝化生物法等。某氮肥厂的氨氮废水中氮元素多以和的形式存在,该厂技术团队设计的废水处理方案如下:

(4)检验某溶液中是否含有的方法是(写出所需试剂、操作及现象)。
(5)是工业合成硝酸的重要原料,写出实验室制取的化学方程式:。
-
14、干法氧化铁脱硫除去大气污染物的原理如图所示。下列说法不正确的是
 A、为该反应的催化剂 B、脱硫反应为 C、再生过程中,硫元素被还原 D、总反应为
A、为该反应的催化剂 B、脱硫反应为 C、再生过程中,硫元素被还原 D、总反应为 -
15、下列“实验结论或解释”与“实验操作及现象”相符的一组是
选项
实验操作及现象
实验结论或解释
A
向蔗糖中滴加浓硫酸,蔗糖变黑
浓硫酸有脱水性
B
向某溶液中加入HCl酸化的BaCl2溶液,有白色沉淀产生
该溶液中一定含有SO
C
向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的气体
该溶液中一定含CO
D
铜丝加入浓硫酸中,无明显变化
铜和浓硫酸不反应
A、A B、B C、C D、D -
16、为原子序数依次增大的短周期主族元素,元素的原子最外层电子数为内层电子数的3倍,元素与元素为同一主族,元素的最高价氧化物为两性氧化物,下列说法中错误的是A、元素对应的离子半径: B、元素的非金属性: C、W元素与第ⅠA族元素形成的化合物均为离子化合物 D、Y元素的单质与溶液能发生反应,可用作固体管道通剂
-
17、在如下图所示的装置中,a的金属活泼性比氢要强,b为碳棒,下列关于此装置的叙述不正确的是
 A、碳棒上有气体放出,溶液pH变大 B、a是正极,b是负极 C、导线中有电子流动,电子从a极到b极 D、a极上发生了氧化反应
A、碳棒上有气体放出,溶液pH变大 B、a是正极,b是负极 C、导线中有电子流动,电子从a极到b极 D、a极上发生了氧化反应 -
18、用硅的氧化物可以制取硅单质,主要步骤及化学反应如下:
①粗硅制取:。
②纯硅制取:、。
下列说法正确的是
A、步骤①的反应中,氧化剂与还原剂的物质的量之比为 B、步骤②涉及的反应中硅元素均被还原 C、可用石英坩埚灼烧熔融固体 D、Si、都能与氢氟酸、NaOH溶液反应 -
19、如图是氮元素的“价-类”二维图的一部分,下列说法错误的是
 A、从氮元素化合价角度考虑:a与b在一定条件下能反应生成 B、a具有还原性、能使湿润的红色石蕊试纸变蓝 C、常温下,e的浓溶液可以用铝罐车运输 D、在铜与e的稀溶液反应中,氧化剂与还原剂的物质的量比为
A、从氮元素化合价角度考虑:a与b在一定条件下能反应生成 B、a具有还原性、能使湿润的红色石蕊试纸变蓝 C、常温下,e的浓溶液可以用铝罐车运输 D、在铜与e的稀溶液反应中,氧化剂与还原剂的物质的量比为 -
20、若表示阿伏加德罗常数的值,下列说法正确的是A、标准状况下,含有的分子数为 B、32g Cu在足量硫蒸气中完全反应失去的电子数为 C、和含有的浓硫酸反应,生成的分子数目为 D、常温下,5.6g铁与硝酸反应,失去的电子数一定为