相关试卷
-
1、三溴化砷(AsBr3)常应用于医药和化学分析领域。下列说法正确的是A、该分子含非极性共价键 B、中心原子采取sp3杂化 C、键角等于120° D、空间结构为平面三角形
-
2、下列比较中一定正确的是A、能量:p能级>s能级 B、键能:C=C>2C−C C、热稳定性:H2S>H2O D、第一电离能:N>O
-
3、下列说法正确的是A、−OH的电子式:
 B、2p、3p、4p能级的轨道数依次增多
C、K+的电子排布式:1s22s22p63s23p6
D、一同学书写某原子的电子排布图为
B、2p、3p、4p能级的轨道数依次增多
C、K+的电子排布式:1s22s22p63s23p6
D、一同学书写某原子的电子排布图为 ,违背了泡利原理
,违背了泡利原理
-
4、关于反应 , 达到平衡后,下列说法不正确的是A、升高温度,氯水中的减小 B、氯水中加入少量醋酸钠固体,上述平衡正向移动,增大 C、取氯水稀释,增大 D、取两份氯水,分别滴加溶液和淀粉KI溶液,若前者有白色沉淀,后者溶液变蓝色,可以证明上述反应存在限度
-
5、
对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。
Ⅰ.现有以下物质:①H2O ②Cu ③BaCO3 ④Fe(OH)3胶体 ⑤酒精 ⑥CO2 ⑦稀硫酸
(1)以上物质中属于混合物的是(填序号,下同),属于电解质的是。
(2)向④中逐滴滴加⑦,可观察到的现象是。
Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是(填字母)。

(4)有同学认为所有酸碱中和反应均可表示为H++OH-=H2O。请举个例子反驳上述观点(用离子方程式表示)。
(5)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:4Ag+2H2S+O2=2X+2H2O。则X的化学式是。其中H2S在该反应中(填字母)。
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
-
6、下列分散系能产生丁达尔效应的是A、雾 B、氯化铁溶液 C、食盐水 D、75%酒精
-
7、下列叙述与图对应的是
 A、对于达到平衡状态的反应 , 图①表示在时刻充入了一定量 , 平衡逆向移动 B、由图②可知,、满足反应: C、图③表示的反应方程式为 D、对于反应 , 图④y轴可以表示Y的百分含量
A、对于达到平衡状态的反应 , 图①表示在时刻充入了一定量 , 平衡逆向移动 B、由图②可知,、满足反应: C、图③表示的反应方程式为 D、对于反应 , 图④y轴可以表示Y的百分含量 -
8、已知:氧化锂(Li2O)晶体形成过程中的能量变化如图所示。

下列说法正确的是
A、ΔH1>0,ΔH2<0 B、ΔH1+ΔH2+ΔH3+ΔH4+ΔH6-ΔH5=0 C、ΔH3<0,ΔH4<0 D、ΔH1+ΔH2+ΔH3+ΔH4=ΔH5+ΔH6 -
9、下列热化学方程式正确的是A、通常状况下,将1g氢气在氯气中完全燃烧,放出92.4kJ热量:H2(g)+Cl2(g)=HCl(g);ΔH=+92.4kJ·mol-1 B、已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出bkJ热量:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH= − 4b kJ·mol-1 C、1g炭与适量水蒸气反应生成一氧化碳和氢气,需吸收10.94kJ的热量:C+H2O=CO+H2ΔH= +10.94 kJ·mol-1 D、已知一定量甲烷完全燃烧生成二氧化碳和液态水放出的热量为55.625kJ∙g-1:CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-55.625 kJ·mol-1
-
10、下列说法正确的是A、肽键中的氧原子与氢原子之间存在氢键,会使肽链盘绕或折叠成特定的空间结构,形成蛋白质的二级结构 B、乙二醇能被过量的酸性氧化为乙二酸 C、可以通过X射线获得包括键长、键角、键能等分子结构信息 D、在酸催化下,苯酚与少量的甲醛反应,可以生成网状结构的酚醛树脂
-
11、探究铜及其化合物的性质,下列实验方案设计、现象和结论都正确的是
实验方案
现象
结论
A
铁片与铜片用导线相连,放入盛有浓硝酸的烧杯中
铜片不断溶解,而铁片表面无明显变化
该情况下,铜单质的还原性强于铁单质
B
向铜丝与浓硫酸反应后的溶液中加蒸馏水稀释
溶液变为蓝色
该反应的产物中有产生
C
在试管中加入2mL 10% NaOH溶液,再加入5滴5% 溶液,振荡后加入0.5mL乙醛溶液,加热
有砖红色沉淀产生
乙醛能将新制氢氧化铜悬浊液还原为
D
向10mL 0.1mol/L 溶液中滴入2mL 0.1mol/L 溶液,再加入2mL 0.1mol/L 溶液
开始有白色沉淀产生,后产生黑色沉淀
Ksp(CuS)<Ksp(ZnS)
A、A B、B C、C D、D -
12、某同学设计如图所示实验,探究反应中的能量变化。下列判断正确的是
 A、由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应 B、将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加 C、实验(c)中将玻璃搅拌器改为铁质搅拌器对实验结果没有影响 D、若用NaOH固体测定中和热,则测定中和热的数值偏高
A、由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应 B、将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加 C、实验(c)中将玻璃搅拌器改为铁质搅拌器对实验结果没有影响 D、若用NaOH固体测定中和热,则测定中和热的数值偏高 -
13、通过2NO(g)+2CO(g)2CO2(g)+N2(g) △H=-746.5kJ•mol-1催化还原的方法,可将汽车尾气中有害气体转化为无害气体。下列说法正确的是A、该反应在任何条件下都能自发进行 B、反应的平衡常数可表示为K= C、其它条件不变,增大的值,NO的转化率下降 D、使用高效的催化剂可以降低反应的焓变
-
14、
I.配制100mL0.05mol·L-1Fe2(SO4)3溶液。
(1)该实验需要用到的玻璃仪器有:烧杯、量筒、玻璃棒、、。
(2)为了防止Fe2(SO4)3水解,在配置过程中可以加入少量。
Ⅱ.探究Fe2(SO4)3与Cu的反应。
原理预测:
(3)请写出Fe2(SO4)3与Cu的反应的离子方程式:。
开展实验并观察现象:
某实验小组在进行Fe2(SO4)3与Cu的反应时观察到了异常现象,决定对其进行进一步的探究。
实验I:

提出问题:
(4)实验前,小组同学预测步骤2后溶液不会变为红色,原因是。
查阅文献:i.CuSCN为难溶于水的白色固体;
ii.SCN-被称为拟卤素离子,性质与卤素离子相似。
提出猜想:经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能。
猜测1:Cu2+与KSCN发生了氧化还原反应。
猜测2:亚铁离子将其还原 , 。
(5)猜测1的离子方程式为。
设计实验:
实验序号
对比实验及试剂
实验步骤
实验现象
Ⅱ
A试管
2 mL 0.1 mol/LFeSO4溶液
加入1mL0.4mol·L-1KSCN溶液
开始时溶液的上方变为红色,一段时间后红色向下蔓延,最后充满整支试管
B试管
2mL0.1mol/LCuSO4溶液
加入1mL0.4mol·L-1KSCN溶液
溶液变成绿色
Ⅲ
C试管
2mL0.1mol/LFeSO4溶液
加入2mL0.1mol·L-1CuSO4溶液
溶液变为淡蓝色
再加1mL0.4mol·L-1KSCN溶液
溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈深红色
得出结论:
(6)实验Ⅱ中试管(填字母)中的现象可以证实猜测1不成立。
(7)Fe3+的氧化性本应强于Cu2+ , 结合实验Ⅲ中的现象解释能正向发生的原因:。
-
15、和HBr在通常情况下发生加成反应主要得到2-溴丙烷,其机理如下:

已知:①电负性H>B ②-CN为吸电子基团。下列说法不正确的是
A、碳正离子中间体稳定性: B、与氢卤酸反应时速率大小HI>HBr>HCl C、与甲硼烷()加成最终能得到 D、乙炔可通过如下流程合成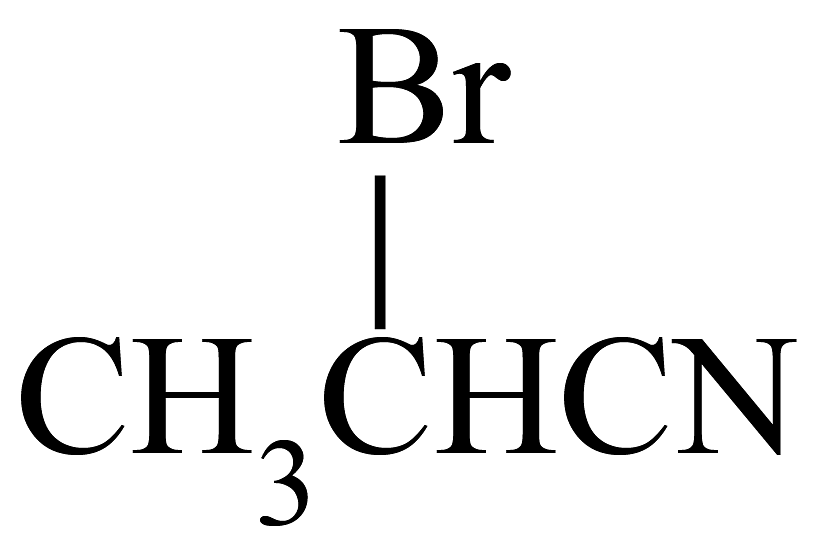 :
: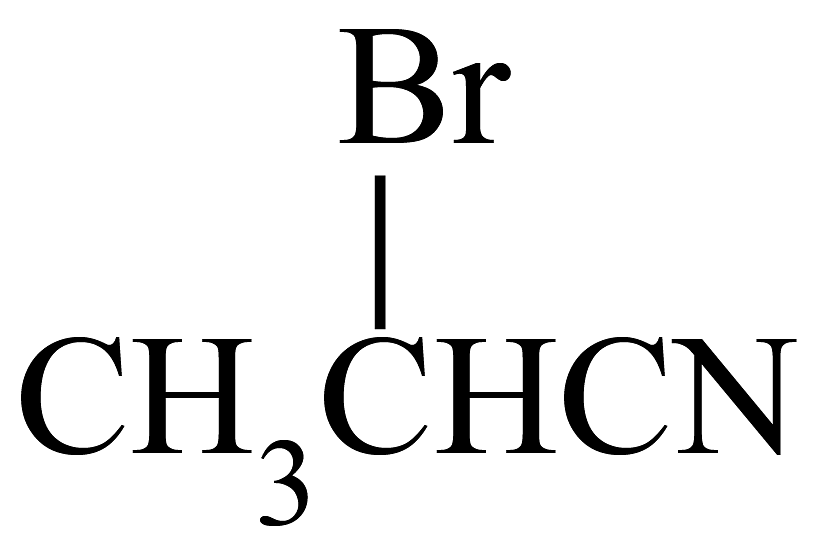
-
16、某兴趣小组为探究溶液的性质,需要的溶液。溶液的配制过程如图所示:
 (1)、配制过程中有一处明显错误为(填序号)。(2)、若用来配制溶液,需选择的玻璃仪器为量筒、玻璃棒、烧杯、。(3)、用托盘天平称取;若所取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度(填“偏大”、“偏小”或“无影响”)。(4)、若配制得到的溶液中混有部分 , 为确定其纯度,取适量溶液,向溶液中滴加稀盐酸(边滴边振荡,假设生成的气体完全逸出),记录生成二氧化碳的体积和消耗盐酸的体积并绘制图像如图,的体积为0-4阶段,发生反应的离子方程式为;的体积为4-9阶段,发生反应的离子方程式为;根据图计算可知,样品中纯碱和小苏打的物质的量之比为。
(1)、配制过程中有一处明显错误为(填序号)。(2)、若用来配制溶液,需选择的玻璃仪器为量筒、玻璃棒、烧杯、。(3)、用托盘天平称取;若所取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度(填“偏大”、“偏小”或“无影响”)。(4)、若配制得到的溶液中混有部分 , 为确定其纯度,取适量溶液,向溶液中滴加稀盐酸(边滴边振荡,假设生成的气体完全逸出),记录生成二氧化碳的体积和消耗盐酸的体积并绘制图像如图,的体积为0-4阶段,发生反应的离子方程式为;的体积为4-9阶段,发生反应的离子方程式为;根据图计算可知,样品中纯碱和小苏打的物质的量之比为。
-
17、将一小块钠投入如图所示的烧杯中,下列有关说法正确的是
 A、钠块只在煤油中游动,并放出气体 B、钠块只在水层游动,钠块熔化,水层变红色 C、在CCl4和水层交界处上下跳动,钠块熔化,水层变红 D、在水层和煤油层交界处上下跳动,钠块熔化,水层变红
A、钠块只在煤油中游动,并放出气体 B、钠块只在水层游动,钠块熔化,水层变红色 C、在CCl4和水层交界处上下跳动,钠块熔化,水层变红 D、在水层和煤油层交界处上下跳动,钠块熔化,水层变红 -
18、下列氧化还原反应中,电子转移的方向和数目均正确的是A、
 B、
B、 C、
C、 D、
D、
-
19、请按要求回答下列问题:(1)、乙醇的结构式;聚异戊二烯的结构简式。(2)、写出铜与浓硝酸反应的离子方程式。(3)、是一种(填“酸性”、“碱性”或“两性”)氧化物。实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞。请结合化学方程式解释其中原因:。
-
20、相同温度下,100mL0.1mol/L的氨水和10mL1mol/L的氨水相比较,下列数值中前者者小于后者的是A、中和时所需HCl的量 B、c(OH-) C、电离平衡常数Kb D、