相关试卷
-
1、下列离子方程式不正确的是A、铜与浓硫酸反应: B、二氧化硅与氢氧化钠溶液反应: C、铜和稀硝酸反应: D、氯化氨溶液与氢氧化钙溶液混合加热:
-
2、利用下列装置能达到实验目的的是
 A、利用甲装置除去氯气中混有的少量HCl B、利用乙装置稀释浓硫酸 C、利用丙装置进行喷泉实验 D、利用丁装置进行蒸发结晶
A、利用甲装置除去氯气中混有的少量HCl B、利用乙装置稀释浓硫酸 C、利用丙装置进行喷泉实验 D、利用丁装置进行蒸发结晶 -
3、化学与社会生产和生活密切相关。下列有关说法正确的是A、是有毒气体,不可在葡萄酒中微量添加 B、可以实现一步转化 C、针对新冠肺炎疫情,可用双氧水对场所进行杀菌消毒,过氧化氢分子只有极性共价键 D、重庆素有雾都之称,雾是一种气溶胶,光束透过大雾可观察到丁达尔效应
-
4、下列化学用语正确的是A、中子数为8的氧原子: B、离子的结构示意图
 C、氯化钠的电子式:
C、氯化钠的电子式: D、水分子的结构式:
D、水分子的结构式:
-
5、某研究小组按下列路线合成药物罗美昔布的中间体W。回答下列问题:

已知:R-NH2R-NH-R'

 (1)、化合物W的含氧官能团名称是。(2)、下列说法不正确的是________。A、A→B的反应试剂/条件是浓硝酸/加热 B、B→C的反应类型为取代反应 C、C→G的作用是定位氯原子的位置并保护氨基 D、
(1)、化合物W的含氧官能团名称是。(2)、下列说法不正确的是________。A、A→B的反应试剂/条件是浓硝酸/加热 B、B→C的反应类型为取代反应 C、C→G的作用是定位氯原子的位置并保护氨基 D、 中②号碳氯键与羰基共同作用,C的正电性更大,反应活性更强
(3)、化合物I的结构简式为。(4)、写出C→D的化学方程式。(5)、利用以上合成路线中的信息,设计以苯和ClCH2COCl为原料合成
中②号碳氯键与羰基共同作用,C的正电性更大,反应活性更强
(3)、化合物I的结构简式为。(4)、写出C→D的化学方程式。(5)、利用以上合成路线中的信息,设计以苯和ClCH2COCl为原料合成 的路线(用流程图表示,无机试剂任选)。 (6)、写出符合下列条件的D的同分异构体。
的路线(用流程图表示,无机试剂任选)。 (6)、写出符合下列条件的D的同分异构体。①分子中含有苯环且与F原子直接相连;
②1H-NMR谱和IR谱检测表明:分子中共有4种不同化学环境的氢原子,有
 。
。 -
6、某小组设计制备补铁剂甘氨酸亚铁的实验步骤和装置图(夹持装置省略)如图:

合成反应为:2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O。
有关物质性质如表所示:
甘氨酸
柠檬酸
甘氨酸亚铁
易溶于水,微溶于乙醇
易溶于水和乙醇
易溶于水,微溶于乙醇
具有两性
酸性和还原性
常温不易,氧化变质
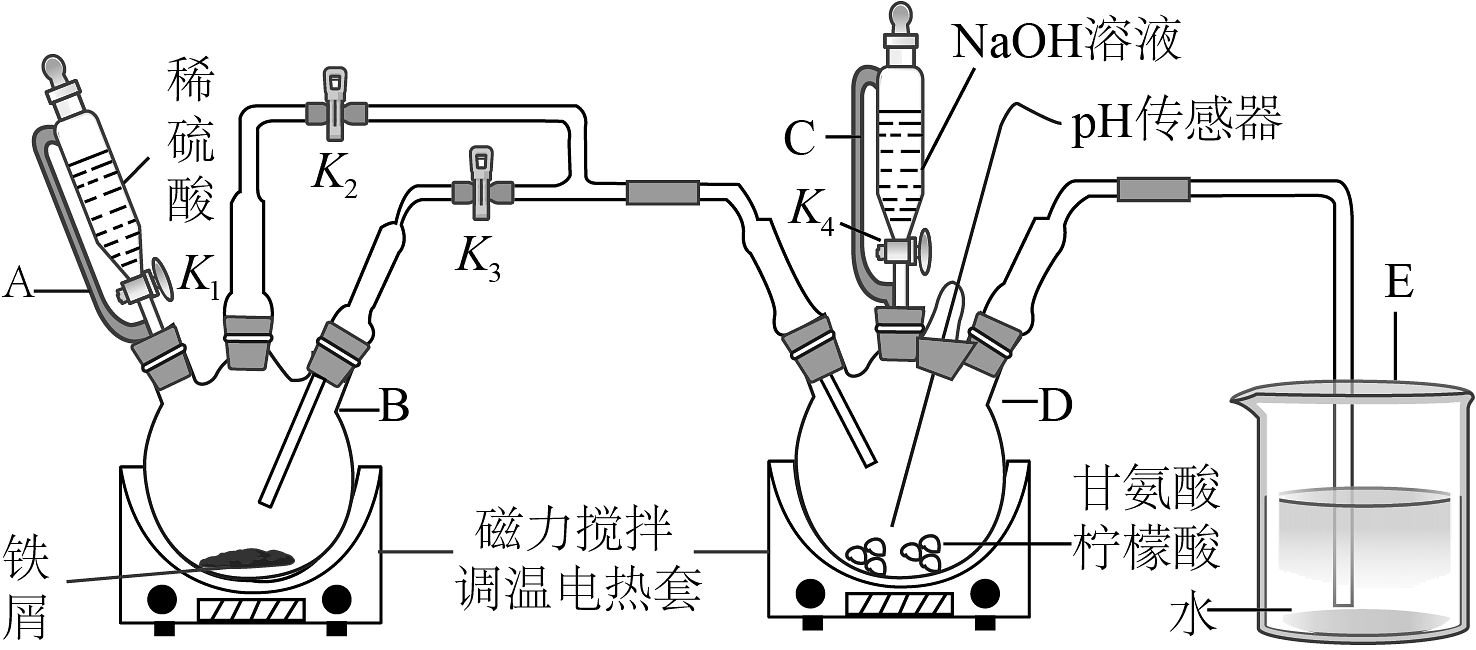
回答下列问题:
(1)、步骤I制备FeSO4 , 先打开K1、K2 , 关闭K3 , 充分反应后(仍有气泡),将B中溶液转移到D中的操作是。(2)、步骤I、II中,为了防止Fe2+被氧化,采取的措施有、(填2种)。(3)、步骤II,D中反应液pH过高或过低均会导致产率降低,原因是。(4)、下列说法不正确的是________。A、步骤I、II使用滴液漏斗A或C滴入液体时,无需取下上口玻璃塞 B、步骤III加入乙醇的作用是降低甘氨酸亚铁的溶解度,促使其结晶析出 C、步骤III过滤后洗涤,往漏斗中加水浸没沉淀,小心搅拌以加快过滤 D、步骤IV重结晶,将粗产品溶解于适量水中,蒸发浓缩至出现大量晶体,趁热过滤(5)、步骤V,检测产品中铁元素的含量,需要用到如图电子天平,以差量法准确称量样品。操作的正确排序为:电子天平开机预热→A→B→______→______→______→______→F。
A.调水平(使水平仪气泡归中)
B.利用标准码进行校准
C.往称量瓶中加入一定量样品,放回秤盘
D.将称量瓶置于秤盘中间,待示数不变时,按TAR键去皮
E.从称量瓶中倒出一定量样品,放回秤盘
F.关闭侧门,待示数不变时读数记录
-
7、甲烷的直接转化具有较高的经济价值,因此备受科学家关注。回答下列问题:(1)、用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:
I.CH4(g)+O2(g)CH3OH(g) △H1=-126.4kJ•mol-1
II.CH4(g)+H2O(g)CH3OH(g)+H2(g) △H2
已知:H2的标准燃烧热为285.8kJ/mol;H2O(l)=H2O(g) △H=+44kJ•mol-1。计算△H2=kJ/mol。
(2)、若采用方法I生产甲醇。在200℃下,向恒容为5L的密闭反应器中加入催化剂,并充入6.0kPaCH4、4.8kPaO2和一定量He使反应充分进行,体系的总压强随时间的变化如图所示。
①下列措施可提高CH4的平衡转化率的是(填标号)。
A.升高温度 B.初始总压强不变,提高CH4的分压
C.投料比不变,增大反应物浓度 D.反应达到平衡后,再充入一定量He
②在200℃下,方法I的标准压力平衡常数K=(可保留)。
已知:2A(g)B(g)的标准平衡常数K= , 其中pθ为标准压强(100kPa),p(A)和p(B)为平衡分压(某成分的物质的量分数×总压)。
③若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率将(填:变大、变小或不变)。
(3)、为提高生产效率,利用方法II进行连续生产时采用如图所示的步骤控制体系温度和通入气体(各阶段气体流速相同)。已知大多数气体分子在催化剂表面的吸附过程是放热的,He不会在催化剂表面吸附,吸附和解吸不会导致体系温度的变化。
①通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是。
②从反应速率的角度分析,通入CH4后维持200℃的原因(不考虑催化剂失活)。
-
8、氯化亚砜(
 )常用作脱水剂和氯化剂。如图流程表示其制备及用途,回答下列问题:
)常用作脱水剂和氯化剂。如图流程表示其制备及用途,回答下列问题: (1)、用硫磺、氯气和三氧化硫为原料,在一定条件下可合成SOCl2 , 原子利用率达100%。写出该反应方程式。(2)、下列有关说法不正确的是________。A、SO3是极性分子,容易与H2O发生反应 B、途径①能制得无水FeCl3是因为SOCl2吸水性强且产物HCl能抑制Fe3+水解 C、FeCl3在溶液中分步水解,第一步反应为:Fe3++H2OFe(OH)2++H+ D、CH3COCl能与NH3反应生成乙酰胺(3)、途径②除了CH3COCl外还产生两种酸性气体,写出该反应方程式。(4)、SOCl2极易水解,试从共价键的极性角度分析其原因。(5)、途径①可能发生氧化还原反应而生成副产物,设计实验分别检验氧化产物和还原产物的存在。
(1)、用硫磺、氯气和三氧化硫为原料,在一定条件下可合成SOCl2 , 原子利用率达100%。写出该反应方程式。(2)、下列有关说法不正确的是________。A、SO3是极性分子,容易与H2O发生反应 B、途径①能制得无水FeCl3是因为SOCl2吸水性强且产物HCl能抑制Fe3+水解 C、FeCl3在溶液中分步水解,第一步反应为:Fe3++H2OFe(OH)2++H+ D、CH3COCl能与NH3反应生成乙酰胺(3)、途径②除了CH3COCl外还产生两种酸性气体,写出该反应方程式。(4)、SOCl2极易水解,试从共价键的极性角度分析其原因。(5)、途径①可能发生氧化还原反应而生成副产物,设计实验分别检验氧化产物和还原产物的存在。 -
9、硼及其化合物在工农业生产、新型材料等方面应用广泛,回答下列问题:(1)、基态硼原子的价层电子排布式是。(2)、下列说法不正确的是________。A、根据对角线规则,B元素的一些化学性质与Si元素相似 B、第一电离能(I1):I1(Be)<I1(B)<I1(C) C、BF3的空间结构为平面三角形 D、晶体硼的熔点为2300℃,推测其为共价晶体(3)、储氢材料氨硼烷水解释放氢气:3NH3BH3+6H2O3NH+
 +9H2↑。反应中硼原子的杂化轨道类型由变为。 (4)、AlF3的熔点(1040℃)远高于BF3的熔点(-127℃),从晶体类型及微粒间作用力角度分析其原因。(5)、硼化镁是一种离子晶体,属于六方晶系(如图1),a=b≠c, α=90°,β=120°,镁层和硼层交替排列,硼原子层形成平面六元并环结构。硼化镁晶体沿z轴方向的投影如图2所示。
+9H2↑。反应中硼原子的杂化轨道类型由变为。 (4)、AlF3的熔点(1040℃)远高于BF3的熔点(-127℃),从晶体类型及微粒间作用力角度分析其原因。(5)、硼化镁是一种离子晶体,属于六方晶系(如图1),a=b≠c, α=90°,β=120°,镁层和硼层交替排列,硼原子层形成平面六元并环结构。硼化镁晶体沿z轴方向的投影如图2所示。
①硼化镁的化学式为。
②B的配位数(紧邻的镁原子数)是。
-
10、下列实验操作对应的现象和根据现象得出的结论不正确的是
选项
实验操作
现象
结论
A
向2mL0.1mol/LFeI2溶液中依次滴加少量氯水和CCl4 , 振荡,静置
溶液分层,下层呈紫红色
还原性:Fe2+<I-
B
往NaAlO2溶液中滴加NaHCO3溶液
产生白色沉淀
结合H+的能力:AlO>CO
C
用pH计测定0.1mol/LNaHCO3溶液和0.1mol/LCH3COONa溶液的pH
NaHCO3(aq)为8.3,CH3COONa(aq)为8.9
水解常数:Kh(HCO)<Kh(CH3COO-)
D
甲、乙试管均盛有2mL等浓度银氨溶液,分别加入2滴等浓度的NaCl溶液和NaI溶液
甲中无明显现象,乙中产生黄色沉淀
溶度积常数:Ksp(AgI)<Ksp(AgCl)
A、A B、B C、C D、D -
11、某温度下,用0.1000mol/L硝酸银标准溶液对25mL含KX和KY的混合溶液进行电位滴定(Y-与H+的反应可以忽略),获得电动势(E)和硝酸银标准溶液体积(V)的电位滴定曲线如图所示。
已知:Ag++2Y-=[AgY2]- , [AgY2]-+Ag+=2AgY↓。该温度下,Ksp(AgY)=2×10-16 , Ksp(AgX)=2×10-10。下列说法不正确的是
 A、B→C主要发生了反应:Ag++X-=AgX↓ B、若HY为弱酸,则从0→A点,水的电离程度不断减小 C、原混合溶液中c(KX)=0.03000mol/L D、AgX(s)+Y-(aq)AgY(s)+X-(aq)的平衡常数为10-6
A、B→C主要发生了反应:Ag++X-=AgX↓ B、若HY为弱酸,则从0→A点,水的电离程度不断减小 C、原混合溶液中c(KX)=0.03000mol/L D、AgX(s)+Y-(aq)AgY(s)+X-(aq)的平衡常数为10-6 -
12、某溶液初始仅溶有等浓度的M和N,反应①、②同时进行:
①M+NX+W
②M+NY+W
反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中M和X的浓度随时间变化如图所示。下列说法正确的是
 A、0~30min,消耗M的平均速率为0.01mol•L-1•min-1 B、体系中X和Y的浓度之比保持不变,说明反应已平衡 C、反应①的活化能比反应②的活化能更大 D、充分反应后,X的选择性[×100%]为62.5%
A、0~30min,消耗M的平均速率为0.01mol•L-1•min-1 B、体系中X和Y的浓度之比保持不变,说明反应已平衡 C、反应①的活化能比反应②的活化能更大 D、充分反应后,X的选择性[×100%]为62.5% -
13、某无隔膜流动海水电解法制H2的装置如图所示,其中高选择性催化剂PRT可抑制O2在电极表面产生,提高放电效率。下列说法不正确的是
 A、钛箔作阴极,发生还原反应 B、阳极反应主要为:Cl--2e-+H2O=HClO+H+ C、电解后海水pH明显下降 D、理论上生成1molH2转移电子数为2NA
A、钛箔作阴极,发生还原反应 B、阳极反应主要为:Cl--2e-+H2O=HClO+H+ C、电解后海水pH明显下降 D、理论上生成1molH2转移电子数为2NA -
14、通过下列实验可从I2的CCl4溶液中回收I2。下列说法不正确的是

 A、I2/CCl4溶液可以用乙酸乙酯萃取分离其中的碘 B、操作①为分液,需要使用分液漏斗 C、步骤②发生的反应为:IO+5I-+6H+=3I2↓+3H2O D、操作③为升华法(如图),可除去粗碘快速结晶时混入的杂质
A、I2/CCl4溶液可以用乙酸乙酯萃取分离其中的碘 B、操作①为分液,需要使用分液漏斗 C、步骤②发生的反应为:IO+5I-+6H+=3I2↓+3H2O D、操作③为升华法(如图),可除去粗碘快速结晶时混入的杂质 -
15、α-氰基丙烯酸异丁酯可用作医用胶,其结构简式如图。下列有关其说法不正确的是
 A、分子中碳原子的杂化方式有3种 B、其同分异构体不可能是芳香族化合物 C、能发生加成聚合反应 D、在“H2O,H+/加热”条件下反应可生成二元羧酸
A、分子中碳原子的杂化方式有3种 B、其同分异构体不可能是芳香族化合物 C、能发生加成聚合反应 D、在“H2O,H+/加热”条件下反应可生成二元羧酸 -
16、下列反应的离子方程式不正确的是A、向硫酸铜溶液中滴加过量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2NH B、氢氧化铁沉淀溶于氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O C、用硫化亚铁除去废水中的汞离子:FeS(s)+Hg2+(aq)=Fe2+(aq)+HgS(s) D、向硫化钠溶液中滴加次氯酸钠溶液:S2-+ClO-+H2O=S↓+Cl-+2OH-
-
17、下列说法正确的是A、蛋白质、淀粉、纤维素和油脂等高分子均能发生水解 B、通过煤的液化可获得液态烃等有机化合物,煤的液化过程为物理变化 C、氨基酸既能与HCl反应,也能NaOH反应,产物均为盐和水 D、天然橡胶硫化后由线型结构转变为网状结构
-
18、设NA为阿伏加德罗常数的值,下列说法正确的是A、向1L1mol/LNH4Cl溶液中加氨水至中性,此时溶液含NH数目为NA B、1molAlCl3完全水解生成的Al(OH)3胶体粒子数目为NA C、4.2gC3H6中含有σ键的数目为0.8NA D、标准状况下5.6LCH4与5.6LCl2混合后光照,充分反应后生成CH3Cl的数目为0.25NA
-
19、汽车发生碰撞时,安全气囊中发生反应:10NaN3+2KNO3=5Na2O+K2O+16N2↑。下列判断不正确的是A、该反应能在瞬间完成,并产生大量气体 B、生成标准状况下2.24 L气体,该反应转移电子的数目为0.5NA C、N2既是氧化产物又是还原产物 D、被氧化和被还原的N原子的物质的量之比为15:1
-
20、完成下述实验,装置或试剂不正确的是




A.实验室制氯气
B.验证氨气易溶于水且溶液呈碱性
C.溶液的转移
D.实验室制乙炔除去H2S杂质
A、A B、B C、C D、D