相关试卷
-
1、向绝热恒容密闭容器中通入CO(g) 和H2O(g), 在一定条件下发生反应: ,该反应的正反应速率随着时间变化的示意图如图所示。下列说法正确的是
 A、d点: v(正)>v(逆) B、该反应的△H >0 C、c点时CO的转化率最大 D、a、b、 c、d四点对应的压强: c>d>b>a
A、d点: v(正)>v(逆) B、该反应的△H >0 C、c点时CO的转化率最大 D、a、b、 c、d四点对应的压强: c>d>b>a -
2、下列装置不能达到对应实验目的的是


 A、探究浓度对化学平衡的影响[Fe3+(浅黄色)+3SCN- (无色)Fe(SCN)3(红色)] B、探究温度对碳酸氢钠和碳酸钠分解速率的影响 C、探究温度对化学平衡的影响[2NO2(g)(红棕色)N2O4(g)(无色)] D、探究压强对化学平衡的影响[2NO2(g)(红棕色)N2O4(g)(无色)]
A、探究浓度对化学平衡的影响[Fe3+(浅黄色)+3SCN- (无色)Fe(SCN)3(红色)] B、探究温度对碳酸氢钠和碳酸钠分解速率的影响 C、探究温度对化学平衡的影响[2NO2(g)(红棕色)N2O4(g)(无色)] D、探究压强对化学平衡的影响[2NO2(g)(红棕色)N2O4(g)(无色)] -
3、已知H2与ICl的反应分两步完成:H2(g)+ICl(g)HCl(g)+HI(g) △H1<0, △H2<0,且△H1>△H2 下列图像最符合上述反应历程的是A、
 B、
B、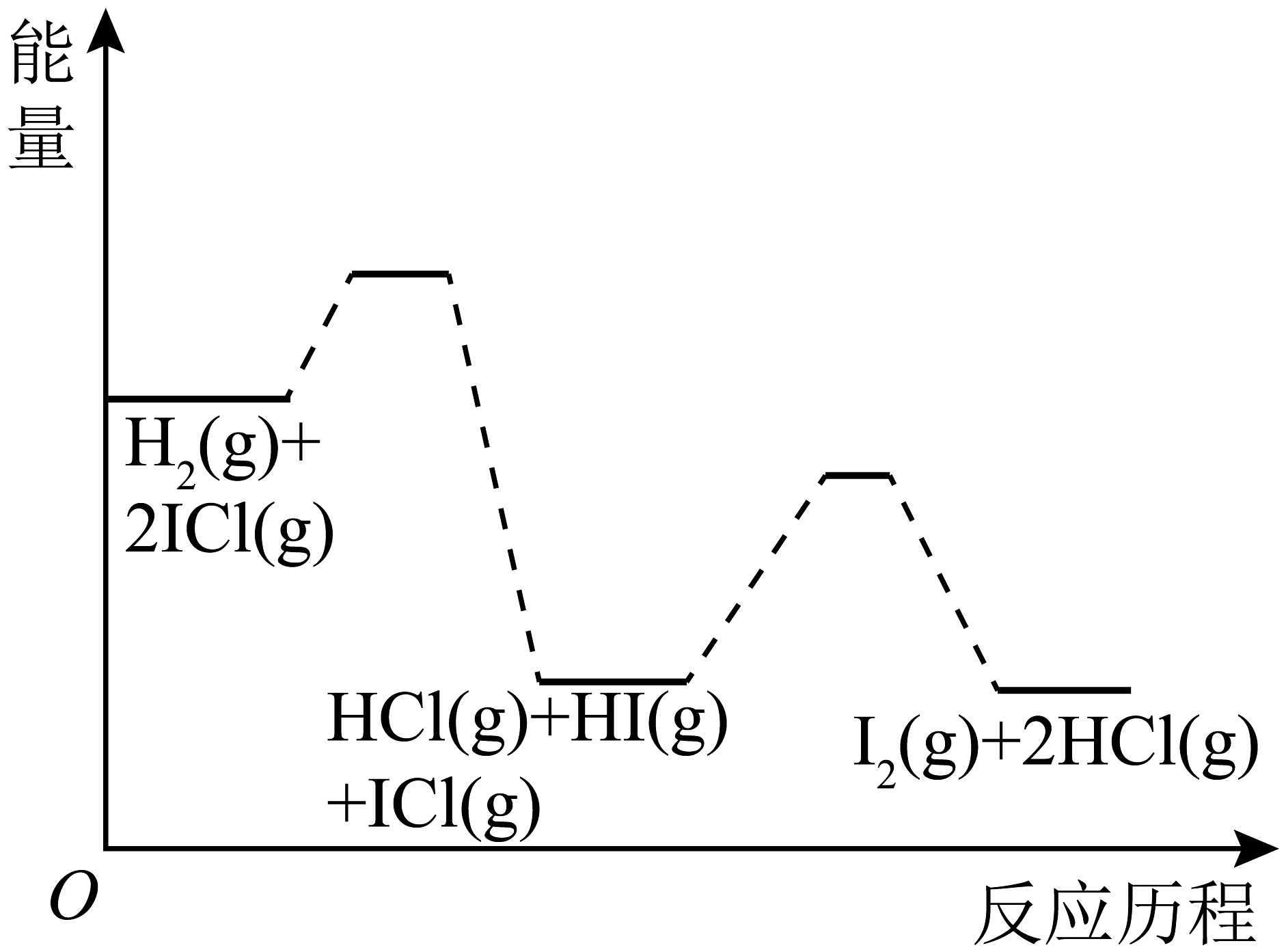 C、
C、 D、
D、
-
4、在SO2的饱和溶液中H2SO3达到电离平衡的标志是A、 B、溶液中无H2SO3分子 C、c(HSO3)不再变化 D、溶液中 共存
-
5、下列措施能增大氨水中NH3·H2O 电离程度的是A、加入NH4Cl固体 B、通入一定量的NH3 C、加入少量冰醋酸 D、加入少量NaOH固体
-
6、在一定温度下的恒容密闭容器中发生可逆反应: , 已知NH3(g)、O2(g)、NO(g)、H2O(g)的初始浓度分别为 当反应达到平衡时,各物质的浓度不可能为A、 B、 C、 D、
-
7、下列事实不能用平衡移动原理解释的是A、反应 达到化学平衡后,升高温度,体系的颜色变浅 B、新制氯水应放在阴暗低温处保存 C、合成氨的过程中及时分离出氨气 D、反应 达到化学平衡后,减小容器体积,体系的颜色加深
-
8、下列说法正确的是A、自发进行的反应均是熵增反应 B、蔗糖在水中溶解是一个自发过程 C、NaHCO3受热分解过程:△S<0 D、吸热反应一定不能自发进行
-
9、下列热化学方程式的反应热表示燃烧热的是A、 B、 C、 D、
-
10、如下图所示,下列有关化学反应能量变化的说法错误的是
 A、铁与盐酸反应的能量变化可用图1表示 B、图1 表示反应物的总键能小于生成物的总键能 C、图1、图2中化学反应的焓变 D、图2可以表示反应 的能量变化
A、铁与盐酸反应的能量变化可用图1表示 B、图1 表示反应物的总键能小于生成物的总键能 C、图1、图2中化学反应的焓变 D、图2可以表示反应 的能量变化 -
11、下列说法正确的是A、化学反应总是伴随着能量的变化 B、所有化学反应的反应热均可通过量热计直接测定 C、物质的内能与温度和压强无关 D、所有的分解反应都是吸热反应
-
12、下列仪器在中和热测定实验中不会用到的是A、温度计 B、玻璃搅拌器 C、秒表 D、量筒
-
13、在2 L恒容密闭容器中充入4 mol CO和4 mNO,发生反应2NO(g)+2CO(g)N2(g)+2CO2(g),平衡时,NO的体积分数与温度(℃)、压强(Pa)的关系如图所示。
 (1)、求C点NO的平衡转化率。(2)、若C点在10min达到平衡,求10min内CO的平均反应速率。(3)、若起始容器内压强为pPa,求C点时该反应的平衡常数Kp(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
(1)、求C点NO的平衡转化率。(2)、若C点在10min达到平衡,求10min内CO的平均反应速率。(3)、若起始容器内压强为pPa,求C点时该反应的平衡常数Kp(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。 -
14、
CO2的资源化对于构建低碳社会具有重要意义。回答下列问题:
I.利用CO2催化加氢合成二甲醚
主要发生下列反应:
反应ⅰ:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH1=+41.2 kJ·mol-1
反应ⅱ:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH2
(1)已知反应:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) ΔH3=-204.9 kJ·mol-1。则ΔH2=kJ·mol-1。Ⅱ.利用CO2制备CH3OH
(2)一定条件下,在容积为2 L的恒容密闭容器中充入1.5 mol CO2和3 mol H2发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),下图是反应体系中CO2的平衡转化率与温度的关系曲线。已知在温度为500 K的条件下,反应10 min后达到平衡。
①下列现象能说明反应达到平衡状态的是(填标号)。
a.单位时间内消耗n mol H2的同时消耗 n mol H2O
b.体系中CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度相等
c.混合气体的平均摩尔质量不变
d.体系中混合气体密度不变
②该反应是(填“吸热”或“放热”)反应。500 K时,在0~10 min内平均反应速率v(H2)为。
③500 K下达到平衡时体系的总压强为p,该反应的平衡常数Kp=。(Kp为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)
Ⅲ.高温电解CO2和H2O制备清洁燃料
(3)该技术的原理如图所示。电极a上的电极反应式是H2O+2e-=H2↑+O2-和。
-
15、回答下列问题:(1)、甲装置发生的化学反应方程式为。阴极收集到标况下2.24L气体时,阳极溶液质量减轻g。
 (2)、乙装置是一种家用环保型消毒液发生器,外接电源b为(填“正”或“负”)极,外接电源a连接的石墨电极的电极反应式为。
(2)、乙装置是一种家用环保型消毒液发生器,外接电源b为(填“正”或“负”)极,外接电源a连接的石墨电极的电极反应式为。 (3)、一氧化氮-空气质子交换膜燃料电池将化学能转化为电能。如图所示,某同学设计用该电池探究将雾霾中的SO2、NO转化为(NH4)2SO4的原理和电镀的原理。
(3)、一氧化氮-空气质子交换膜燃料电池将化学能转化为电能。如图所示,某同学设计用该电池探究将雾霾中的SO2、NO转化为(NH4)2SO4的原理和电镀的原理。
①燃料电池放电过程中负极的电极反应式。
②乙装置中物质A是(填化学式),若在标准状况下,甲装置有5.6L O2参加反应,则乙装置中通入的物质A的物质的量为mol。
③丙装置为铜表面镀银装置,电极D为 ,电镀一段时间后,溶液中AgNO3溶液浓度(填“变大”、“变小”或“不变”)。
(4)、“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。飞船在光照区运行时,太阳能电池帆板将太阳能转化为电能(工作原理图1),除供给飞船使用外,多余部分用镉镍蓄电池储存起来。当飞船运行到阴影区时,镉镍蓄电池开始为飞船供电,镉镍蓄电池工作原理为Cd+2NiO(OH)+2H2OCd(OH)2 +2Ni(OH)2。
飞船在光照区运行时,N极链接镉镍蓄电池极(填“m”或“n”)。飞船运行到阴影区时,b室中发生的电极反应反应式为 。
-
16、某工业矿渣废料的主要成分为、和 , 还含有少量和。利用该矿渣废料制备高纯和回收含铁化合物的工业流程如图:

已知:i.当微粒浓度低于时,认为溶液中不存在该微粒;
ii.常温下;部分难溶物的溶度积常数如表:
难溶物
回答下列问题:
(1)、“滤渣Ⅱ”的主要成分为(填化学式)。(2)、“还原”过程中发生的主要氧化还原反应的离子方程式为、。(3)、“氧化”时需要少量、多次加入 , 其目的是。(4)、“调”时可选择的试剂为___________(填字母)。A、 B、 C、 D、(5)、常温下,若“调”后所得溶液中、 , 则所调的范围为。(6)、“沉锰”时发生反应的离子方程式为。(7)、若使用100 kg含87% MnO2的矿渣废料,最终获得101.2 kg MnCO3 , 则MnCO3产率为。 -
17、我国科学家实现了在铜催化条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法错误的是
 A、由图可以判断DMF转化为三甲胺的反应属于放热反应 B、是该反应历程的决速步骤 C、使用铜作催化剂可以降低反应的活化能,从而加快反应速率 D、该历程中最大能垒(活化能)
A、由图可以判断DMF转化为三甲胺的反应属于放热反应 B、是该反应历程的决速步骤 C、使用铜作催化剂可以降低反应的活化能,从而加快反应速率 D、该历程中最大能垒(活化能) -
18、一定温度下,在2L的恒容密闭容器中发生反应A(g)+2B(g)3C(g)。反应过程中的部分数据如下表所示:
t/min
n(A)/mol
n(B)/mol
n(C)/mol
0
2.0
2.4
0
5
0.9
10
1.6
15
1.6
下列说法正确的是
A、该反应在10min后才达到平衡 B、平衡状态时,c(C)=0.6mol·L-1 C、物质B的平衡转化率为20% D、该温度下的平衡常数为 -
19、在下列合成氨的事实中,不能用平衡移动原理来解释的是
①使用铁催化剂有利于合成氨反应
②在500℃左右高温下反应比常温下更有利于合成氨
③增大体系的压强,可以提高混合物中氨的百分含量
④在合成氨生产中,要不断分离出液态氨气
A、①③ B、②④ C、①② D、③④ -
20、某校化学兴趣小组利用如图装置在实验室制备“84”消毒液,下列说法正确的是
 A、装置Ⅰ中的KMnO4 可以替换成MnO2 B、装置Ⅱ可以除去Cl2中HCl 杂质,还可以防止倒吸 C、装置Ⅲ中消耗5.6 LCl2 , 转移0.5 mol电子 D、装置Ⅳ的作用是吸收空气中的CO2和水蒸气
A、装置Ⅰ中的KMnO4 可以替换成MnO2 B、装置Ⅱ可以除去Cl2中HCl 杂质,还可以防止倒吸 C、装置Ⅲ中消耗5.6 LCl2 , 转移0.5 mol电子 D、装置Ⅳ的作用是吸收空气中的CO2和水蒸气