相关试卷
-
1、下列哪个危险警告标签应该贴在盛的试剂瓶上A、
 B、
B、 C、
C、 D、
D、
-
2、下列物质中,属于纯净物的是A、氯水 B、漂白粉 C、蔗糖溶液 D、纯碱
-
3、
Ⅰ.水煤气变换反应为 。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面水煤气变换的反应历程,如图所示,其中吸附在金催化剂

(1)在金催化剂表面的吸附为过程(吸热或放热),该反应中的决速步骤的方程式是。
Ⅱ.“低碳循环”已经引起了各国的高度重视,“低碳经济”正成为科学家们研究的重要课题。以为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。
(2)和在一定条件下可转化为甲烷,转化过程中发生的反应如下:
反应Ⅰ(主反应):
反应Ⅱ(副反应):
甲烷与二氧化碳制备合成气的反应为 , 该反应的。
(3)科学家通过如下反应合成甲醇: 。
①原料气可通过捕获技术从空气或工业尾气中获取,下列物质能作为捕获剂的是(填标号)。
A.溶液 B.NaOH溶液 C.溶液 D.溶液
②科学研究中常用产物的时空收率(单位物质的量催化剂表面产物分子的平均生成速率)来衡量催化效果。在3MPa、时,不同Ni、Ga配比的催化剂下,测定甲醇时空收率随温度的变化曲线如图所示,催化剂的最佳配比和反应温度是;甲醇时空收率在后随温度增大而减小的原因是。

③某温度下,向容积恒为1L的密闭容器中通入)和 , 10min后体系达到平衡,此时的转化率为20%。用表示0~10min内平均反应速率。
④下列有关说法中,正确的是(填标号)。
A.增大浓度有利于提高的转化率
B.其他条件相同,升高温度,可以提高的平衡转化率
C.其他条件相同,增大压强(减小容器的容积),正反应速率增大,逆反应速率减小
D.混合气体的平均相对分子质量不变,说明反应达平衡状态。
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的CO和水蒸气进入一个体积一定的密闭反应器时,会发生如下反应: , 该反应的平衡常数随温度的变化如下表所示:
温度/℃
400
500
800
平衡常数K
9.94
9
1
该反应的正反应方向是反应(填“吸热”或“放热”);若在时进行,设起始时CO和的浓度均为 , 则该条件下CO的平衡转化率为。
-
4、
Ⅰ.研究小组利用溶液和酸性溶液的反应来探究外界条件改变对化学反应速率的影响,实验如下:
实验序号
实验温度/K
参加反应的物质
溶液颜色褪至无色时所需时间/s
溶液(含硫酸)
溶液
①
290
2
0.02
3
0.1
0
6
②
2
0.02
2
0.1
8
③
315
2
0.02
0.1
1
回答下列问题:
(1)通过实验①、②,可探究的改变对反应速率的影响,其中。
(2)通过实验(填实验序号)可探究温度变化对化学反应速率的影响,由实验②中数据可知。
Ⅱ.某兴趣小组以重铬酸钾溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。
已知:①溶液存在平衡:。②。

(3)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是。
(4)ⅲ的目的是要验证“增大生成物浓度,该平衡逆向移动”,此实验是否能达到预期目的(填“能”或“不能”),理由是。
(5)根据实验Ⅱ中不同现象,可以得出的结论是。
-
5、常温下,几种酸的电离常数如表所示。
酸或碱
(次磷酸)
或
回答下列问题:
(1)、上述酸的酸性最强的是(写化学式)。若将10mLpH值均为2的HCN溶液与HF溶液稀释到1000mL,如下图所示,则代表HF溶液的是线(A或B)。 (2)、已知次磷酸是一元酸,则次磷酸与足量的氢氧化钠溶液反应的离子方程式为。(3)、向KCN溶液中通入少量 , 写出反应的离子方程式:。(4)、已知: 。其他条件不变,如果用HF溶液替代盐酸测定中和反应的反应热,测得的会_______(填字母)。A、偏高 B、偏低 C、无影响 D、无法判断(5)、已知:CuS为不溶于硫酸的沉淀。
(2)、已知次磷酸是一元酸,则次磷酸与足量的氢氧化钠溶液反应的离子方程式为。(3)、向KCN溶液中通入少量 , 写出反应的离子方程式:。(4)、已知: 。其他条件不变,如果用HF溶液替代盐酸测定中和反应的反应热,测得的会_______(填字母)。A、偏高 B、偏低 C、无影响 D、无法判断(5)、已知:CuS为不溶于硫酸的沉淀。①往溶液中通入少量的 , 发生反应的化学方程式为充分反应后,溶液的pH(填“变大”“变小”或“不变”)。
②常温下,往的氢硫酸溶液中逐滴滴入未知浓度的NaOH溶液,当溶液中的时,停止滴入,此时溶液的。
-
6、电解质的水溶液中存在电离平衡。(1)、醋酸是常见的弱酸,下列方法中,可以使稀醋酸中电离程度减小的是。
a.微热溶液 b.滴加浓盐酸 c.加水稀释 d.加入冰醋酸
(2)、常温条件下,用0.1000mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。(已知:醋酸钠溶液呈弱碱性)
①滴定开始前,Ⅰ图中水电离出的是mol/L。
②滴定醋酸的曲线是(填“I”或“Ⅱ”),且(填“>”、“<”或“=”)。
(3)、如下图为盛放盐酸的滴定管中液面的位置,盐酸的体积读数读数为mL。 (4)、酸碱中和滴定可用于测定酸或碱的物质的量浓度,取20.00mL未知浓度的醋酸放入锥形瓶中,用0.1000mol/LNaOH标准溶液进行滴定。重复上述操作2~3次,记录数据如下。(已知:醋酸钠溶液呈弱碱性)
(4)、酸碱中和滴定可用于测定酸或碱的物质的量浓度,取20.00mL未知浓度的醋酸放入锥形瓶中,用0.1000mol/LNaOH标准溶液进行滴定。重复上述操作2~3次,记录数据如下。(已知:醋酸钠溶液呈弱碱性)实验编号
NaOH溶液的浓度()
滴定完成时,NaOH溶液滴入的体积(mL)
待测醋酸的体积(mL)
1
0.1000
22.48
20.00
2
0.1000
25.72
20.00
3
0.1000
22.52
20.00
①该滴定过程应选择(填“甲基橙”或“酚酞”)为指示剂,判断滴定终点的现象是。②根据上述数据,可计算出该醋酸的浓度约为mol/L。
(5)、在上述实验中,下列操作会造成测定结果偏大的有。(填字母序号)。A.滴定前仰视读数,滴定后俯视读数
B.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
C.滴定过程中,溶液刚出现变色,立即停止滴定
D.锥形瓶水洗后未干燥
E.碱式滴定管尖嘴部分有气泡,滴定后消失
-
7、下列实验均在室温条件下完成,则下列说法正确的是A、中和pH和体积均相等的醋酸、HCl溶液,所需NaOH的物质的量后者多 B、将的NaOH溶液稀释100倍,得到的溶液 C、测出1mol/L的醋酸 , 则0.01mol/L的醋酸 D、测出番茄汁的 , 其中是的牛奶的100倍
-
8、下列关于各图像的解释或结论正确的是
 A、图甲为水的电离平衡曲线图,若从点到点,可采用在水中加入适量固体的方法 B、由乙可知:对于恒温恒容条件下的反应 , A点为平衡状态 C、图丙表示在时刻扩大容器体积,随时间变化的曲线 D、图丁可表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
A、图甲为水的电离平衡曲线图,若从点到点,可采用在水中加入适量固体的方法 B、由乙可知:对于恒温恒容条件下的反应 , A点为平衡状态 C、图丙表示在时刻扩大容器体积,随时间变化的曲线 D、图丁可表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 -
9、用下列实验装置进行相应实验,能达到实验目的的是
 A、用装置甲定量测定化学反应速率 B、用装置乙比较对分解速率的影响 C、用装置丙准确测定中和反应的反应热 D、用装置丁依据出现浑浊的快慢探究浓度对化学反应速率的影响
A、用装置甲定量测定化学反应速率 B、用装置乙比较对分解速率的影响 C、用装置丙准确测定中和反应的反应热 D、用装置丁依据出现浑浊的快慢探究浓度对化学反应速率的影响 -
10、一定温度下,容积为1L的密闭容器内,某一反应体系中X、Y的物质的量随时间的变化曲线如图所示,下列说法错误的是
 A、时Y的浓度是X的2倍 B、时向容器中加入催化剂,Y的转化率增大 C、时正反应速率等于逆反应速率 D、时间内,平均反应速率
A、时Y的浓度是X的2倍 B、时向容器中加入催化剂,Y的转化率增大 C、时正反应速率等于逆反应速率 D、时间内,平均反应速率 -
11、甲烷燃烧时的能量变化如下图,有关描述不正确的是
 A、反应①和反应②均为放热反应 B、等物质的量的CO2(g)能量比CO(g)低 C、由图可以推得: D、反应②的热化学方程式:
A、反应①和反应②均为放热反应 B、等物质的量的CO2(g)能量比CO(g)低 C、由图可以推得: D、反应②的热化学方程式: -
12、下列反应方程式正确的是A、溶液与稀硫酸反应的离子方程式: B、醋酸与NaOH溶液反应的离子方程式: C、氢硫酸的电离方程式: D、表示甲烷燃烧热的热化学方程式:
-
13、时,下列说法不正确的是A、的醋酸的电离常数相同 B、某物质溶于水后测定其溶液的 , 一定是中性 C、由水电离出的的浓度为的溶液,溶液呈碱性 D、同pH的盐酸、醋酸溶液,对水的抑制程度相等
-
14、下列不能用勒夏特列原理解释的事实是A、红棕色的NO2加压后颜色先变深后变浅 B、氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 C、黄绿色的氯水光照后颜色变浅 D、向含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡,溶液红色变浅或褪去
-
15、下列事实能说明是弱电解质的是A、中只有共价键,没有离子键 B、常温下0.1 mol/L 溶液的为 C、溶液与溶液不反应 D、将溶液接入电路时灯泡较暗
-
16、下列说法正确的是A、当可逆反应达平衡状态,则该反应停止 B、在可逆反应中,正反应的化学反应速率是正值,逆反应的化学反应速率是负值 C、用铁片与稀硫酸反应制取氢气时,改用98%浓硫酸可以加快反应速率 D、中,当混合气体的颜色不再改变的状态达到平衡
-
17、下列变化过程中一定不存在化学能转化为热能的




A.谷物酿酒
B.木材燃烧
C.干冰升华
D.鞭炮燃放
A、A B、B C、C D、D -
18、某学校小组探秘人体血液中的运载氧平衡及酸碱平衡,请回答下列问题:(1)、正常人体血液中主要含有和形成的缓冲体系,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
项目名称
结果浓度
参考范围
正常人
代谢性酸中毒病人
CO2分压/mmHg
40
50
35~45
c()/mmol·L+
24.2
19
23.3~24.8
血液酸碱度(pH)
7.40
7.21
7.35~7.45
用方程式表示人体血液中存在的化学平衡:。
(2)、人体酸碱平衡维持机制简要表达如下图:
①当人体摄入酸过多时,肺通过呼吸排出的CO2会(选填“增加”“不变”或“减少”)。
②对于重度代谢性酸中毒的病人应该采用什么治疗方法。
A.口服0.9%KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5%NaHCO3溶液 D.静脉注射0.9%NaCl溶液
(3)、血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合。与氧气的结合度α(吸附O2的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压密切相关。①Hb与氧气的结合能力受到c(H+)的影响,相关反应如下:Hb(aq)+H+(aq)⇌HbH+(aq)+O2(g)。37℃,pH分别为7.2、7.4、7.6时氧气分压与达到平衡时Hb与氧气的结合度α的关系如图所示,pH=7.6时对应的曲线为(填“A”或“B”)。
 (4)、Mb与氧气结合的反应如下:氧气分压与达平衡时Mb与氧气的结合度α的关系如图所示。
(4)、Mb与氧气结合的反应如下:氧气分压与达平衡时Mb与氧气的结合度α的关系如图所示。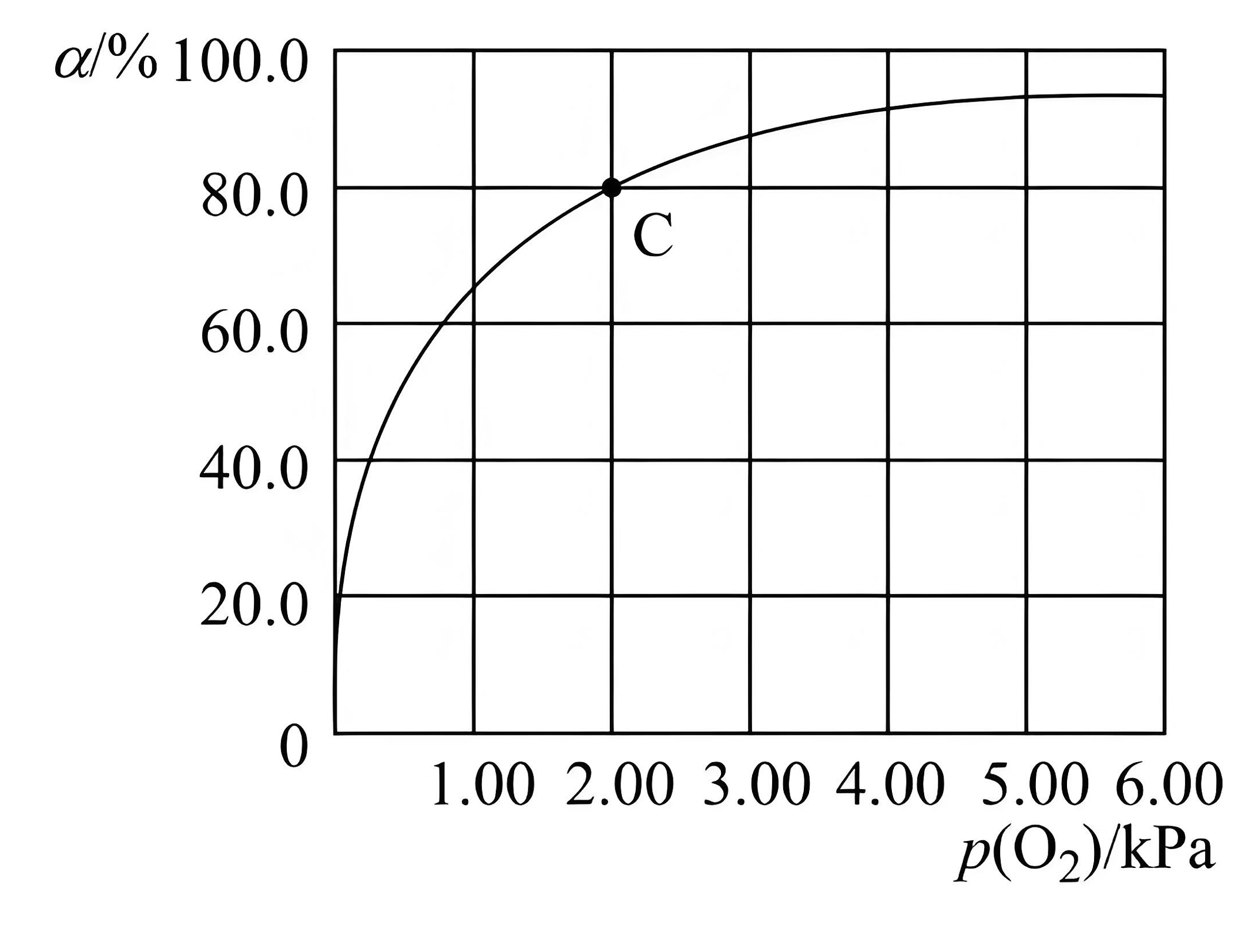
①经测定,体温升高,Mb与氧气的结合度降低,则该反应的ΔH(填“>”、“<”或“=”)0。
②已知Mb与氧气结合的反应的平衡常数表达式计算37℃时K=kPa-1。
-
19、含氮化合物在现代工业、环境治理中有重要地位。请回答下列有关问题:(1)、用CH4催化还原氮氧化物可以消除氢氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
写出CH4(g)与反应生成N2(g)、CO2 (g)和H2O(l)的热化学方程式。
(2)、不同催化剂下合成氨反应的历程如下图,吸附在催化剂表面的物种用“*”表示。由图可知,使用催化剂A时,决速步骤的产物是。合成氨工业上采取了10-30个大气压,400-500℃的高温环境,请从速率或平衡的角度解释原因。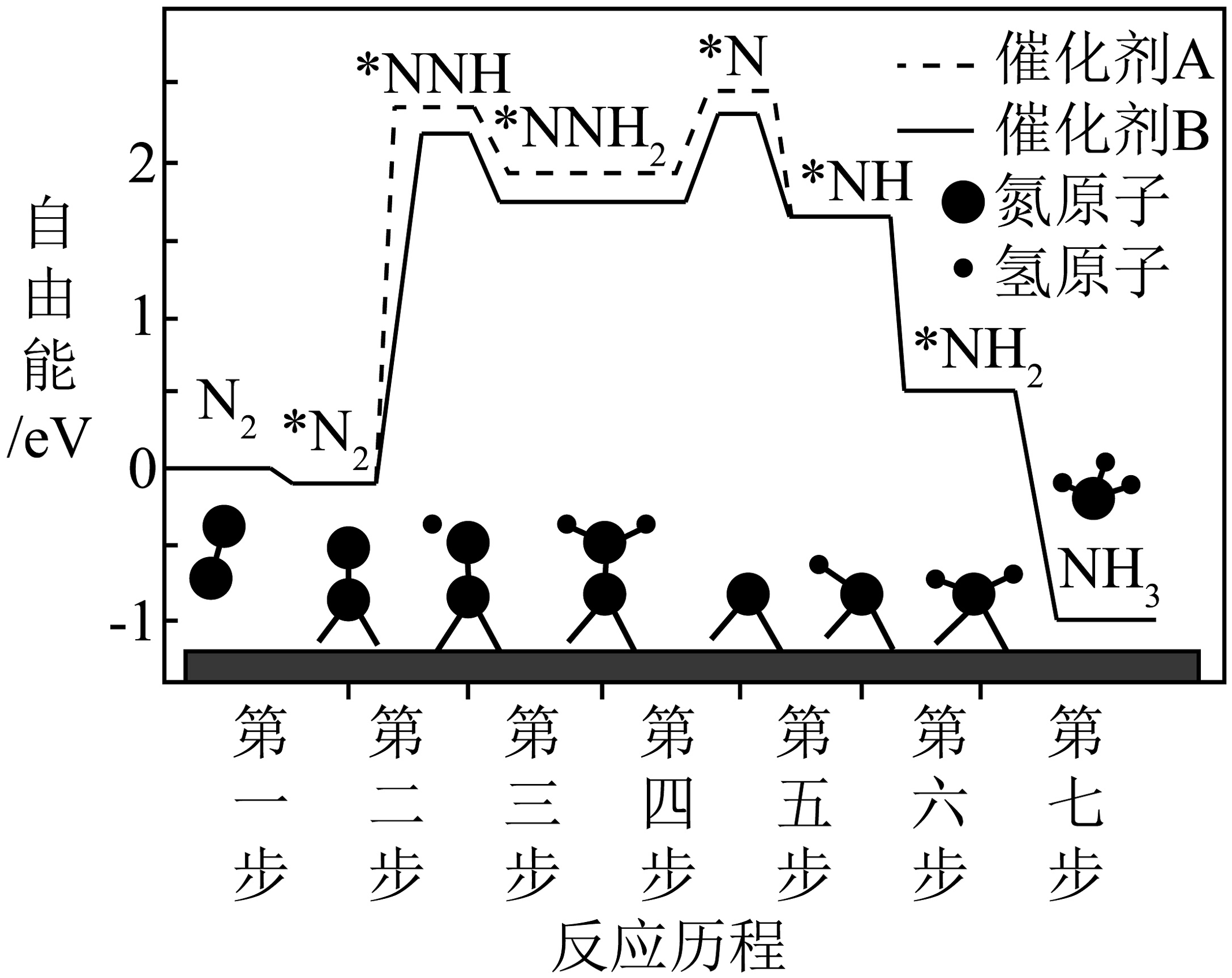 (3)、氨气是工业制取硝酸的重要原料,过程中有以下两个竞争反应I、II。
(3)、氨气是工业制取硝酸的重要原料,过程中有以下两个竞争反应I、II。反应I: ΔH1=-905.0kJ/mol
反应II: ΔH2=-1268kJ/mol
为分析某催化剂对该反应的选择性,将1molNH3和2molO2充入2L密闭容器中,在不同温度,相同时何下,测得有关物质的量关系如图所示。

①该催化剂在低温时对反应(填“I”或“II”)的选择性更好。
②520℃时,反应II:4NH3的平衡常数K= (只需列出有具体数字的计算式,不要求计算出结果)。
③高于840℃时,NO的产率降低的可能原因是。
A.NH3溶于水 B.反应活化能增大
C.反应I的平衡常数变小 D.催化剂活性降低
(4)、NH3也是造成水体富营养化的重要原因之一,用NaClO溶液氧化可除去氨。为了提高氨的去除率,在实际工艺过程中温度控制在15℃~30℃时,请分析选择这个温度范围的原因是。 -
20、硼在冶金、核工业、农业、高新材料等方面都有重要的应用,一种利用硼镁矿制取粗硼的工艺流程:

已知:硼镁矿的主要成分为硼砂的化学式为
回答下列问题:
(1)、硼镁矿要粉碎处理,其目的是 , NaOH浓溶液与硼镁矿反应的化学方程式为(不考虑杂质参与反应)。(2)、请解释流程中生成无水需在HCl氛围中进行的原因。(3)、写出B2O5和Mg在高温下发生置换反应的化学方程式。(4)、已知为一元弱酸,其与NaOH反应的化学方程式为写出在水中的电离方程式:。(5)、实验测得一定质量的在不同温度下分解的曲线如图所示。图中A、B、C、D点对应得到的物质都为纯净物。
①C对应的物质可表示为:则n=。
②写出C到D过程中发生反应的化学方程式:。