相关试卷
-
1、一定温度下,在3个体积均为1.0 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
容器
温度/ ℃
物质的起始浓度/(mol/L)
物质的平衡浓度/(mol/L)
c(SO2)
c(O2)
c(SO3)
c(SO3)
I
758
0.2
0.1
0
0.044
Ⅱ
758
0.1
0.05
0
Ⅲ
858
0.2
0.1
0
A、从开始至平衡时,容器I中SO3的反应速率为0.044 mol/(L·s) B、平衡时,容器Ⅲ中SO3的浓度大于0.044 mol/L C、平衡时,容器Ⅱ中SO3的浓度小于0.022 mol/L D、若起始时,向容器I中充入0.02 mol SO2、0.01 mol O2和0.02 mol SO3 , 则反应正向进行 -
2、锰系氧化物催化降解甲醛具有去除效率高无二次污染等优点,其中一种催化机理如图所示。下列说法错误的是
 A、为中间产物 B、降低了反应①的活化能 C、反应②中有碳氧键断裂 D、该机理的总反应的化学方程式为
A、为中间产物 B、降低了反应①的活化能 C、反应②中有碳氧键断裂 D、该机理的总反应的化学方程式为 -
3、向1 L的密闭容器中通入2 mol CO2(g)、2 mol H2(g),发生反应为H2(g)+CO2(g)CO(g)+H2O(g) ΔH。在T1、T2下,测得CO的物质的量随时间的变化曲线如图所示。下列说法不正确的是
 A、CO2平衡转化率:α(T1)<α(T2) B、前3 min,T2温度下容器内发生的有效碰撞次数比T1温度下少 C、T2温度下,12 min时,向容器中再分别充入H2、CO2、CO、H2O各1 mol,平衡逆向移动 D、在初始温度T1下,向1 L绝热容器通入2 mol CO2(g)、2 mol H2(g),平衡时n(CO)<1 mol
A、CO2平衡转化率:α(T1)<α(T2) B、前3 min,T2温度下容器内发生的有效碰撞次数比T1温度下少 C、T2温度下,12 min时,向容器中再分别充入H2、CO2、CO、H2O各1 mol,平衡逆向移动 D、在初始温度T1下,向1 L绝热容器通入2 mol CO2(g)、2 mol H2(g),平衡时n(CO)<1 mol -
4、氨氮废水中的氮元素多以和NH3·H2O的形式存在,在一定条件下,经过两步反应被氧化成 (第二步是快反应),两步反应的能量变化示意图如下:

下列说法合理的是
A、该反应的催化剂是 B、1 mol全部氧化成吸收的热量为346 kJ C、可以通过测定废水的pH变化来判断氮元素的去除效果 D、升高温度,两步反应速率均加快,温度越高越有利于废水中的氮元素转化 -
5、某温度下,密闭容器中发生反应aX(g)⇌bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是A、a>b+c B、压缩容器的容积时,v正增大,v逆减小 C、达到新平衡时,物质X的转化率减小 D、达到新平衡时,混合物中Z的质量分数增大
-
6、反应达到平衡状态后,改变某一条件,下列图像与条件变化相悖的是
A.增大N2浓度
B.升高温度
C.改变压强
D.加入催化剂



 A、A B、B C、C D、D
A、A B、B C、C D、D -
7、焦炭还原二氧化硫对于烟气脱硫具有重要意义。该反应的化学方程式为2C(s)+2SO2(g)S2(g)+2CO2(g) ∆H<0。向1 L密闭容器中加入足量的焦炭和1 mol SO2发生上述反应。其他条件一定,在甲、乙两种催化剂作用下,反应相同时间,测得SO2(g)转化率与温度的关系如下图所示。下列说法正确的是
 A、该反应的∆S<0 B、生成1molSO2同时消耗1molCO2 , 可判断反应到达平衡 C、若反应足够的时间,图中两条曲线可能会完全重合 D、该反应适宜的条件是选用甲催化剂,反应温度在500℃左右
A、该反应的∆S<0 B、生成1molSO2同时消耗1molCO2 , 可判断反应到达平衡 C、若反应足够的时间,图中两条曲线可能会完全重合 D、该反应适宜的条件是选用甲催化剂,反应温度在500℃左右 -
8、某温度下,在恒容密闭容器中、、建立化学平衡: , 改变下列条件对正、逆反应速率的影响不正确的是



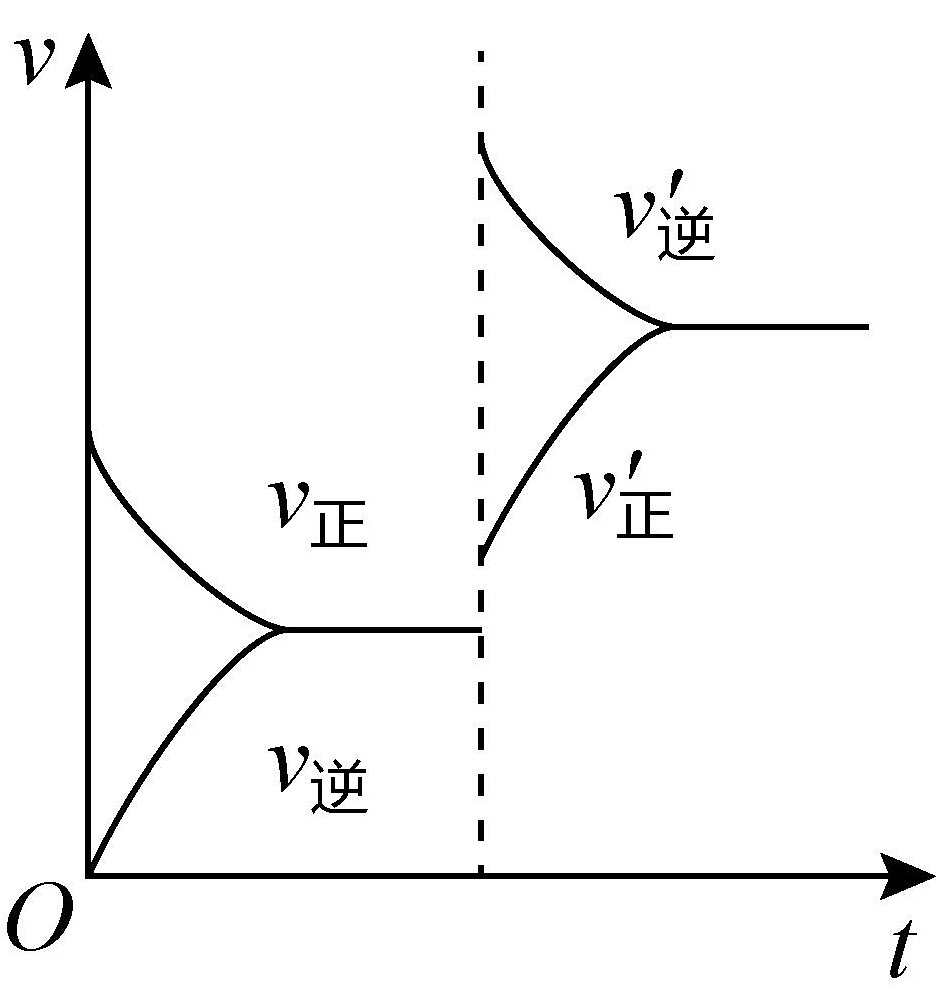
A.压缩容器体积
B.通入
C.使用(正)催化剂
D.升高温度
A、A B、B C、C D、D -
9、某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g)Z(g)+W(s) ΔH>0,下列叙述正确的是A、在容器中加入氩气,反应速率增大 B、加入少量W,逆反应速率增大 C、升高温度,平衡常数增大 D、若将容器的体积压缩,可增大单位体积内活化分子的百分数,有效碰撞次数增大
-
10、在密闭容器中发生储氢反应:LaNi5(s)+3H2(g)LaNi5H6(s) ΔH<0。在一定温度下,达到平衡状态,测得氢气压强为2 MPa。下列说法不正确的是A、低温条件有利于该反应正向自发,利于储氢 B、升高温度,v正增大,v逆增大,平衡逆向移动 C、缩小容器的容积,平衡正向移动,重新达到平衡时H2的浓度减小 D、向密闭容器中充入氢气,平衡正向移动,但平衡常数不变
-
11、下列依据热化学方程式得出的结论正确的是
热化学方程式
结 论
A
2H2(g)+O2(g)=2H2O(l) ΔH=-483.6 kJ/mol
H2 的燃烧热为 483.6kJ/mol
B
OH-(aq)+H+(aq)=H2O(l) ΔH=-57.3kJ/mol
含1mol NaOH 的稀溶液与浓 H2SO4完全中和,放出的热量小于57.3kJ
C
2C(s)+2O2(g)=2CO2(g) ΔH=-a kJ/mol
2C(s)+O2(g)=2CO(g) ΔH=-b kJ/mol
b <a
D
C (石墨,s)=C (金刚石,s) ΔH=+1.5 kJ/mol
金刚石比石墨稳定
A、A B、B C、C D、D -
12、把下列4种溶液,分别加入到4支装有形状大小相同的锌粒的试管中充分反应,其中产生H2的速率最大的是A、40 mL,5 mol·L-1的盐酸 B、60 mL,6 mol·L-1的硝酸 C、15 mL,4 mol·L-1的硫酸 D、40mL,18 mol·L-1的硫酸
-
13、现将固体加热一段时间后,收集到。在反应后的残留固体中加入质量分数为36.5%的浓盐酸(足量),又收集到 , 此时元素全部以形式存在于溶液中。(1)、已知反应: , 用单线桥法标出该反应电子转移的方向和数目。(2)、所加浓盐酸中氯化氢的物质的量为。(3)、。
-
14、氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。利用下图装置(部分装置省略)制备和 , 并探究其性质。
 (1)、装置A中发生反应的化学方程式是。(2)、装置B的作用是。(3)、关于该实验,下列说法不正确的是A、实验过程中应在通风内操作 B、由装置C、D可知,氯气与碱反应温度不同,产物不同 C、该实验装置存在缺陷,应在B、C之间加入一个装有浓硫酸的洗气瓶 D、装置A加热时温度不宜过高,以免浓盐酸大量挥发(4)、取少量和溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液变为棕色,加入淀粉溶液后,溶液变为蓝色。2号试管溶液颜色不变。可以推知该条件下氧化能力:(填“大于”或“小于”或“等于”)。(5)、反应结束后,取出C中试管,经冷却结晶, , 洗涤,干燥,得到晶体。生成的离子方程式为。
(1)、装置A中发生反应的化学方程式是。(2)、装置B的作用是。(3)、关于该实验,下列说法不正确的是A、实验过程中应在通风内操作 B、由装置C、D可知,氯气与碱反应温度不同,产物不同 C、该实验装置存在缺陷,应在B、C之间加入一个装有浓硫酸的洗气瓶 D、装置A加热时温度不宜过高,以免浓盐酸大量挥发(4)、取少量和溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液变为棕色,加入淀粉溶液后,溶液变为蓝色。2号试管溶液颜色不变。可以推知该条件下氧化能力:(填“大于”或“小于”或“等于”)。(5)、反应结束后,取出C中试管,经冷却结晶, , 洗涤,干燥,得到晶体。生成的离子方程式为。 -
15、对盐X:进行如下实验:

请回答:
(1)、单质气体A是(填分子式),磁性黑色固体E是(填化学式)。(2)、下列说法正确的是___________。A、盐X具有氧化性 B、工业上常用气体A与澄清石灰水制备漂白粉 C、红棕色固体C常用作油漆、涂料、油墨和橡胶的红色颜料 D、在高温下与水蒸气反应可以生成气体B(3)、写出固体C隔绝空气加热生成E的化学方程式。(4)、写出固体E与浓盐酸反应的离子方程式。(5)、设计实验方案检验溶液G中的金属阳离子。 -
16、某同学欲用硫酸铜晶体()配制的溶液。
请回答下列问题:
(1)、实验过程中涉及的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和。(2)、配制过程中需要称量的质量为g。(3)、配制溶液时正确的操作顺序是f(请把中间步骤补充完整)。a.将烧杯中的溶液沿玻璃棒注入容量瓶
b.计算并称量所需的固体
c.用少量蒸馏水洗涤烧杯内壁和玻璃棒次,将洗涤液也都注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀
d.将蒸馏水注入容量瓶,后定容
e.将称好的固体放入烧杯中,加入蒸馏水,用玻璃棒搅拌,使固体全部溶解
f.将配制好的溶液倒入试剂瓶中,并贴好标签
g.盖好瓶塞,反复上下颠倒,摇匀
(4)、将定容的具体操作补充完整:将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线时,改用胶头滴管滴加蒸馏水至溶液的。盖好瓶塞,反复上下颠倒,摇匀。(5)、下列说法正确的是___________。A、定容操作时,俯视刻度线,会导致所配溶液浓度偏高 B、容量瓶在检漏和洗净后无需干燥即可配制溶液 C、摇匀后发现溶液未达到刻度线,再加几滴蒸馏水至刻度线,对所配溶液浓度无影响 D、转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制 -
17、请回答:(1)、①生石灰的化学式为。
②除去溶液中少量的杂质应加入(填化学式)。
(2)、在溶液中加入溶液时,生成的色絮状沉淀迅速变成色,过一段时间后还会有红褐色物质生成。(3)、写出钠与水反应的离子方程式。(4)、现有8种物质:①熔融 ②氯水 ③ ④葡萄糖 ⑤稀硫酸 ⑥ ⑦ ⑧
上述物质中:属于电解质的是 , 能导电的是。
-
18、实验小组利用传感器探究和的性质,并测量实验过程中烧杯中溶液的 , 下列说法正确的是
 A、可以省略实验① B、①与②的实验数据基本相同,说明②中和澄清石灰水不反应 C、实验③中当加入试剂体积为时,反应的离子方程式: D、实验③的变化与实验②的变化有明显差异,原因是滴加溶液的烧杯中消耗了
A、可以省略实验① B、①与②的实验数据基本相同,说明②中和澄清石灰水不反应 C、实验③中当加入试剂体积为时,反应的离子方程式: D、实验③的变化与实验②的变化有明显差异,原因是滴加溶液的烧杯中消耗了 -
19、工业废水中含有的重铬酸根离子有毒,常用绿矾处理达标后排放,已知处理含重铬酸根离子浓度为的废水,消耗绿矾(被氧化为),则处理后的废水中铬元素的化合价为A、+3 B、+4 C、+5 D、+6
-
20、下列实验操作不正确的是


A.比较和的热稳定性
B.除去溶液中混有的少量


C.实验室收集
D.检验与水反应生成的气体
A、A B、B C、C D、D