相关试卷
-
1、下列有关实验描述正确的是A、向NaOH溶液中滴加饱和溶液制备胶体 B、向溶液中通入少量可观察到有白色沉淀生成 C、用稀盐酸洗净的玻璃棒蘸取NaCl溶液进行焰色试验,观察到火焰呈黄色 D、将新制氯水放置在棕色细口瓶中并遮光保存
-
2、类比是研究物质性质的常用方法之一,下列类比正确的是A、是碱性氧化物,也是碱性氧化物 B、Cu与反应生成 , Fe与反应生成 C、与反应生成和 , 则与反应也生成和 D、溶解度大于 , 的溶解度也大于
-
3、下列逻辑关系图中正确的是A、
 B、
B、 C、
C、 D、
D、
-
4、下列关于实验室突发事件的应对措施和常见废弃物的处理方法不正确的是A、中学实验室中,未用完的钠、钾、白磷可放回原试剂瓶 B、如果不慎将碱沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸 C、应将酸、碱、氧化剂或还原剂的废液倒在同一个废液缸内再排放 D、手指被玻璃割伤,先用药棉把伤口清理干净,然后用碘酒擦洗,再用创可贴外敷
-
5、下列说法不正确的是A、在紫外线作用下转化为是化学变化 B、在实验室中,要把Na保存在石蜡油或煤油中,以隔绝空气 C、为防止月饼等富脂食品因氧化变质,常在包装袋中放入生石灰 D、花青素遇碱显蓝色,故可用苏打检验红酒中是否含有花青素
-
6、同种物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应称为歧化反应。下列反应中是歧化反应的是A、 B、 C、 D、
-
7、下列关于胶体叙述正确的是A、蛋白质溶液、有色玻璃、云、雾均属于常见的胶体 B、纳米四氧化三铁粒子直径在1~100nm,属于胶体 C、溶液和胶体的本质区别是能否发生丁达尔效应 D、胶体能够与水发生化学反应,达到净水目的
-
8、下列溶液中浓度最大的是A、5mL的NaCl溶液 B、3mL的溶液 C、1mL的溶液 D、2mL的溶液
-
9、下列仪器与名称对应且书写正确的是A、
 泥三角
B、
泥三角
B、 钳埚
C、
钳埚
C、 长颈漏斗
D、
长颈漏斗
D、 溶量瓶
溶量瓶
-
10、下列物质属于电解质的是A、酒精 B、石墨 C、稀硫酸 D、NaOH
-
11、下列物质中属于盐的是A、 B、HClO C、 D、
-
12、填空。(1)、128g铜的物质的量是mol。(2)、等质量的O2和O3所含的原子个数之比是。(3)、44gCO2气体在标准状态下的体积是L。(4)、配制500mL1.0mol/LH2SO4溶液,需要18mol/LH2SO4溶液的体积为mL。
-
13、用如图所示装置进行实验,证明过氧化钠(Na2O2)可在呼吸面具和潜水艇中作供氧剂。

请回答:
(1)、A中盛放稀盐酸的装置的名称。(2)、装置C中过氧化钠与二氧化碳反应的化学方程式是。(3)、装置B作用是。(4)、当装置内气流平稳后开始用试管收集气体,该气体能 , 证明过氧化钠可作供氧剂。 -
14、铜与浓硫酸可发生如下反应:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。(1)、用单线桥标出电子转移的方向和数目:。(2)、该反应中氧化产物是(填化学式)(3)、该反应中氧化剂与还原剂物质的量之比是。
-
15、以氯化钠为原料可以制备纯碱,烧碱,漂白粉等多种工业产品,流程示意图,如下:

请回答:
(1)、氯气可以用来制备漂白粉,写出氯气的其他一种用途。(2)、漂白粉的有效成分(填化学式)。(3)、写出实验室制取氯气的离子方程式。(4)、写出晶体Z加热的化学方程式。(5)、下列说法不正确的是_______。A、步骤I能制得金属钠 B、步骤II制备漂白粉的试剂W为冷的石灰乳 C、铁在氯气中燃烧生成氯化铁 D、干燥的氯气不能使有色鲜花变色 -
16、按要求回答下列问题:(1)、氯化铁的化学式。(2)、硫酸钾在水溶液中的电离方程式。(3)、碳酸钠与足量稀盐酸反应的离子方程式。(4)、向沸水中逐滴加入5~6滴饱和溶液,继续加热至沸腾,液体呈现色,停止加热,即可制得胶体。
-
17、下列有关实验操作、实验现象及实验结论都正确的是A、向溶液中通入少量CO2 , 有白色沉淀生成,白色沉淀为CaCO3 B、某试样做焰色试验,火焰呈黄色,该试样一定是钠盐 C、把小块钠投入到硫酸铜溶液中,钠熔化成闪亮的小球,在水面上四处游动,有“嘶嘶”的响声发出,有蓝色絮状沉淀生成 D、向某无色溶液中滴加硝酸银溶液,有白色沉淀生成,原无色溶液中一定含有氯离子
-
18、NaCl溶于水,溶解过程如图所示。下列说法不正确的是
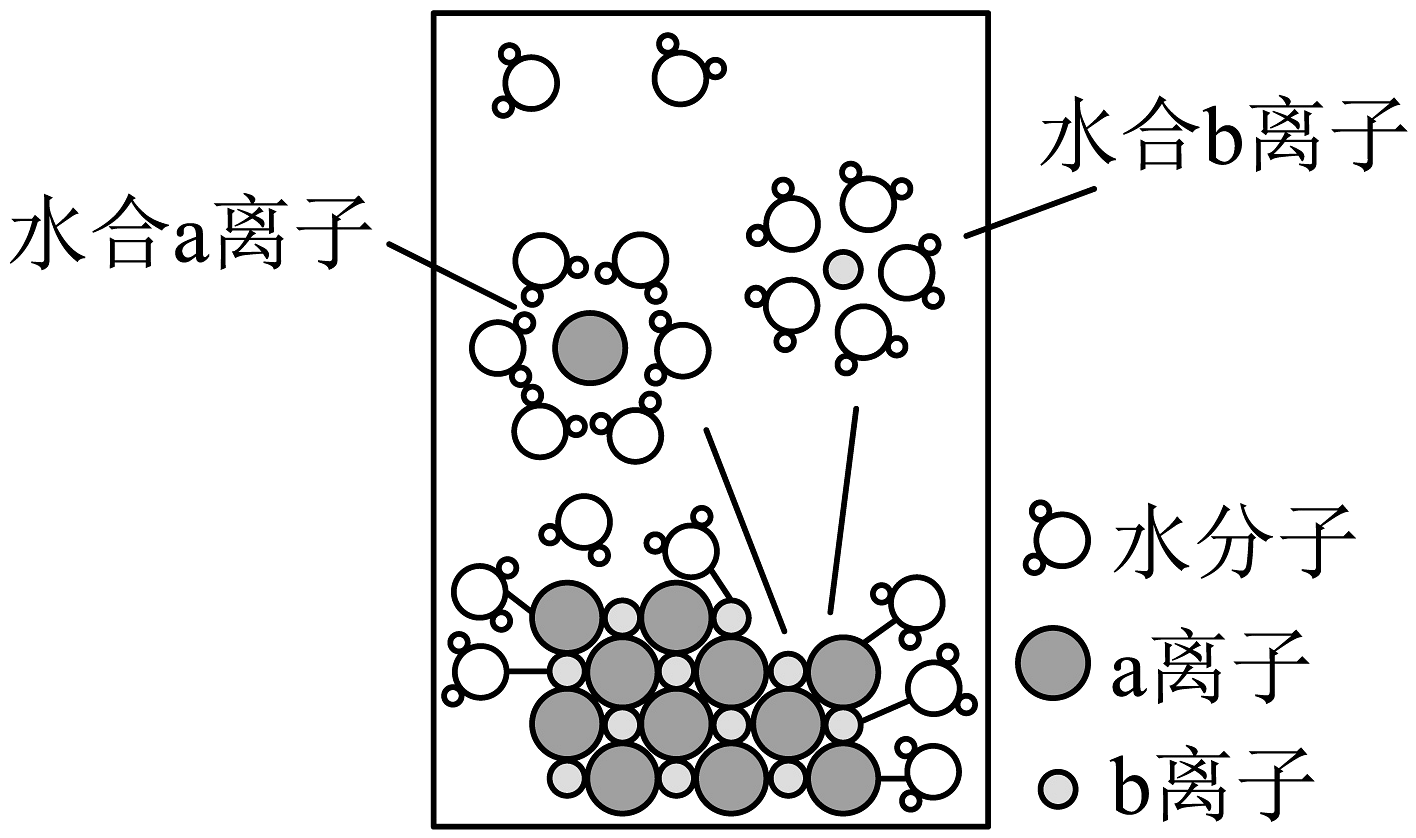 A、a离子为Cl− , b离子为Na+ B、NaCl在水分子的作用下,形成自由移动的水合钠离子和水合氯离子 C、NaCl溶液导电的原因是溶液中有自由移动的离子 D、在通电后,NaCl固体发生电离
A、a离子为Cl− , b离子为Na+ B、NaCl在水分子的作用下,形成自由移动的水合钠离子和水合氯离子 C、NaCl溶液导电的原因是溶液中有自由移动的离子 D、在通电后,NaCl固体发生电离 -
19、下列有关Na2CO3和NaHCO3的性质,叙述错误的是A、鉴别Na2CO3和NaHCO3可以用BaCl2溶液 B、Na2CO3、NaHCO3的水溶液均呈碱性 C、向Na2CO3粉末和NaHCO3晶体中滴入少量水,前者温度升高,后者温度下降 D、NaHCO3热稳定性大于Na2CO3
-
20、实验室需要配制2mol/L的NaCl溶液450mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是A、450mL52.65g B、500mL58.5g C、450mL52.7g D、任意规格58.5g