相关试卷
-
1、下列化学用语表述正确的是A、的电子式:
 B、在水中的电离方程式:
C、纯碱的化学式:
D、乙酸的结构简式:
B、在水中的电离方程式:
C、纯碱的化学式:
D、乙酸的结构简式:
-
2、新疆维吾尔自治区,边塞诗的故乡。下列有关说法错误的是A、“明月出天山,苍茫云海间”,云转化为雨属于物理变化 B、“葡萄美酒夜光杯,欲饮琵琶马上催”,葡萄酒属于弱电解质 C、“忽如一夜春风来,千树万树梨花开”,水蒸气凝结成雪花是放热的过程 D、“大漠空高尘不飞,新秋塞上草犹肥”,牧草晒干水分可以减缓腐败速率
-
3、无水四氯化锡()用于制作FTO导电玻璃,FTO导电玻璃广泛用于液晶显示屏、光催化和薄膜太阳能电池基底等,可用如图装置使熔融状态下的Sn与反应制备。

【相关药品的性质】
药品
颜色、状态
熔点(℃)
沸点(℃)
其他性质
Sn
银白色固体
231
2260
较活泼金属能与等气体反应
无色液体
114
极易水解产生溶胶
无色晶体
246
652
具有还原性,可被空气中的氧气氧化
请回答下列问题:
(1)、仪器a的名称是。(2)、为了获得较纯的产品,当装置戊处具支试管中(现象)时,再点燃装置丁处酒精灯。反应制得的产品中可能会含有杂质 , 为加快反应速率并防止产品中混有 , 除了通入过量外,还应控制反应的最佳温度范围为。(3)、水解的化学方程式为。(4)、经测定发现实验所得样品中含有少量的 , 测定样品纯度的方案如下:取样品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用碘酸钾标准溶液滴定至终点,消耗标准液VmL。滴定过程中先后发生的反应为:ⅰ.;ⅱ.(均未配平)。①滴定前,有关滴定管的正确操作为:。
(_______)→蒸馏水洗涤→(_______)→(_______)→(_______)→(_______)→(_______)→后续操作。
A.记录起始读数
B.装入待装液至“0”刻度以上2~3cm处
C.调整滴定管液面至“0”刻度或“0”刻度以下
D.赶出滴定管内部气泡
E.用待装液润洗2至3次
F.检漏
②0.0100mol/L碘酸钾标准溶液应装在滴定管中,滴定终点的现象为。
③样品的纯度为;若滴定时间过长,会使测量结果(填“偏大”“偏小”)。
-
4、是一种重要的化工品,一定温度下发生分解反应:
①
②
②
回答下列问题:
(1)、(用含和的式子表示),反应③自发进行的条件是(填“较低温度”、“较高温度”或“任何温度”)。(2)、向一恒温恒容密闭容器中投入足量(s),只发生反应(1),下列叙述正确的是_______。A、再投入少量的(s),反应速率明显增大 B、平衡后,再充入少量氩气,该平衡逆向移动 C、平衡后,再充入少量质量增大 D、混合气体平均相对分子质量不变时,该反应达到平衡状态(3)、的速率方程为(、为速率常数,K为反应平衡常数,只与温度有关)。①某温度下, , 则。
②已知:(A和R均为常数,的单位为 , 温度T的单位为,E的单位为kJ/mol)。速率常数与活化能()、温度(T)的关系如下图所示(Cat1、Cat2为催化剂)。

相同条件下,催化效率较高的是(填“Cat1”或“Cat2”),判断依据是。
(4)、一定温度下,向体积为1L的恒容密闭容器中加入足量 , 达到平衡时测得生成和 , 则的平衡常数。 -
5、软锰矿的主要成分是 , 还含有少量金属铁、铝、铜的化合物等杂质,黄铁矿的主要成分是 , 还含有硅、铝的氧化物等杂质。工业上采用同槽酸浸工艺制备碳酸锰并回收硫酸铵,其主要流程如下:
 (1)、在浸取时不能提高浸出率的措施是_______。A、适当升高温度 B、加压 C、搅拌 D、矿石研成粉末(2)、“氧化”中加入与反应的离子方程式为:。(3)、已知:: , : , : , :。若形成“滤渣3”之前溶液中 , 则理论上需调节的pH范围为。(一般溶液中离子浓度小于或等于 , 即认为已经除尽,)(4)、“碳化”反应:。
(1)、在浸取时不能提高浸出率的措施是_______。A、适当升高温度 B、加压 C、搅拌 D、矿石研成粉末(2)、“氧化”中加入与反应的离子方程式为:。(3)、已知:: , : , : , :。若形成“滤渣3”之前溶液中 , 则理论上需调节的pH范围为。(一般溶液中离子浓度小于或等于 , 即认为已经除尽,)(4)、“碳化”反应:。①碳化温度采用50℃的原因是。
②已知:。请设计实验检验是否反应完全:。
-
6、硫酸是一种重要的化工原料,其制备方法和应用备受关注。(1)、在一定的温度、压强和钥催化剂存在的条件下,SO2被空气中的O2氧化为SO3。郭汗贤等提出:V2O5在反应Ⅰ的催化过程中,经历的Ⅱ、Ⅲ两个反应阶段如下图所示。

已知反应Ⅱ的化学方程式为:。则反应Ⅲ的化学方程式为:。
(2)、某科研单位利用电化学原理,使用SO2来制备硫酸,装置如下图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触,质子交换膜只允许H+通过,装置如下图所示。该制备的负极反应式为:。 (3)、我国科学家应用H2SO4、K2SO4和KOH为电解质,发明了一种Zn-PbO2电池,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,如下图所示。
(3)、我国科学家应用H2SO4、K2SO4和KOH为电解质,发明了一种Zn-PbO2电池,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,如下图所示。
①下列关于该电池说法正确的是。
A.PbO2覆盖的极板为正极
B.B区域的电解质为KOH
C.a为阴离子交换膜
D.负极反应式为:
②已知E为电池电动势[电池电动势即电池的理论电压,是两个电极电位之差为:E=E(+)-E(-)],△G为电池反应的自由能变,则该电池与传统铅酸蓄电池相比较,;。(填“>”或“<”)
③该电池充电时的阳极反应式为:。
-
7、已知在时,的电离平衡常数如下所示。
:;
:
:;
:
:;
请按要求回答下列问题。
(1)、浓度均为的①;②NaHS;③;④NaClO,四种溶液pH由大到小排列顺序为(用序号回答)。(2)、水溶液呈 (用“酸性”或“中性”或“碱性”填空);水溶液呈酸性的原因。(用简要文字描述)(3)、将少量溶液加入过量的溶液中,该反应离子方程式为 , 若所得溶液的 , 则此时溶液中。 -
8、根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计和结论都正确的是
实验目的
方案设计
现象
结论
A
探究压强对化学平衡的影响
向恒温恒容密闭玻璃容器中充入100mLHI气体,分解达到平衡后再充入100mLAr
气体颜色不变
对于反应前后气体总体积不变的可逆反应,改变压强平衡不移动
B
比较、的大小
向等物质的量浓度的NaCl、混合溶液中滴加溶液
先生成AgCl白色沉淀
C
比较HF与的酸性
分别测定等物质的量浓度的与溶液的pH
前者pH小
酸性:
D
探究温度对反应速率的影响
等体积、等物质的量浓度的与溶液在不同温度下反应
温度高的溶液中先出现浑浊
温度升高,该反应速率加快
A、A B、B C、C D、D -
9、某小组做如下实验:
实验①:向溶液中滴加盐酸溶液。
实验②:向2.33gBaSO4固体中加入溶液充分搅拌浸泡
[已知:常温下, , 的电离常数: , 溶液混合后体积变化忽略不计]
下列说法不正确的是
A、实验①选用酚酞作指示剂时,滴定终点发生反应为 B、实验①中盐酸时,存在: C、实验②中再加入溶液,可将完全转化为 D、实验②静置,向上层清液中滴加溶液,会析出和 -
10、氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比强。时氯气-氯水体系中存在以下平衡关系:
其中和分别在三者中所占物质的量分数随pH变化的关系如图所示。下列表述正确的是
 A、在氯处理水体系中,存在 B、在标准状况下,将2.24L氯气通入水中充分反应,电子转移数为(为阿伏加德罗常数的数值) C、用氯处理饮用水时,时杀菌效果比时好,且在夏季的杀菌效果比在冬季好 D、经计算,的平衡常数
A、在氯处理水体系中,存在 B、在标准状况下,将2.24L氯气通入水中充分反应,电子转移数为(为阿伏加德罗常数的数值) C、用氯处理饮用水时,时杀菌效果比时好,且在夏季的杀菌效果比在冬季好 D、经计算,的平衡常数 -
11、将金红石转化为是生产金属钛的关键步骤。在 , 将以物质的量之比为进行反应,平衡体系中主要物质的量分数随温度变化理论计算结果如图所示。

下列说法不正确的是
A、反应达到平衡时,的转化率均已接近 B、反应体系中可能发生的反应有:;; C、时,测得某时刻。其他条件不变,延长反应时间能使超过该温度下平衡时的 D、实际生产时反应温度选择而不选择 , 其主要原因是比时化学反应速率更快,生产效益更高 -
12、微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置,以葡萄糖为燃料的微生物燃料电池结构示意图如图1所示,并利用此电池为电源模拟电化学降解 , 其原理如图2所示。下列说法正确的是
 A、电池工作时,电流由A极经电解质溶液流向B极 B、电解过程中,阴极区溶液的pH不变 C、每生成 , 左右两侧溶液质量变化差7.2g D、理论上,图1中每生成 , 图2中生成的体积是8.96L
A、电池工作时,电流由A极经电解质溶液流向B极 B、电解过程中,阴极区溶液的pH不变 C、每生成 , 左右两侧溶液质量变化差7.2g D、理论上,图1中每生成 , 图2中生成的体积是8.96L -
13、我国科学家成功研发了甲烷和二氧化碳的共转化技术,助力“碳中和”目标。该催化反应历程如图所示:

已知部分化学键的键能数据如下:
共价键
键能
413
497
462
351
348
下列说法正确的是
A、该催化反应历程中没有非极性键的断裂和形成 B、催化剂的使用降低了该反应的活化能和焓变 C、总反应的原子利用率小于 D、该反应的热化学方程式为: -
14、常温下,下列说法正确的是A、将相同体积的pH=3盐酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性或酸性 B、浓度均为0.1mol/L的盐酸和醋酸分别加水稀释100倍,pH前者小 C、pH相等的盐酸和醋酸溶液等体积混合(混合液体积可视为两溶液体积之和),混合液中 D、相等的NH4Cl溶液和CH3COONH4溶液,物质的量浓度前者大
-
15、我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法不正确的是
 A、断电时,锌环能有效防止铁帽的腐蚀,该防护方法是牺牲阳极法 B、通电时,阴极上的电极反应式为: C、把锌环换成锡环后,断电时,仍能防止铁帽被腐蚀 D、断电时,正极上的电极反应式为:
A、断电时,锌环能有效防止铁帽的腐蚀,该防护方法是牺牲阳极法 B、通电时,阴极上的电极反应式为: C、把锌环换成锡环后,断电时,仍能防止铁帽被腐蚀 D、断电时,正极上的电极反应式为: -
16、乙酸乙酯一般通过乙酸和乙醇酯化合成:。关于该反应,下列说法不合理的是A、该反应的化学平衡常数表达式为: B、该化学方程式前后物质的化学计量数之和相等,但该反应的不等于零 C、因为该反应的接近于零,所以温度变化对平衡转化率的影响小 D、该反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
-
17、氨对发展农业有着重要意义,也是重要的化工原料。合成氨的生产流程示意如下。

下列说法不正确的是
A、控制原料气 , 是因为相对易得,适度过量可提高转化率 B、合成氨一般选择进行,铁触媒的活性最大,原料气平衡转化率高 C、热交换的目的是预热原料气,同时对合成的氨气进行降温利于液化分离 D、压缩机加压是为了保证尽可能高的平衡转化率和反应速率 -
18、在一定条件下,某密闭容器中发生反应: , 其他条件相同时,在甲、乙两种催化剂(催化剂活性不受压强影响)的作用下,反应相同时间,的转化率与温度的关系如图所示。下列说法不正确的是
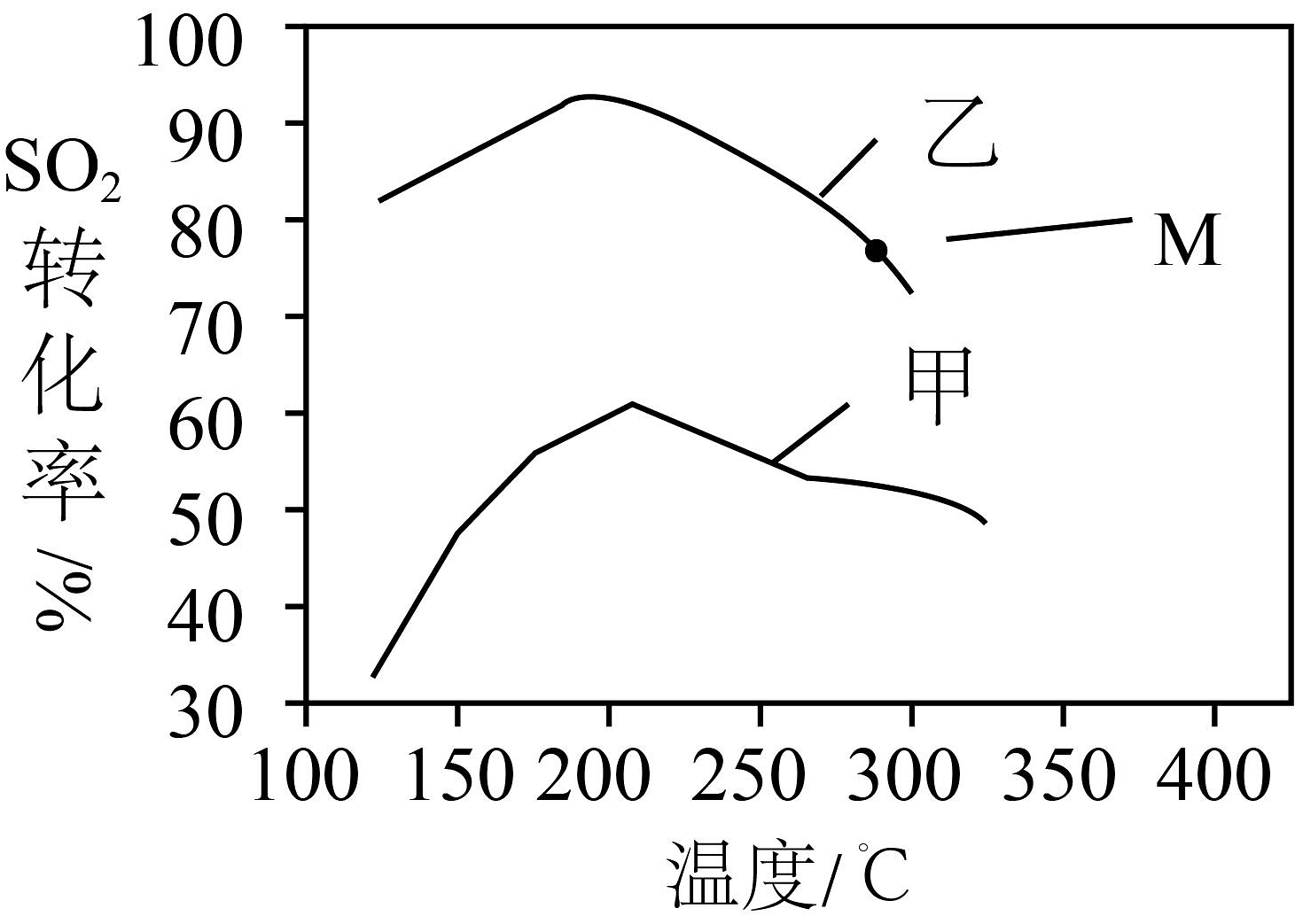 A、其他条件相同,该反应用乙作催化剂的催化效果比用甲好 B、其他条件相同,压缩容器体积,甲曲线可能整体向上移动 C、甲中约200℃后,转化率下降的原因可能为平衡向左移动 D、其他条件相同,压缩容器体积,M点的转化率一定增大
A、其他条件相同,该反应用乙作催化剂的催化效果比用甲好 B、其他条件相同,压缩容器体积,甲曲线可能整体向上移动 C、甲中约200℃后,转化率下降的原因可能为平衡向左移动 D、其他条件相同,压缩容器体积,M点的转化率一定增大 -
19、下列方程式书写正确的是A、的水解的离子方程式: B、氢氧化铝(一元弱酸)的酸式电离方程式: C、已知的燃烧热 , 表示其燃烧热的热化学方程式: D、表示稀醋酸和稀NaOH溶液中和反应热效应的方程式:
-
20、可逆反应: , 在一定条件下达到平衡,下列条件改变叙述正确的是A、增加A的量,平衡向正反应方向移动 B、降低温度的瞬间减小的程度小于 , 然后逐渐增大,继续减小,有利于反应正向进行 C、压缩体积使压强增大一倍,平衡不移动,平衡常数K不变,但均增大 D、增大B的浓度,平衡向正反应方向移动,B的转化率提高