相关试卷
-
1、下列关于仪器选择、实验操作及相关叙述均正确的是
 A、图甲用于测定中和反应反应热 B、图乙用于测定锌与稀硫酸反应速率(夹持装置省略) C、图丙操作可排出盛有溶液滴定管尖嘴内的气泡 D、图丁装置盐桥中阳离子向溶液中迁移
A、图甲用于测定中和反应反应热 B、图乙用于测定锌与稀硫酸反应速率(夹持装置省略) C、图丙操作可排出盛有溶液滴定管尖嘴内的气泡 D、图丁装置盐桥中阳离子向溶液中迁移 -
2、下列溶液一定呈中性的是A、滴加石蕊溶液显紫色 B、溶液中 C、的溶液 D、溶液中水电离出来的氢离子浓度为
-
3、下列物质中水溶液呈酸性的强电解质是A、 B、 C、 D、
-
4、工业上制取纯净的CuCl2·2H2O的主要过程是:①将粗氧化铜(含少量Fe)溶解于稀盐酸中,加热、过滤,调节滤液的pH为3;②对①所得滤液按下列步骤进行操作:

已知Cu2+、Fe2+在pH为4~5时不水解,而Fe3+却几乎完全水解而沉淀。请回答下列问题:
(1)、加X的目的是 , X可以是。其反应的离子方程式为。(2)、加Y 的目的是 , 生产中Y可选:。(3)、蒸发结晶时,直接在空气中加热蒸干溶液乙得不到CuCl2·2H2O晶体,原因是。可以采用减压低温蒸发结晶的方法,在蒸发过程中需不断通入气体,且不能蒸干。 -
5、
I.一定条件下,在体积为的密闭容器中,A、B、C三种气体的物质的量随时间的变化如图所示。已知达平衡后,降低温度,A的体积分数将减小。

(1)该反应的化学方程式为。
(2)该反应的反应速率随时间的关系如图所示:

①根据上图判断,在时刻改变的外界条件是。
②a、b、c三点中,C的体积分数最大的是。
③各阶段的平衡常数如下表所示:
、、之间的大小关系为(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的 , 发生反应 ,如图所示为气体分解生成和的平衡转化率与温度、压强的关系。

(3)(填“>”“<”或“=”)0。
(4)图中压强(、、)的大小顺序为。
(5)图中M点平衡常数。
-
6、白醋是烹调中的酸味辅料,能改善调节人体的新陈代谢,其主要成分为CH3COOH,为一元弱酸,回答下列问题:(1)、25℃时,pH=5的醋酸溶液中,由水电离出的c(H+)=mol·L-1(2)、已知CH3COOH的Ka=1.74×10-5 , NH3·H2O的Kb=1.74×10-5 , 则CH3COONH4的浓溶液呈(填“酸性”或“中性”或“碱性”);将CH3COONH4加入到Mg(OH)2悬浊液中,发现沉淀溶解,试解释原因:(用文字和方程式说明)。(3)、用如图所示装置测定Zn和4.0mol·L-1、2.0mol·L-1醋酸的反应速率:

①仪器a的名称为。
②Zn和醋酸溶液反应的离子方程式为。
③检查装置气密性的操作方法是。
④设计实验方案:在不同浓度醋酸溶液下,测定(要求所测得的数据能直观体现反应速率大小)。
-
7、在火箭推进器中装有强还原剂肼()和强氧化剂(),当它们混合时,即产生大量的和水蒸气,并放出大量热。已知液态肼和足量反应,生成氮气和水蒸气,放出的热量。(1)、写出该反应的热化学方程式(计算结果保留小数点后三位)(2)、已知 , 则液态肼燃烧生成氮气和液态水时,放出的热量是(计算结果保留小数点后一位)。(3)、上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是。(4)、已知 , , 根据盖斯定律写出肼与完全反应生成氮气和气态水的热化学方程式。(5)、肼()和是一种双组分火箭推进剂。两种物质混合发生反应生成和 , 已知气体肼在上述反应中放出热量,其热化学方程式为。(6)、的气态高能燃料乙硼烷()在氧气中燃烧,生成固态三氧化二硼和液态水,放出热量,其热化学反应方程式为;又知 , 则(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是(计算结果保留小数点后一位)。
-
8、20℃时向 20mL 0.1mol·L-1 醋酸溶液中不断滴入0.1mol·L-1 NaOH 溶液,溶液 pH 变化如图所示。此过程中溶液中离子浓度的关系错误的是
 A、a 点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) B、b 点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) C、c 点:c(H+)=c(CH3COO-)+c(OH-) D、d 点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
A、a 点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) B、b 点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) C、c 点:c(H+)=c(CH3COO-)+c(OH-) D、d 点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) -
9、在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )A、图
 表示的是t1时刻增大O2的浓度对反应速率的影响
B、图
表示的是t1时刻增大O2的浓度对反应速率的影响
B、图 表示的是t1时刻加入催化剂对反应速率的影响
C、图
表示的是t1时刻加入催化剂对反应速率的影响
C、图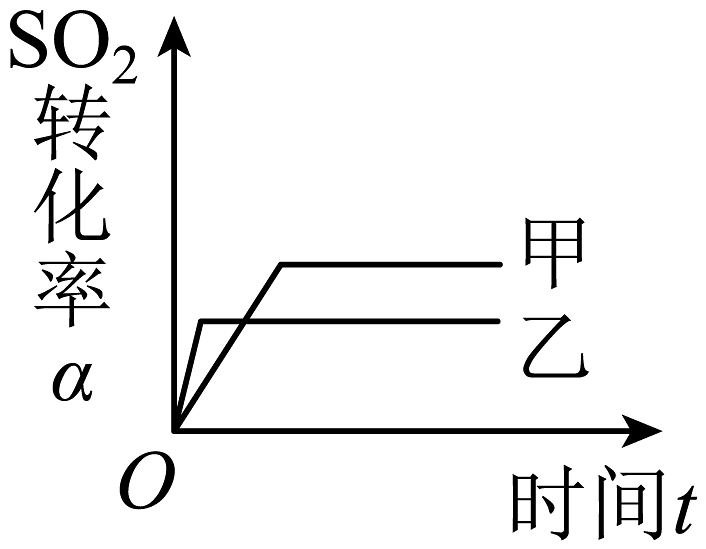 表示的是催化剂对平衡的影响,且甲的催化剂效率比乙高
D、图
表示的是催化剂对平衡的影响,且甲的催化剂效率比乙高
D、图 表示的是压强对化学平衡的影响,且乙的压强较高
表示的是压强对化学平衡的影响,且乙的压强较高
-
10、对于反应A2(g)+2B2 (g)
 2AB2(g) ΔH<0 ,下列各图所表示的变化符合勒夏特列原理的是 A、
2AB2(g) ΔH<0 ,下列各图所表示的变化符合勒夏特列原理的是 A、 B、
B、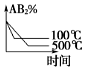 C、
C、 D、
D、
-
11、常温下,下列各组离子在溶液中能大量共存的是A、能与Al反应产生气体的溶液中:NH、K+、SO、Mg2+ B、Na+、K+、OH-、NO C、Fe3+、Na+、Cl-、I- D、Ca2+、HCO、Cl-、Al3+
-
12、向三份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2CO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为A、减小、增大、减小 B、增大、减小、减小 C、减小、增大、增大 D、增大、减小、增大
-
13、25℃时水的电离达到平衡:H2OH++OH- △H>0,下列叙述不正确的是A、将纯水加热,Kw增大,pH减小 B、向水中加入少量硫酸氢钠固体,增大 C、在蒸馏水中加少量小苏打,Kw不变,溶液中c(H+)增大 D、向水中滴入少量NaOH溶液,平衡逆向移动,c(H+)降低
-
14、相同温度下,根据三种酸的电离常数,下列判断正确的是
酸
HA
HB
HC
电离常数K
9×10-7
9×10-6
1×10-2
A、三种酸的酸性强弱关系:HA>HB>HC B、相同物质的量浓度的盐溶液NaA、NaB、NaC,NaC溶液的pH最大 C、反应HC+B-=HB+C-不能发生 D、当NaA、NaB、NaC三种溶液的pH相同时,NaA溶液的物质的量浓度最小 -
15、用标准浓度的NaOH溶液滴定未知浓度的盐酸时下列情况会使盐酸物质的量浓度偏低的是( )A、碱式滴定管用蒸馏水洗净后,直接注入标准浓度的NaOH溶液 B、碱式滴定管尖端有气泡,滴定后气泡消失 C、记录消耗的碱液,滴定前平视,滴定后俯视凹液面 D、锥形瓶用蒸馏水洗净后,直接装入未知浓度的盐酸
-
16、对于反应A(g) +2B(g)
 2C(g) ΔH﹤0 ,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是 A、
2C(g) ΔH﹤0 ,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是 A、 B、
B、 C、
C、 D、
D、
-
17、下列有关盐类水解的叙述正确的是A、溶液呈中性的盐一定是强酸、强碱反应生成的盐 B、含有弱酸根离子的盐的水溶液一定呈碱性 C、酸式盐由于可以电离出来 , 所以酸式盐溶液中的电离一定被抑制 D、盐溶液的酸碱性主要取决于形成盐的酸和碱的相对强弱
-
18、已知: , 若反应速率分别用、、、表示,则关系正确的是A、 B、 C、 D、
-
19、将条投入盛有稀的容器里,产生的速率与下列因素:①盐酸浓度、②温度、③镁条的表面积、④溶液中大小,有关系的是A、①②③ B、③④ C、①② D、①②③④
-
20、下列有关热化学方程式书写与对应表述均正确的是A、稀硫酸与溶液反应: B、在下的燃烧热 , 则水分解的热化学方程式为 C、已知的燃烧热 , 则有 D、已知硫粉与铁粉混合加热生成时放出热量,则