相关试卷
-
1、在实验室进行下列实验,实验现象或实验结论不合理的是
选项
实验操作
实验现象
实验结论
A
将氯水滴到试纸上
试纸变红
可以用试纸测定氯水的
B
向溶液中滴加溶液
溶液褪色,有气泡冒出
具有还原性
C
向盛有溶液的试管中滴加溶液,反应达到平衡后继续加入4滴溶液
溶液颜色变深
增大反应物浓度,平衡向正反应方向移动
D
向饱和溶液中加入过量酸
溶液中无明显气泡
相同温度下,
A、A B、B C、C D、D -
2、将和体积都相同的和溶液分别加蒸馏水稀释,随溶液体积的变化如图所示,已知25℃时 , , 下列叙述正确的是
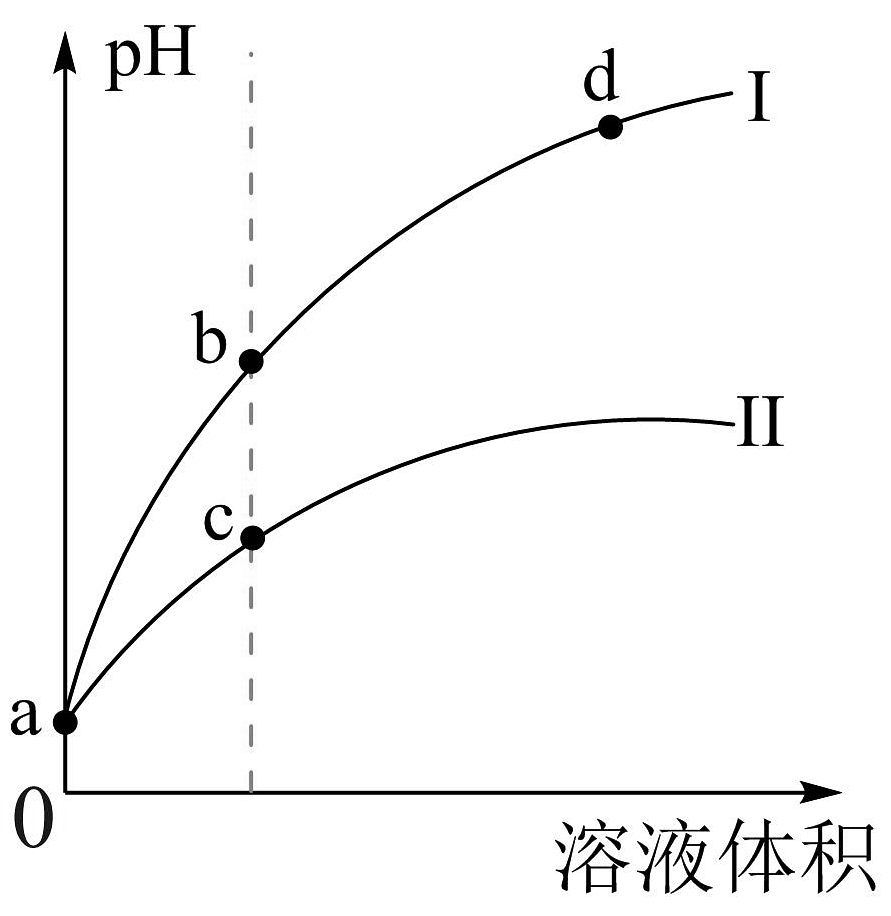 A、a点 B、曲线I为稀释时的变化曲线 C、b点溶液中水的电离程度比d点溶液中水的电离程度大 D、分别取点、点的两种酸溶液,中和相同体积、相同浓度的溶液,消耗点溶液体积较大
A、a点 B、曲线I为稀释时的变化曲线 C、b点溶液中水的电离程度比d点溶液中水的电离程度大 D、分别取点、点的两种酸溶液,中和相同体积、相同浓度的溶液,消耗点溶液体积较大 -
3、已知①
②
③
下列说法正确的是
A、反应③为表示的燃烧热的热化学方程式 B、 C、反应 D、反应 -
4、次氯酸溶液中存在电离平衡: , 下列叙述不正确的是A、的溶液加水稀释10倍, B、降低温度,平衡逆向移动,次氯酸的电离常数减小 C、加入固体,溶液中的值增大 D、欲使次氯酸溶液的、电离程度都减小,可加入次氯酸溶液
-
5、下列装置能达到实验目的的是
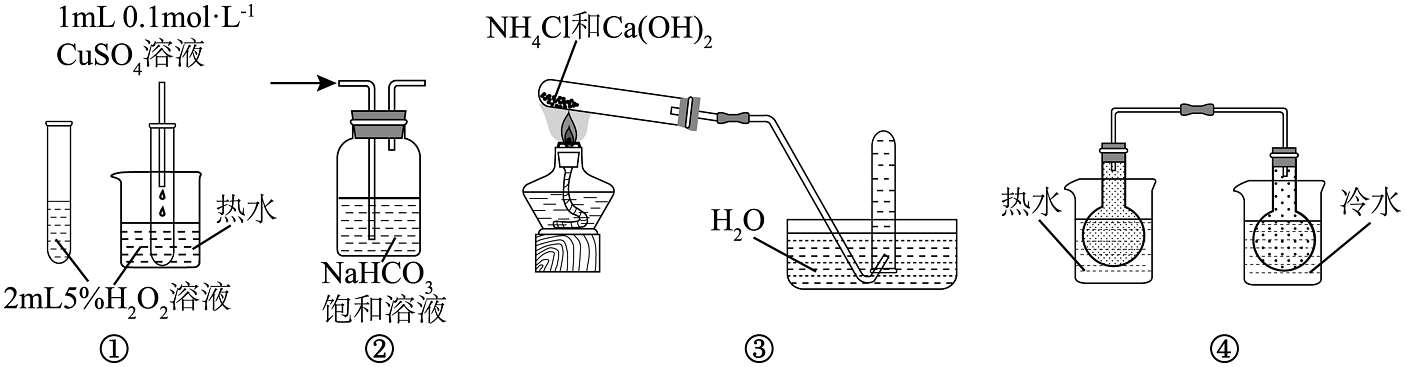 A、图①装置用于验证对分解反应有催化作用 B、图②装置用于除去中 C、图③装置实验室制取氨气 D、图④装置用于探究温度对平衡的影响
A、图①装置用于验证对分解反应有催化作用 B、图②装置用于除去中 C、图③装置实验室制取氨气 D、图④装置用于探究温度对平衡的影响 -
6、下列叙述正确的是A、若将含HCl的稀盐酸与含的稀溶液混合,放出的热量小于 B、 , 则金刚石比石墨稳定 C、非自发的反应不能通过改变条件使其成为自发反应 D、对于平衡体系 , 缩小体积,颜色加深,此现象符合勒夏特列原理
-
7、对已经达到化学平衡的反应 , 温度升高,对反应产生的影响是A、正、逆反应速率都减小,平衡向正反应方向移动 B、正、逆反应速率都增大,平衡向逆反应方向移动 C、逆反应速率增大,正反应速率减小,平衡向正反应方向移动 D、逆反应速率减小,正反应速率增大,平衡向逆反应方向移动
-
8、反应过程中能量变化如图所示(图中表示正反应的活化能,表示逆反应的活化能),下列有关叙述正确的是
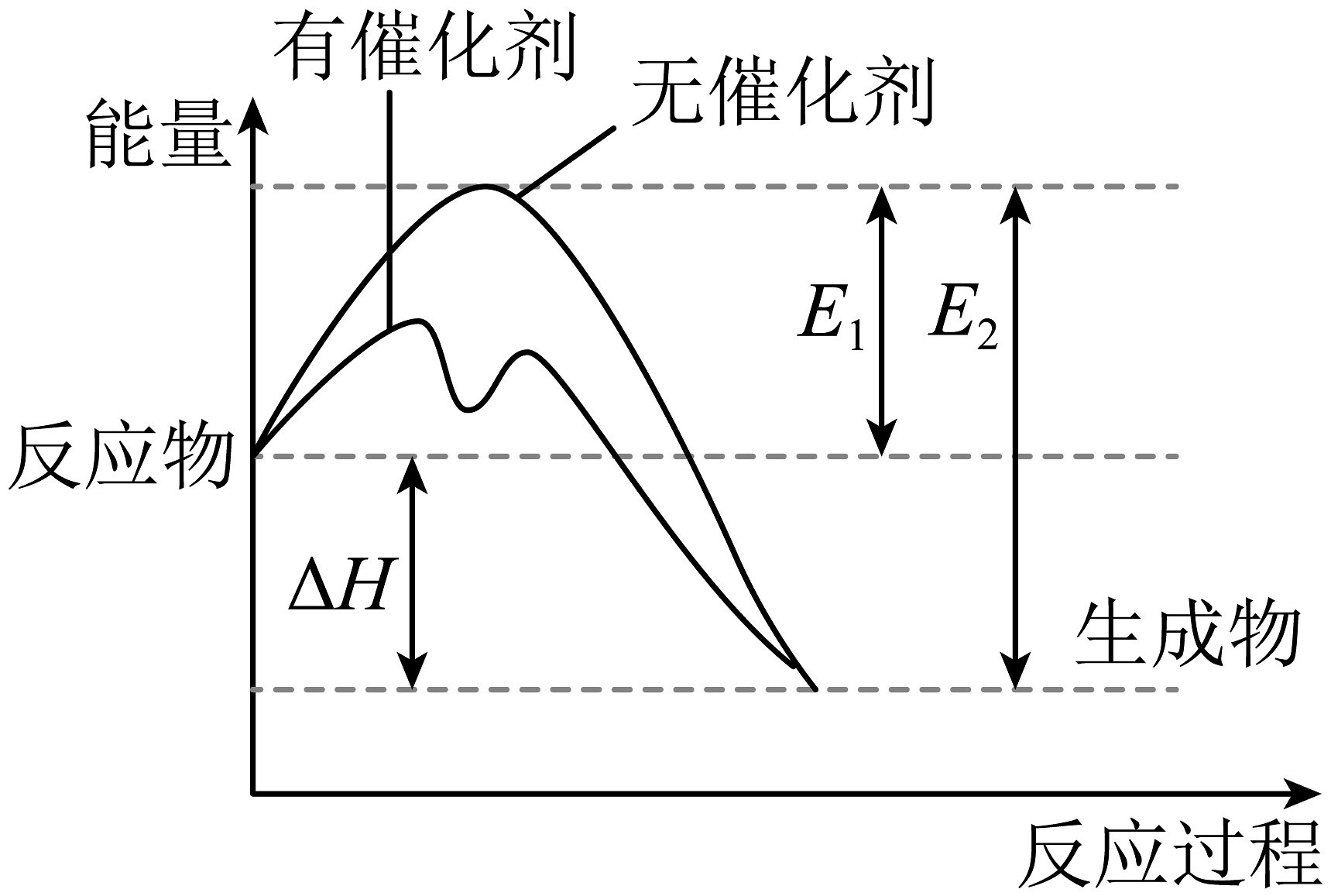 A、的能量比的能量高 B、若 , 则和充分反应放出的热量一定等于 C、 D、有催化剂的两步反应中,第二步为该反应的决速步
A、的能量比的能量高 B、若 , 则和充分反应放出的热量一定等于 C、 D、有催化剂的两步反应中,第二步为该反应的决速步 -
9、关于反应 , 下列说法不正确的是A、是氧化剂 B、氧化产物和还原产物的物质的量之比是 C、每生成 , 转移电子数为 D、还原性:
-
10、科学家研制出新型催化剂,在该催化剂表面可以实现利用太阳光高效分解水,其主要过程如图所示。下列说法不正确的是
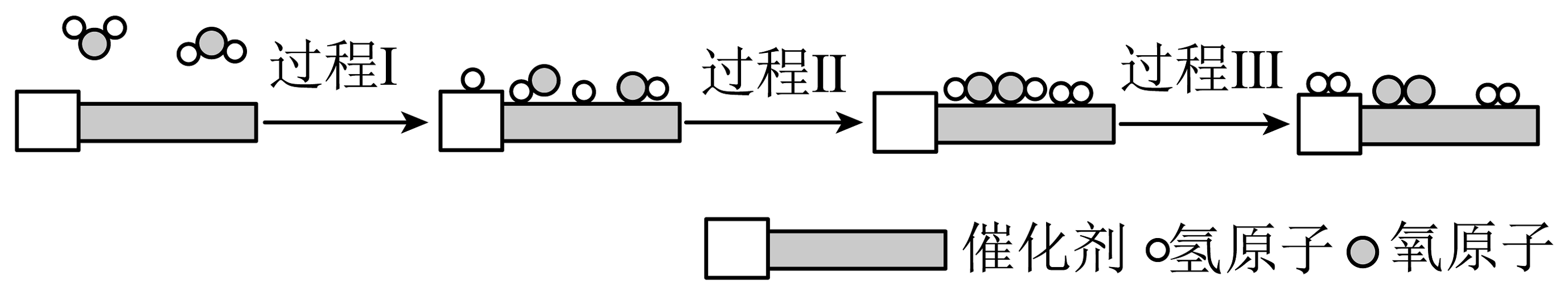 A、使用催化剂降低了总反应的焓变 B、过程I破坏了键,需要吸收能量 C、过程Ⅲ有化学键的断裂和形成 D、总反应的
A、使用催化剂降低了总反应的焓变 B、过程I破坏了键,需要吸收能量 C、过程Ⅲ有化学键的断裂和形成 D、总反应的 -
11、下列离子方程式不正确的是A、和盐酸: B、钠和水反应: C、通入碳酸钠溶液: D、氢氧化钠溶液中加入片:
-
12、下列属于非自发过程的是A、水由高处向低处流 B、蔗糖在水中溶解 C、天然气的燃烧 D、室温下水结成冰
-
13、下列反应属于放热反应的是A、硝酸铵溶于水 B、的电离 C、和水反应 D、和盐酸
-
14、物质的性质决定用途,下列两者对应关系正确的是A、单质 质地较软,可用于冶炼金属钛 B、浓硫酸具有吸水性,可用于干燥 C、溶液显黄色,可用于印刷电路板的制作 D、极易溶于水,可用于制冷剂
-
15、下列化学用语不正确的是A、的结构示意图:
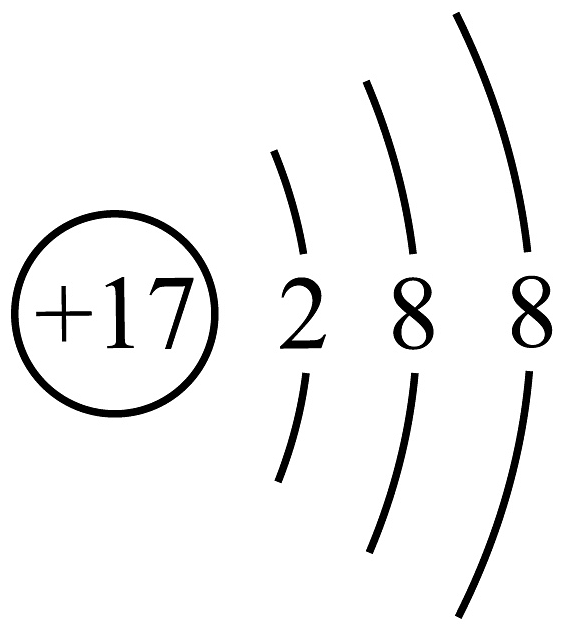 B、的电子式:
B、的电子式: C、的空间构型是形
D、的电离方程式为
C、的空间构型是形
D、的电离方程式为
-
16、下列物质属于弱电解质的是A、 B、 C、盐酸 D、
-
17、某固体粉末由、组成,为探究各组分含量,将其分成质量相等的两份进行实验。
实验1:一份加热至恒重,称得固体质量为15.9g。
实验2:向另一份滴加足量盐酸,充分反应后,得到5.6L(标准状况下)CO2(不考虑过程中CO2的损失)。
下列说法正确的是
A、原固体粉末的质量是22.1g B、实验1中生成的CO2的质量为8.8g C、实验2中,至少需要盐酸 D、实验2中,当加入盐酸时,溶液中只有一种溶质 -
18、下列实验装置合理或操作规范且能达到实验目的的是
 A、甲:检验Cl2是否有漂白性 B、乙:制备胶体 C、丙:验证碳酸氢钠的热稳定性 D、丁:配制一定浓度的溶液时的定容操作
A、甲:检验Cl2是否有漂白性 B、乙:制备胶体 C、丙:验证碳酸氢钠的热稳定性 D、丁:配制一定浓度的溶液时的定容操作 -
19、现有Cl2、He、O3三种气体,它们含有的原子数相同,则三种气体的物质的量之比为A、2:1:3 B、1:2:1 C、3:6:2 D、1:1:1
-
20、营养液是无土栽培的核心和关键,某营养液中含有表中四种离子(忽略微量离子),该营养液中R离子及其物质的量浓度可能是
离子种类
R离子
浓度/
_______
0.03
0.03
0.01
A、H+、0.01 mol∙L-1 B、K+、0.02 mol∙L-1 C、Ba2+、0.01 mol∙L-1 D、、0.01 mol∙L-1