相关试卷
-
1、下列说法不正确的是


A.表示氧化性物质
B.用pH计测定溶液的pH

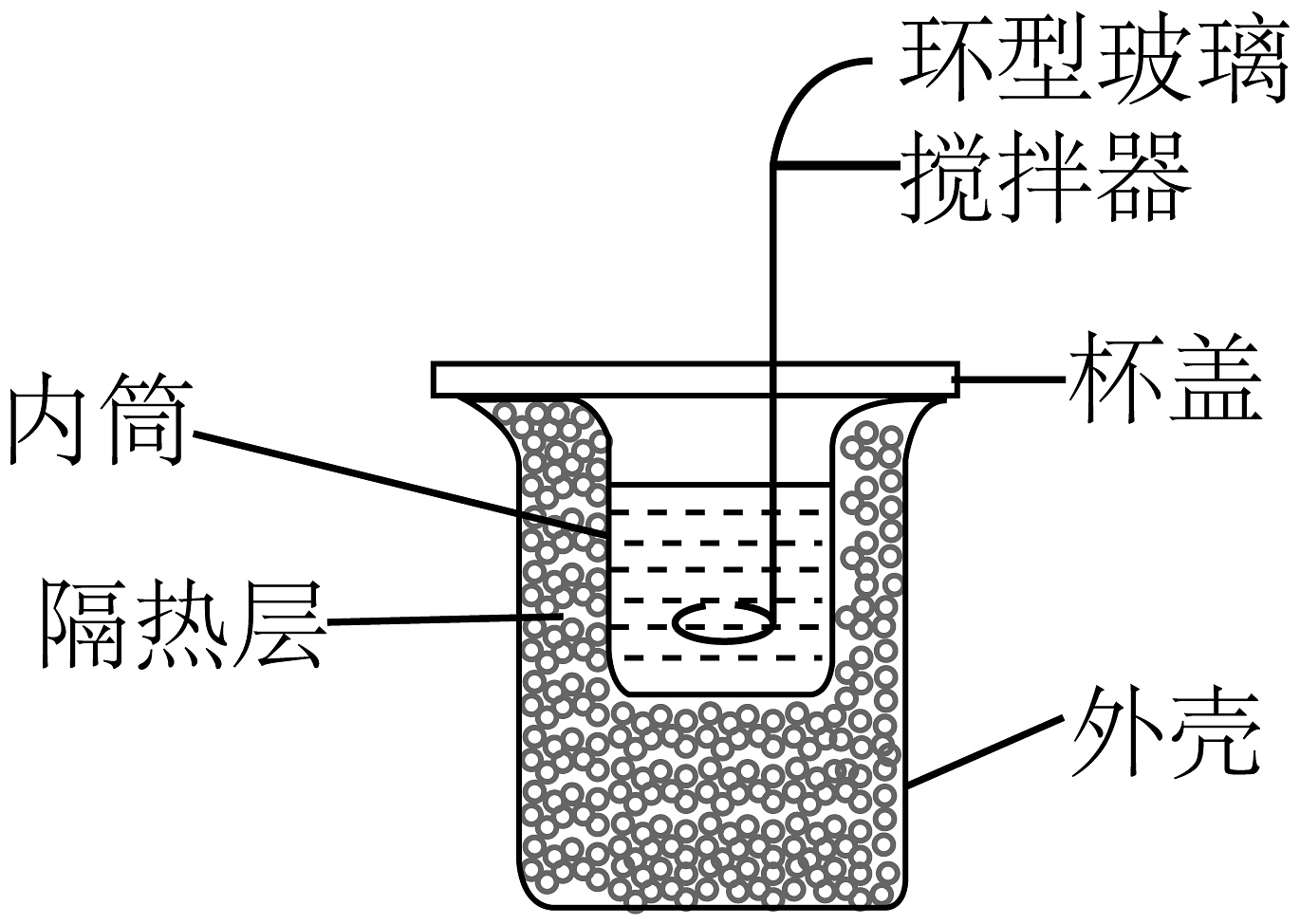
C.可用于铜丝与浓硝酸反应并吸收尾气
D.可用于测定中和反应的反应热
A、A B、B C、C D、D -
2、下列表示正确的是A、的结构示意图:
 B、乙酸的结构式:
C、的空间填充模型:
B、乙酸的结构式:
C、的空间填充模型: D、NaCl溶液中的水合离子:
D、NaCl溶液中的水合离子:
-
3、下列说法不正确的是A、石灰乳具有碱性,可用于除去废气中的二氧化硫 B、铝具有强还原性,可用于制作门窗框架 C、具有氧化性,可用于腐蚀印刷电路板上的Cu D、利用的还原性,可从海水中制取溴
-
4、下列化合物属于弱电解质的是A、 B、HCl C、 D、
-
5、烃A是一种重要的化工原料,还是一种果实催熟剂,标准状况下密度为 , 其中含碳85.7%(质量分数)。E是有香味的不易溶于水的油状液体。有关物质转化关系如下:
 (1)、A的分子式 , A→B的反应类型 , 有机化合物D中含有的官能团名称是。(2)、写出反应①的化学方程式:。(3)、下列说法不正确的是___________(填字母)。A、A、D、E均能发生加聚反应生成高分子化合物 B、实验室鉴别B、D和E三种物质可用饱和碳酸钠溶液 C、A能使溴水、酸性高锰酸钾溶液褪色,两者褪色原理相同 D、石油分馏产品在催化剂作用下加热制A的过程称为催化裂化
(1)、A的分子式 , A→B的反应类型 , 有机化合物D中含有的官能团名称是。(2)、写出反应①的化学方程式:。(3)、下列说法不正确的是___________(填字母)。A、A、D、E均能发生加聚反应生成高分子化合物 B、实验室鉴别B、D和E三种物质可用饱和碳酸钠溶液 C、A能使溴水、酸性高锰酸钾溶液褪色,两者褪色原理相同 D、石油分馏产品在催化剂作用下加热制A的过程称为催化裂化 -
6、常温下,有浓度均为的氨水和溶液、均为1的和四种溶液。(1)、为精确测定的氨水的 , 最好选择___________。A、紫色石蕊试液 B、精密试纸 C、酸度计 D、酚酞试液(2)、为证明是一种弱碱,有同学设计了下列方案,其中不合理的是___________。A、相同条件下,取的氨水和溶液进行导电性实验,氨水的导电性弱 B、向滴有酚酞的的氨水中逐滴加入溶液,溶液红色变浅,说明是一种弱碱,抑制了的电离 C、取等体积浓度均为的氨水和溶液,分别用的盐酸完全中和,氨水所需盐酸的体积较小 D、实验测得的氨水(3)、有同学认为是一种强电解质,在水溶液中不存在电离平衡,改变温度不影响的电离,故的溶液在常温和80℃时的相同。你认为该同学的说法是否正确,并说明理由。(4)、某兴趣小组欲利用下图装置、计时器及相关实验用品,探究相同规格的与均为1的盐酸和溶液反应产生的速率大小。

①该实验成功的关键是装置的气密性好。检查该装置气密性的正确操作是:如图搭建好装置,关闭分液漏斗的旋塞,将针筒的活塞往里推进一定距离,若 , 则装置气密性好。
②相同条件下,称取等质量的两份粒,分别与等体积、足量的上述盐酸和反应。收集到等量的所需时间更长。
-
7、的回收和综合利用有利于实现“碳中和”。在催化剂作用下,、同时发生如下反应:
反应I:
反应II:
请回答:
(1)、反应I能自发进行的条件是(填“高温”、“低温”或“任意温度”)。(2)、工业上可以利用和反应生产 , 反应如下: , 结合上述信息可知,该反应的 , 平衡常数(用“、”表示)。(3)、在恒温、10L的密闭容器中加入和发生反应I和II,的物质的量随时间变化如图所示。
①的平衡转化率为。
②若反应达到平衡后测得: , , 则反应II的化学平衡常数。
(4)、若和按一定比例在装有催化剂的反应器中发生反应I、II,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如下图所示。490K之后甲醇产率下降,其变化的原因是。
-
8、常温下,已知下列三种酸的电离平衡常数如下:
化学式
电离平衡常数(K)
(1)、写出醋酸的电离方程式。(2)、、、三种微粒结合能力由大到小的顺序是。(3)、写出下列反应的化学方程式:①过量通入少量溶液中。
②少量通入过量溶液中。
(4)、试计算:溶液中的浓度,。(已知:) -
9、请按要求填空。(1)、请写出氨气的结构式 , 氮气分子的电子式。(2)、已知气态分子中断裂化学键所需的能量称为键能(单位)。请比较、、三种物质的键能(、、)由大到小的顺序是。(3)、已知: 、 , 且 , 请从原子结构角度分析的原因。(4)、已知键能数据:
化学键
键能
243
431
328
414
写出与反应生成一氯甲烷()的热化学方程式。
-
10、下列实验能达到目的的是
选项
实验目的
实验方法或操作
A
探究反应物浓度对化学反应速率的影响
A、B两试管中分别加入酸性溶液,再向a中加入溶液,向b试管中加入溶液和蒸馏水,记录两试管中溶液褪色所需时间。
B
探究对分解速率的影响
向2支试管中各加入溶液,再向其中一支试管中加入溶液,比较两支试管中气泡产生速率。
C
探究增大反应物浓度对下列化学平衡的影响:
取橙黄色的混合溶液分别置于2支试管中,向其中一支试管中加入蒸馏水,比较两支试管的颜色。
D
探究压强对化学平衡的影响
 , 保持温度不变,推进活塞,压缩图示平衡混合气体,观察气体颜色变化。A、A B、B C、C D、D
, 保持温度不变,推进活塞,压缩图示平衡混合气体,观察气体颜色变化。A、A B、B C、C D、D -
11、根据下列图示所得出的结论不正确的是
 A、图甲是镁条与盐酸反应的速率随时间变化曲线,说明时刻溶液的温度最高 B、图乙是某容器中充入一定量和合成氨,测得的平衡产率随温度和压强的变化关系图,可知温度: C、图丙是恒温密闭容器中发生反应时,随反应时间变化的曲线,时刻改变的条件可能是缩小容器的体积 D、图丁是的平衡浓度随温度变化的曲线,说明平衡常数
A、图甲是镁条与盐酸反应的速率随时间变化曲线,说明时刻溶液的温度最高 B、图乙是某容器中充入一定量和合成氨,测得的平衡产率随温度和压强的变化关系图,可知温度: C、图丙是恒温密闭容器中发生反应时,随反应时间变化的曲线,时刻改变的条件可能是缩小容器的体积 D、图丁是的平衡浓度随温度变化的曲线,说明平衡常数 -
12、氨对发展农业有着重要意义,也是重要的化工原料。合成氨的生产流程示意图如下。

下列有关合成氨说法不正确的是
A、控制原料气 , 是因为相对易得,适度过量利于提高转化率 B、从合成氨的平衡体系中分理出 , 可提高正反应速率,减小逆反应速率,平衡正移 C、热交换的目的是充分利用反应热预热原料气,同时有利于氨气的液化分离 D、原料气的干燥、净化可防止催化剂中毒失效 -
13、下列实验事实不能用勒夏特列原理解释的是A、硫酸工业将催化氧化成的反应,选择常压比高压更经济 B、加压可以提高在水中的溶解度 C、已知反应:将该平衡体系浸入冷水中颜色变浅 D、工业制取金属钾 , 使K变成蒸气从混合体系中分离
-
14、常温下,下列溶液碱性最强的是A、的溶液 B、的溶液 C、将的氨水稀释成后所得溶液 D、的盐酸与的溶液按体积比1:9混合反应后所得溶液
-
15、反应:的能量变化如图所示,下列说法不正确的是
 A、升高温度,能同时加快正逆反应速率,且对逆反应速率影响更大 B、曲线b为使用催化剂的反应历程,其中W是该反应体系中最不稳定的物质 C、的逆反应活化能大于正反应活化能,该反应为放热反应 D、压缩容器体积增大体系压强,可提高活化分子百分数,加快反应速率,但不影响X的平衡转化率
A、升高温度,能同时加快正逆反应速率,且对逆反应速率影响更大 B、曲线b为使用催化剂的反应历程,其中W是该反应体系中最不稳定的物质 C、的逆反应活化能大于正反应活化能,该反应为放热反应 D、压缩容器体积增大体系压强,可提高活化分子百分数,加快反应速率,但不影响X的平衡转化率 -
16、相同条件下,下列比较不正确的是A、焓(H)的大小关系: B、熵(S)的大小关系: C、溶液中水的电离程度: D、等质量S分别在纯氧和空气中完全燃烧放出的能量:两者相等
-
17、下列热化学方程式正确的是A、已知1 g甲烷燃烧生成二氧化碳和液态水放出的热量为55.625 kJ: B、已知充分燃烧V L乙烯气体生成1 mol二氧化碳气体和液态水,放出b kJ热量: C、通常状况下,将1 g氢气在氯气中完全燃烧,放出92.4 kJ热量: D、12 g碳与适量水蒸气反应生成一氧化碳和氢气,需吸收120 kJ的热量:
-
18、黑火药爆炸时的反应为: , 有关该反应的说法正确的是A、爆炸反应产生大量气体并放出巨大的能量,可推知该反应逆方向任意温度不能自发进行 B、可以氧化C C、每产生标准状况下气体,则反应转移电子数为 D、该反应的还原产物是 , 氧化产物是
-
19、W、X、Y、Z为原子序数依次增大的短周期主族元素。W和Y同族,Y的原子序数是W的2倍,X是地壳中含量最多的金属元素。下列说法不正确的是A、Y、Z的氧化物对应的水化物均为强酸 B、X与Y可形成化合物 C、非金属性: D、可用于自来水杀菌消毒
-
20、下列反应属于吸热反应的是A、锌粒与稀H2SO4反应制取H2 B、Na2CO3+10H2O=Na2CO3·10H2O C、植物通过光合作用将CO2转化为葡萄糖 D、葡萄糖在人体内氧化分解