相关试卷
-
1、、、、这些物质自身或物质之间在一定条件下发生的化学反应中,不涉及的反应类型为A、化合反应 B、分解反应 C、置换反应 D、复分解反应
-
2、化学与生活密切相关,下列过程或现象与氧化还原反应有关的是


A.天然气的燃烧
B.制作糕点时,加入的发生分解


C.清晨树林间光亮的“通路”
D.铁杵磨成针
A、A B、B C、C D、D -
3、配制0.1mol/L的NaOH溶液,如图所示装置和描述均正确的是
 A、用图①装置称量一定质量的NaOH固体 B、用图②溶解NaOH固体 C、转移洗涤后用图③装置定容 D、定容完成后摇匀如图④所示
A、用图①装置称量一定质量的NaOH固体 B、用图②溶解NaOH固体 C、转移洗涤后用图③装置定容 D、定容完成后摇匀如图④所示 -
4、二甲双酮是一种抗惊厥药,以丙烯为起始原料的合成路线如下:
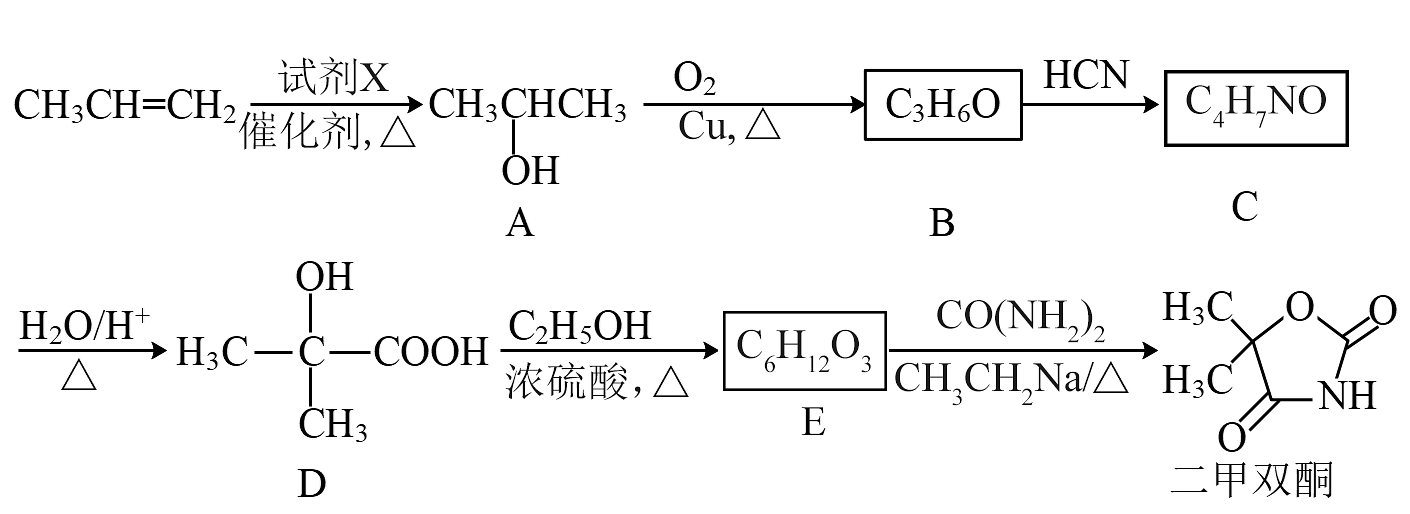
已知:
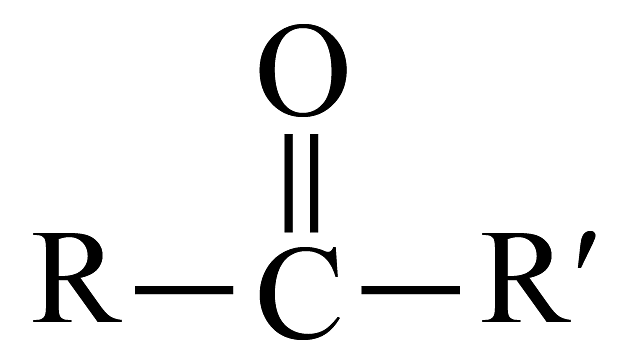
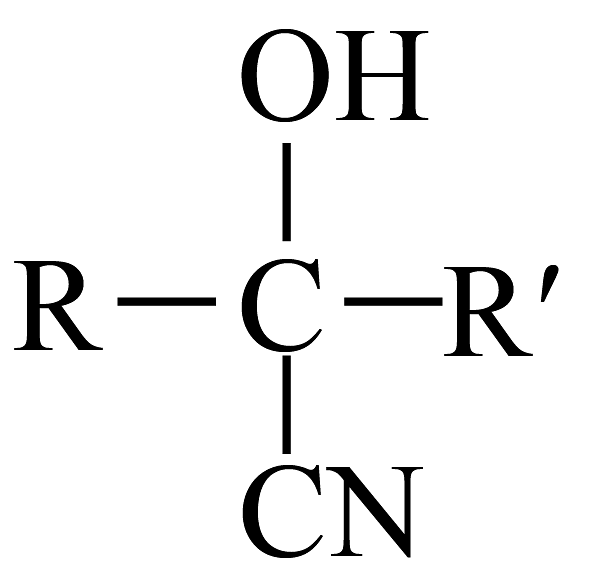 。回答下列问题:(1)、A的官能团名称是 , C的结构简式为。(2)、下列说法不正确的是___________。A、丙烯分子中3个碳原子共直线 B、试剂X是 C、E能发生水解、氧化、加成反应 D、二甲双酮的分子式为(3)、写出的化学方程式。(4)、参考上述合成路线图,设计以乙烯为原料合成乳酸(
。回答下列问题:(1)、A的官能团名称是 , C的结构简式为。(2)、下列说法不正确的是___________。A、丙烯分子中3个碳原子共直线 B、试剂X是 C、E能发生水解、氧化、加成反应 D、二甲双酮的分子式为(3)、写出的化学方程式。(4)、参考上述合成路线图,设计以乙烯为原料合成乳酸( )的路线(用流程图表示,无机试剂任选)。
)的路线(用流程图表示,无机试剂任选)。 -
5、
邻苯二甲酸氢钾(简写为KHA,其摩尔质量为)是一种性质稳定的酸式盐,滴定分析中常用于标定易变质的碱溶液的浓度。
I.溶液配制
(1)用烧碱配制的NaOH溶液,所需要的玻璃仪器除试剂瓶、玻璃棒、烧杯、量筒外还需要________、________。
(2)烧碱在储存取用过程中容易潮解变质,使得所配溶液的浓度________(填“偏大”、“偏小”或“无影响”)。
Ⅱ.浓度测定
用KHA标定NaOH溶液的主要步骤如下:
a.精确称取邻苯二甲酸氢钾
b.加入滴指示剂
c.用NaOH溶液滴定至终点,记录读数
d.往锥形瓶中加入固体
e.往锥形瓶中加入新煮沸放冷的蒸馏水
(3)正确的操作排序为:a→________(每步限用1次)→重复实验两次,并记录相关数据。
(4)滴定接近终点时,向锥形瓶中滴入半滴溶液的操作为___________(填序号)。
A. 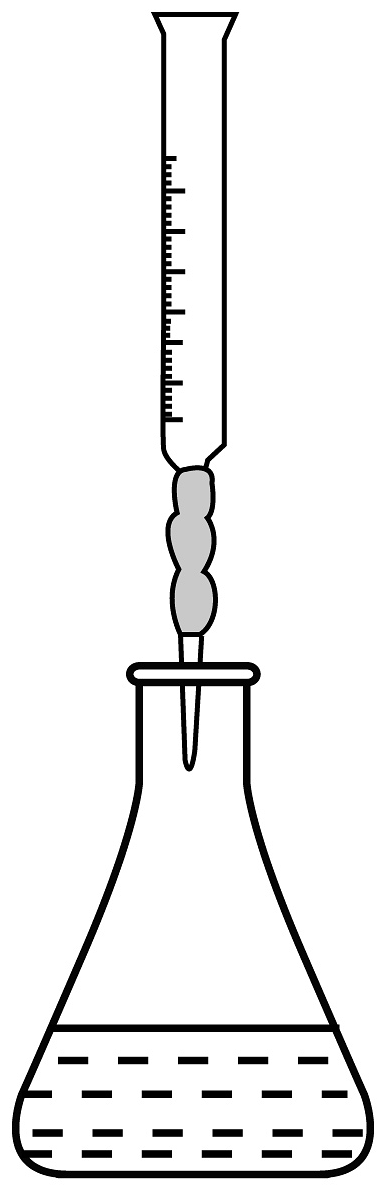
B. 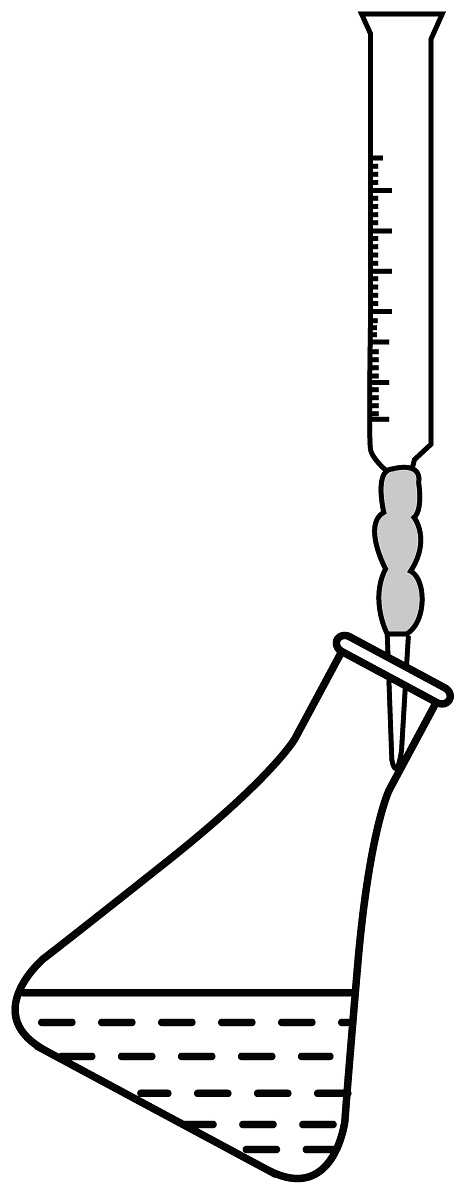
C. 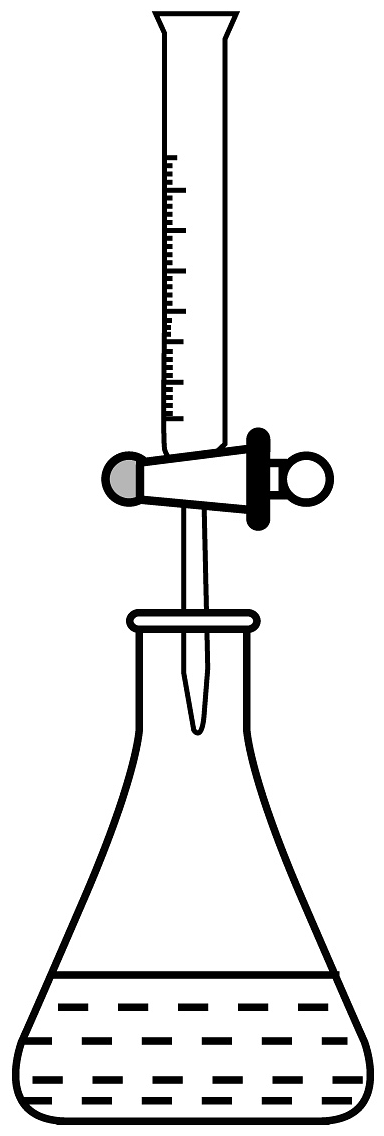
D. 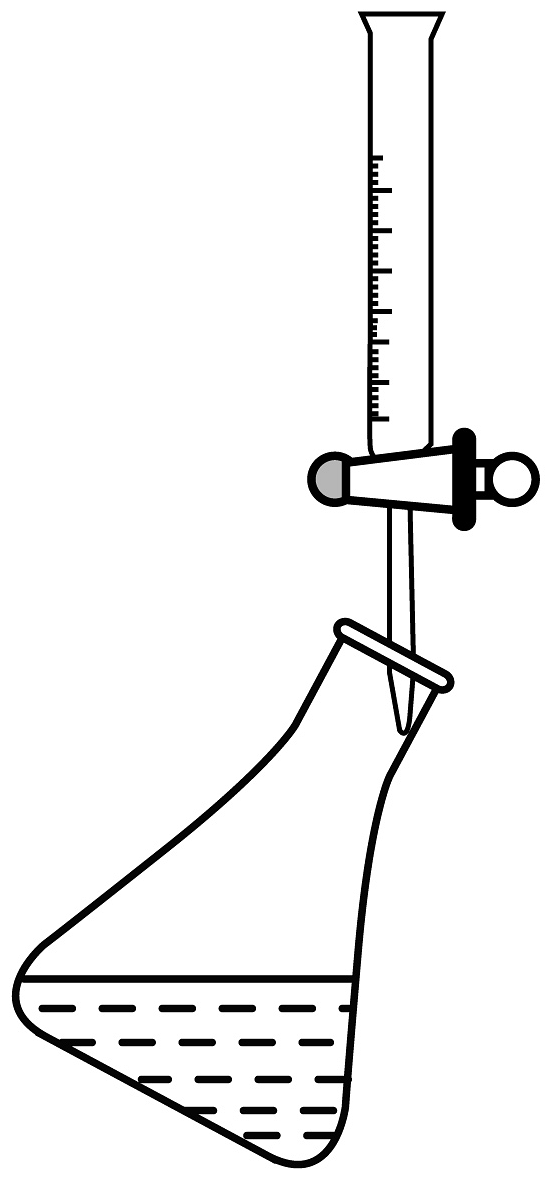
(5)本实验选择酚酞作指示剂,判断滴定到达终点的实验现象为________。
(6)若标定过程中消耗NaOH溶液的平均体积为 , 则NaOH溶液浓度的表达式为:________(用m、M、V表示)。
(7)下列操作会使得NaOH溶液浓度偏低的是___________(填字母)。
A. 滴定前有气泡,滴定结束时气泡消失 B. 滴定管未用NaOH溶液润洗 C. 滴定前仰视读数,结束时俯视读数 D. 锥形瓶未干燥 -
6、
黄铁矿(主要成分为二硫化亚铁)是重要的含硫矿物,常用于生产硫酸或硫磺。
I.《天工开物》中记载,将黄铁矿、木炭和适量空气混合加热可得硫磺,反应如下:
反应i:
(1)该反应自发进行的条件为___________。
A. 高温 B. 低温 C. 任意温度 D. 不自发 (2)对于此反应的说法正确的是___________。
A. 加热的作用主要是使硫单质以气态存在 B. 加入木炭,可与反应供能 C. 为保持足够的反应温度,需鼓入过量空气 D. 此反应条件下,稳定性高于 Ⅱ.反应i所得气体经冷凝回收后,尾气中还含有CO和。将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
反应ii:
反应iii:
理论分析及实验结果表明,600~1000K范围内,平衡转化率接近。其他条件相同,不同温度下,、COS平衡产率和10min时产率如图。

(3)10min时,的产率高于平衡产率,说明反应ii的活化能________(填“>”或“<”)反应iii。
(4)600~1000K范围内,温度升高,的平衡产率增大,分析其原因。________。
(5)1000K下,的产率在10min达最大值,在下图中画出产率在0-40min内随时间变化的曲线________。

Ⅲ.将一定量硫蒸气冷却至473K,发生反应 , 达到平衡时,的分压 , 的分压。
(6)该反应在473K时的平衡常数(用各物质的分压表示)为________。
-
7、已知常温下四种弱酸的电离常数如下表,回答下列问题:
酸
HClO
HCN
HCOOH
电离常数
(1)、上述四种酸中酸性最弱的酸的电离方程式为。(2)、下列方法可以增大溶液的电离程度的是___________。A、加热 B、加入少量甲酸钠固体 C、滴加几滴浓NaOH溶液 D、加入盐酸(3)、向NaClO溶液中通入少量 , 发生反应的离子方程式为。(4)、常温下,溶液中。(5)、常温下,某和的混合溶液的 , 则。 -
8、X、Y、Z、M、G为原子序数依次增大的短周期主族元素,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成、两种分子。
请回答下列问题:
(1)、M在元素周期表中的位置为。(2)、上述元素的最高价氧化物对应的水化物中酸性最强的是(写化学式)。(3)、的电子式为。(4)、已知1g固体单质M完全燃烧放出9kJ的热量,写出固体M燃烧的热化学方程式:。(5)、某种固体氧化物燃料电池的结构示意图如下,写出其负极的电极反应式。该电池以4.8A恒定电流工作50min,消耗体积为2.45L,计算该电池将化学能转化为电能的转化率:。[已知:该条件下气体摩尔体积为;电荷量电流时间;;]
-
9、为探究速率、平衡移动的影响因素,设计方案并进行实验,观察到相关现象。其中方案设计和结论都正确的是
选项
因素
方案设计
现象
结论
A
浓度
分别测量和的醋酸溶液的pH
前者是2.9,后者是3.4
稀释溶液时电离平衡逆向移动
B
压强
注射器先充满气体,然后往里推活塞压缩体积
气体颜色最终加深
增大压强,平衡向生成的方向移动
C
温度
取2支试管,均加入溶液,分别放入冷水和热水中,稍后同时加入硫酸
热水中先出现浑浊
升高温度,反应速率加快
D
催化剂
取2支试管,均加入1mL乙酸乙酯,再分别加入1mL水、稀硫酸,加热
加酸的酯层消失快
合适的催化剂能使平衡正向移动
A、A B、B C、C D、D -
10、下列叙述不正确的是A、25℃时,溶液比等浓度的溶液的导电能力强 B、90℃时,纯水的 , 说明加热可导致水呈酸性 C、25℃时,的醋酸溶液与的氢氧化钠溶液等体积混合后 D、25℃时,pH均为3的醋酸溶液和盐酸等体积混合后pH仍为3
-
11、乙烯在溴水中发生加成反应的机理如图所示:

实验显示,在饱和溴水中反应时,产物A和B的比例约为1:9。下列说法不正确的是
A、若在的溶液中反应,产物仅有A B、该反应不可逆,产物的比例主要由第②和第③步反应的速率大小决定 C、降低溴的浓度,产物中B的比例可能升高 D、该实验说明第②步反应的活化能比第③步大 -
12、常温下,烧瓶中存有氯气和氯水,相关平衡及平衡常数为:
①
②
③
下列说法不合理的是
 A、抽出氯气,氯水中的浓度会减小 B、氯水中, C、反应①的平衡常数可表示为[表示氯气的压强] D、在水中的溶解度(以物质的量浓度表示)
A、抽出氯气,氯水中的浓度会减小 B、氯水中, C、反应①的平衡常数可表示为[表示氯气的压强] D、在水中的溶解度(以物质的量浓度表示) -
13、一定条件下,将2molX和1molY充入到2L恒温恒容的密闭容器中进行反应: , 反应到5min时,测得生成的Z为1.2mol,下列说法正确的是A、第5min时,反应放出的热量为QkJ B、5min内,Y的平均反应速率为 C、第5min时,X的反应速率小于 D、当体系的压强不再变化时,说明反应已达到平衡状态
-
14、下列关于如下图所示转化关系(X代表卤素)的说法中正确的是
 A、 B、按照、、的顺序,依次增大 C、越小,则HX就越稳定 D、越小,则X的非金属越弱
A、 B、按照、、的顺序,依次增大 C、越小,则HX就越稳定 D、越小,则X的非金属越弱 -
15、下列说法正确的是A、糖类、油脂、蛋白质都是高分子化合物 B、石油的分馏、煤的气化和液化都是物理变化 C、游泳池常用硫酸铜溶液做消毒剂,是利用了蛋白质的变性原理 D、在淀粉水解后的溶液中加入少量新制氢氧化铜,加热,若没有砖红色沉淀产生则说明淀粉没有发生水解
-
16、下列离子方程式正确的是A、将一小粒钠投入溶液中: B、溶液中滴加溶液: C、铅酸蓄电池工作时: D、溶液与过量澄清石灰水反应:
-
17、工业上用和合成代表阿优加德罗常数的值,下列说法正确的是A、消耗 , 生成分子数为 B、生成 , 电子转移数为 C、消耗的同时断裂个键,说明反应已达到平衡状态 D、用氨气催化还原技术脱除氮氧化物,含的废气至少需消耗分子数为
-
18、下列应用活动对应的化学知识不正确的是
选项
应用活动
化学知识
A
水处理:用消毒自来水
具有强氧化性
B
水质检验:用沉淀滴定法测水中含量
C
实验检验:判断是否失效
D
材料加工:聚氯乙烯树脂中加入增塑剂
增塑剂能提高塑料的硬度
A、A B、B C、C D、D -
19、用如下反应制备:(方程已配平),下列有关说法不正确的是A、浓盐酸在反应中仅体现还原性 B、是还原产物 C、X表示NaCl D、每生成转移0.2mol电子
-
20、下列说法不正确的是A、热化学方程式未注明温度和压强时,表示25℃和101kPa时的数据 B、能够发生有效碰撞的分子叫做活化分子,活化能即活化分子具有的能量 C、升高温度和使用催化剂,都是增大了活化分子百分数,从而加快反应速率 D、汽车尾气净化反应 , 低温下能自发进行