相关试卷
-
1、《中国诗词大会》不仅弘扬了中华传统文化,诗句中还蕴含着许多化学知识。下列分析错误的是A、“千淘万漉虽辛苦,吹尽狂沙始到金”说明金的化学性质稳定,在自然界中常以单质形态存在 B、“忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关 C、“爆竹声中一岁除,春风送暖入屠苏”中爆竹爆炸过程中涉及化学变化 D、“纷纷灿烂如星陨,赫赫喧豗似火攻”中灿烂美丽的烟花是某些金属的焰色反应,焰色反应属于化学变化
-
2、根据所学知识,回答下列问题:(1)、的质量是g,其与分子中含有的氢原子数相同。(2)、在同温同压下,实验测得由和三种气体组成的混合气体的密度是的14.5倍,若其中CO和的物质的量之比为 , 则混合气体中氧元素的质量分数约为。(3)、同温同压下,某集气瓶充满时为116g,充满时为122g,充满气体A时为114g,则A的相对分子质量为 , 若相同条件下充满 , 则称重质量为g。(4)、常温下,已知某饱和NaCl溶液的体积为 , 密度为 , 质量分数为 , 物质的量浓度为 , 用含的式子表示该温度下NaCl的溶解度为g。(5)、工业上可将氯气通入的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为 , 则生产1000kg该NaClO溶液需消耗氯气的质量为kg(保留整数)。
-
3、实验室制备氯气的装置如图。

请回答以下问题:
(1)、仪器B的名称为;气体发生装置中发生反应的离子方程式为。(2)、设计装置D的实验目的是验证氯气是否具有漂白性,则D中Ⅰ、Ⅱ、Ⅲ处依次放入的物质组合为、无水、。(填“干燥的有色布条”或“湿润的有色布条”)(3)、由图可知收集氯气一般采用向上排空气法,根据氯气的溶解性,也可以采用法收集。(4)、用NaOH溶液吸收尾气的原理是(填化学方程式)。(5)、某同学用50g质量分数为29.2%的浓盐酸与足量的反应,利用上述装置制取氯气。根据计算,该同学预测能制取7.1g氯气。你认为该同学的预测是(填“正确”或“错误”)的,原因是。 -
4、盐酸是实验室常用的一种试剂,实验室中有一瓶物质的量浓度为的盐酸。请回答下列问题:(1)、取出上述盐酸,该溶液中的物质的量浓度为 , 将该盐酸稀释至 , 稀释后溶液中的物质的量浓度为。(2)、实验室需要盐酸,用上述盐酸试配制。
①用(填规格)量筒量取上述盐酸,倒入烧杯中,用适量水稀释,待冷却至室温后,转移到中,洗涤烧杯内壁和2~3次,并转移洗涤液。
②继续加水至离刻度线时,改用滴加蒸馏水至溶液的 , 盖好瓶塞,反复上下颠倒,摇匀;最后装入试剂瓶中,贴上药品标签。
-
5、碳纳米管可以看成是由石墨片层卷成的管状物,在力学、电学等方面都具有非凡的性能。工业上用电弧法合成的碳纳米管中常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式为。已知氧化性:。
回答下列问题:
 (1)、碳纳米管、碳纳米颗粒与金刚石的关系为;将碳纳米颗粒均匀分散在水中,使用激光笔照射,能观察到的现象为。(2)、由价态规律可知,具有的性质:(填标号)。
(1)、碳纳米管、碳纳米颗粒与金刚石的关系为;将碳纳米颗粒均匀分散在水中,使用激光笔照射,能观察到的现象为。(2)、由价态规律可知,具有的性质:(填标号)。a.仅具有氧化性 b.仅具有还原性
c.既有氧化性又有还原性 d.无法判断
(3)、在上述反应中,还原剂是(填化学式,下同),氧化剂被还原为。该反应中只表现酸性,为反应提供酸性环境,则在该反应中(填“能”或“不能”)用盐酸代替硫酸提供酸性环境,原因为。(4)、将上述化学方程式改写为离子方程式:。 -
6、甲、乙、丙、丁四种可溶性盐,其阳离子分别是、、、中的某一种,阴离子分别是中的某一种。已知:每种离子均不重复出现。现做以下实验:
①各取少量四种盐,分别溶于盛有5mL蒸馏水的4支试管中,只有乙盐溶液呈蓝色。
②分别向4支试管中加入2mL稀盐酸,发现甲盐溶液中产生白色沉淀,丙盐溶液中有较多气泡产生,而丁盐溶液中无明显现象。
下列说法正确的是
A、乙盐为 B、甲盐溶液中产生的白色沉淀是AgCl C、若向丙盐溶液中滴加稀盐酸,溶液中立即产生气泡 D、实验②结束后,向盛有丁盐溶液的试管中依次滴加足量的稀硝酸、溶液,可检验丁盐中是否含有 -
7、化学的学习与研究,由宏观到微观,由定性到定量。用表示阿伏加德罗常数的值,下列定量分析正确的是A、标准状况下,的质量为 B、等物质的量的、含有的原子数均为 C、溶液中含有的原子数为 D、通常状况下,固体中含有的阴离子数为
-
8、下列实验装置或操作能达到相应实验目的的是


A
B


C
D
A、观察的焰色 B、比较的热稳定性 C、除去中含有的 D、制备胶体 -
9、下列实验情景对应的离子方程式书写正确的是
选项
实验情景
离子方程式
A
向溶液中通入足量的
B
向溶液中加入足量的溶液
C
向溶液中通入少量气体
D
向稀硝酸中加入少量固体
A、A B、B C、C D、D -
10、已知反应:。关于该反应的说法正确的是A、 B、该反应中生成的与的质量之比 C、氧化产物是 , 还原产物是KCl D、被氧化的氯原子与被还原的氯原子的个数之比为6:1
-
11、学生实验需要使用的溶液,下列操作会导致所配溶液浓度偏大的是A、定容时,俯视刻度线 B、转移液体时,有液体溅出 C、用托盘天平称量固体 D、上下颠倒容量瓶,摇匀后,液面低于刻度线,再加水定容
-
12、下列各组离子能在同一溶液中大量共存的是A、、、、 B、、、、 C、、、、 D、、、、
-
13、下列关于钠及其化合物的说法错误的是A、过氧化钠可用作呼吸面具的供氧剂 B、钠单质可从溶液中置换出铜单质 C、碳酸氢钠的溶液呈碱性,碳酸氢钠可用作食用碱 D、当火灾现场存放有大量钠单质时,可用干燥的沙土来灭火
-
14、下列描述Ⅰ、描述Ⅱ均正确且存在因果关系的是
选项
描述Ⅰ
描述Ⅱ
A
和的水溶液能够导电
均为电解质
B
在水溶液中能电离出自由移动的离子
为电解质
C
的水溶液能导电
为电解质
D
Cu单质能够导电
Cu为电解质
A、A B、B C、C D、D -
15、下列关于摩尔质量的说法正确的是A、氮气的摩尔质量是 B、摩尔质量是物质的质量 C、的质量是 D、氧化钙的摩尔质量是
-
16、氢能是理想清洁能源,氢能产业链由制氢、储氢和用氢组成。(1)、工业上常利用甲烷水蒸气重整制氢:
反应I:
反应Ⅱ:
①反应的。
②在一定温度下,向恒容密闭容器中通入和 , 下列说法正确的是。
A.加入催化剂能提高平衡转化率
B.平衡时向容器中充入 , 反应I平衡正向移动
C.继续通入 , 能提高平衡转化率
D.反应体系中气体相对分子质量不变时到达化学平衡状态
(2)、在一定温度下,向的密闭容器中通入和 , 只发生反应Ⅱ: , 反应达平衡时的转化率50%,反应Ⅱ的平衡常数。(3)、氢燃料清洁能源车辆的使用将减少空气中氮氧化物的含量,某氢氧燃料电池工作示意图如下。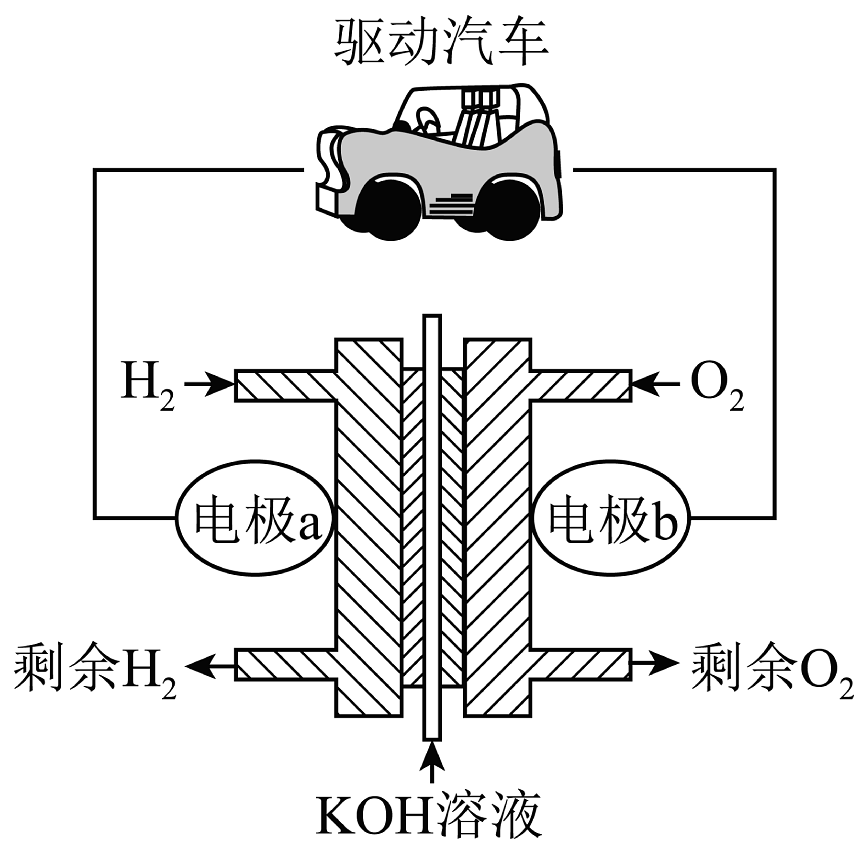
①电极a的电极反应式是。
②下列说法正确的是。
A.b极是负极
B.向a极移动
C.电池工作一段时间后,溶液中的会变大
D.有电子经过驱动汽车,消耗为
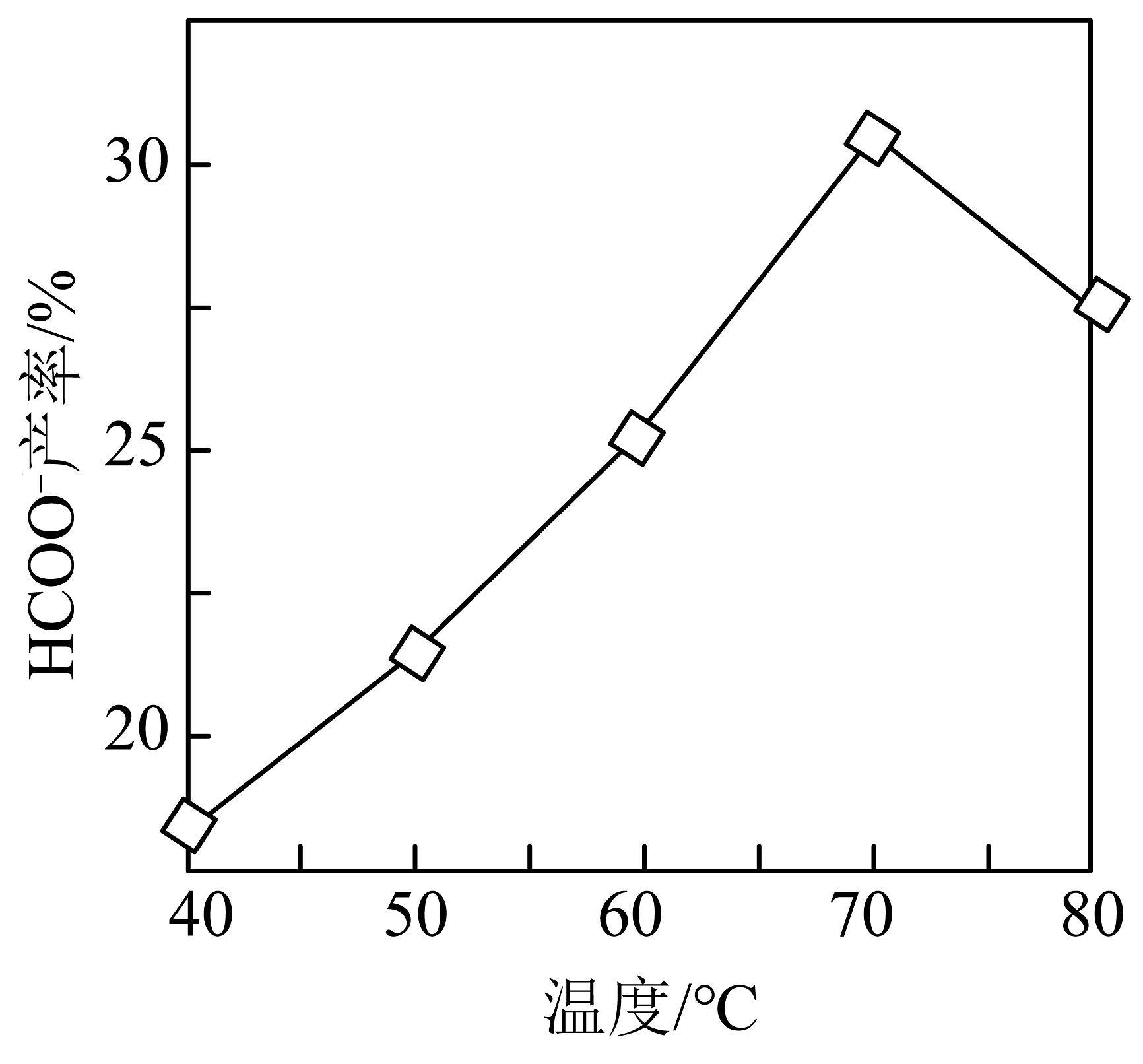
(4)、反应可用于储氢。密闭容器中,其他条件不变,向含有催化剂的溶液中通入 , 产率随温度变化如图所示。温度高于70℃,产率下降的可能原因是。
-
17、NH3是重要的化工原料,可制备硝酸和肼(N2H4 , 具有较强还原性)。
 (1)、写出N2的结构式。(2)、下列说法正确的是___________。A、步骤Ⅰ发生了氧化还原反应 B、步骤Ⅱ中需控制NaClO溶液的用量,不可过量 C、硝酸工业排放的NOx尾气可用NH3处理,生成无污染的物质 D、实验室可借助浓氨水和熟石灰反应快速制取少量氨气,且用无水CaCl2干燥(3)、N2H4在常温下是一种可燃性的液体,可用作火箭燃料。已知在25℃、101kPa时,32.0g N2H4在氧气中完全燃烧生成N2和液态水,放出624 kJ热量,N2H4完全燃烧的热化学方程式是。(4)、设计实验检验溶液A中金属阳离子。(5)、已知反应Ⅲ歧化生成NaNO2和另一种含氧酸盐,写出该反应的离子方程式。
(1)、写出N2的结构式。(2)、下列说法正确的是___________。A、步骤Ⅰ发生了氧化还原反应 B、步骤Ⅱ中需控制NaClO溶液的用量,不可过量 C、硝酸工业排放的NOx尾气可用NH3处理,生成无污染的物质 D、实验室可借助浓氨水和熟石灰反应快速制取少量氨气,且用无水CaCl2干燥(3)、N2H4在常温下是一种可燃性的液体,可用作火箭燃料。已知在25℃、101kPa时,32.0g N2H4在氧气中完全燃烧生成N2和液态水,放出624 kJ热量,N2H4完全燃烧的热化学方程式是。(4)、设计实验检验溶液A中金属阳离子。(5)、已知反应Ⅲ歧化生成NaNO2和另一种含氧酸盐,写出该反应的离子方程式。 -
18、某学生将准确称取的含有一定量杂质的样品(杂质与酸不反应)配制成待测液,并用浓度为的盐酸标准溶液滴定。(1)、操作步骤如下:
A.用移液管移取待测溶液注入洁净的锥形瓶中,并加入2∼3滴酚酞试液。
B.用标准溶液润洗滴定管2∼3次。
C.调节滴定管旋塞使尖嘴充满溶液,把盛有标准溶液的酸式滴定管固定好。
D.取标准盐酸溶液注入酸式滴定管至零刻度以上。
E.调节液面至零刻度(或以下),记下读数。
F.用标准溶液滴定至终点,记下滴定管液面的刻度。
请写出操作步骤的正确顺序为。
___________→___________→___________→___________→A→F
(2)、如果酸式滴定管液面位置如图所示,则此时的读数为。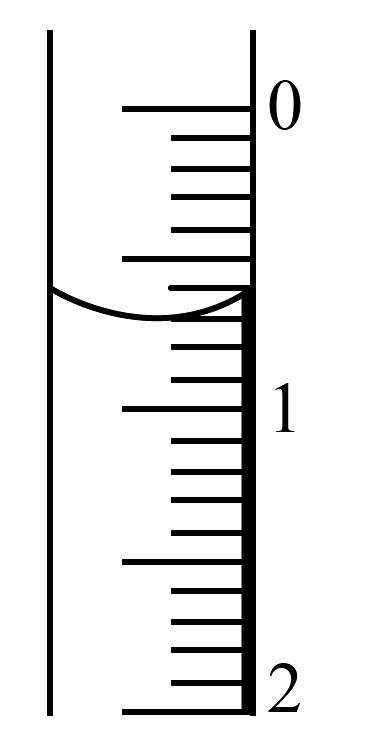 (3)、滴定时,滴定达到终点的标志是。(4)、滴定前读数及滴定后读数如下表所示:
(3)、滴定时,滴定达到终点的标志是。(4)、滴定前读数及滴定后读数如下表所示:滴定次数
待测液体积()
的盐酸体积()
滴定前读数
滴定后读数
第一次
10.00
0.20
20.10
第二次
10.00
4.05
24.15
第三次
10.00
2.10
22.10
由实验数据可知,样品的纯度为。
(5)、由于错误操作,使得上述样品的纯度偏高的是___________。A、锥形瓶用待测液润洗 B、部分标准液滴出锥形瓶外 C、锥形瓶洗净后还留有蒸馏水 D、中和滴定到达终点时俯视滴定管内液面读数 -
19、如图所示装置制备亚氯酸钠
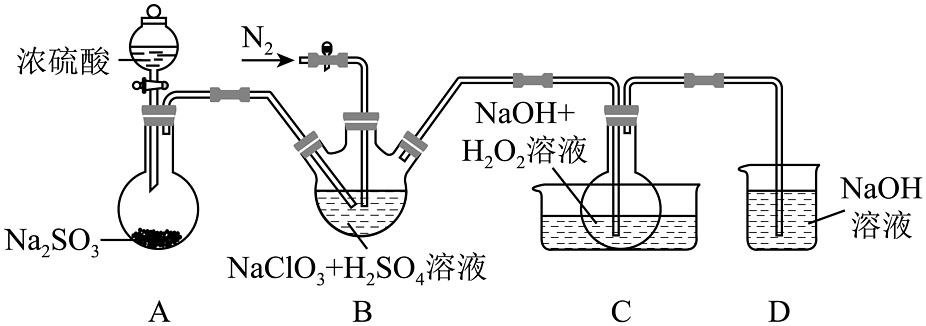
已知:①与在酸性条件下反应生成;
②饱和溶液在低于38℃时析出 , 高于38℃时析出 , 高于60℃时分解。
回答下列问题:
(1)、装的仪器名称 , B中体现(填氧化性或还原性)。(2)、装置D的作用。(3)、C中反应需要用冷水浴控制反应温度在38℃∼60℃,原因是。 -
20、汽车尾气中的、会对大气造成严重污染,利用催化技术可将和转化为和 , 发生反应(1)、该反应在(填“高温”或“低温”或“任何温度”)能自发进行。(2)、为探究温度和催化剂的比表面积对化学反应速率的影响规律,某研究小组设计了如表三组实验。
实验编号
T(℃)
初始浓度()
初始浓度()
催化剂的比表面积
I
200
82
Ⅱ
200
b
124
Ⅲ
300
a
82
实验I、Ⅱ探究的改变对化学反应速率的影响,其中a=。
(3)、测得不同时间的浓度如下表:时间/s
0
6
12
……
5.00
3.00
1.40
……
用的浓度变化表示的平均反应速率为
(4)、在恒容密闭容器中充入一定量的和 , 发生反应①当改变下列条件时,反应速率会增加的是。
A.升高温度 B.充入惰性气体 C.加入CaO固体 D.再通入
②下列能说明该反应达到平衡状态的是。
A.容器内气体密度不再变化
B.的浓度不再改变
C.相同时间内,反应生成同时生成
D.、、、的浓度之比为