相关试卷
-
1、某固体粉末由与组成,将其分成等量的两份,第一份恰好与盐酸完全中和;第二份与足量的气体作用,发现该固体质量增加了11.6g,试计算:(1)、与第一份反应的盐酸的物质的量是。(2)、固体中与的物质的量之比是。
-
2、如图是一套制取并验证氯气部分化学性质的实验装置。已知:。

回答下列问题:
(1)、写出装置A中仪器a的名称。(2)、为了尽量减少浓盐酸挥发和多余氯气尽量被氢氧化钠充分吸收(产生氯气不能太快),可采取的措施有(写两条):;。(3)、若要证明无漂白性,则必须在C与D装置之间加一个装有为洗气瓶,此实验条件下装置D中干燥的有色布条褪色的可能原因是。(4)、装置E中反应的离子方程式为。(5)、经测定E中得到1mol NaClO和 , 则吸收过程中消耗NaOH物质的量为mol。(6)、某消毒小组人员用的浓硫酸配制的稀硫酸用于84消毒液消毒能力的实验探究,在配制过程中,下列操作中能使所配溶液的浓度偏低的有(填代号)。①用量筒量取98%的硫酸时俯视
②未等稀释后的溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④转移过程中,有少量液体溅出
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
-
3、从钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:
 (1)、第一步:钛铁矿的主要成分是 , 第一步发生的反应: , 该反应的氧化产物是。(2)、第二步:第一步反应所得的高钛渣主要成分为二氧化钛,在高温下与焦炭、氯气反应,焦炭转化为一氧化碳,写出该反应的化学方程式。(3)、第三步用Mg高温下还原四氯化钛需要在惰性气体或隔绝空气条件下进行,原因是。(4)、单质镁通过电解熔融氯化镁的方式得到,请用一个化学方程式说明不能通过钠与氯化镁溶液反应制备单质镁的原因:。(5)、在潮湿的空气中产生白色的烟雾,生成和一种二元化合物,请写出此二元化合物分子式。
(1)、第一步:钛铁矿的主要成分是 , 第一步发生的反应: , 该反应的氧化产物是。(2)、第二步:第一步反应所得的高钛渣主要成分为二氧化钛,在高温下与焦炭、氯气反应,焦炭转化为一氧化碳,写出该反应的化学方程式。(3)、第三步用Mg高温下还原四氯化钛需要在惰性气体或隔绝空气条件下进行,原因是。(4)、单质镁通过电解熔融氯化镁的方式得到,请用一个化学方程式说明不能通过钠与氯化镁溶液反应制备单质镁的原因:。(5)、在潮湿的空气中产生白色的烟雾,生成和一种二元化合物,请写出此二元化合物分子式。 -
4、
某化学兴趣小组设计实验,探究离子反应及氧化还原反应的本质。
I.电解质在水溶液中的反应
向溶液中滴入几滴酚酞溶液,然后向溶液中滴加溶液。请回答下列问题:
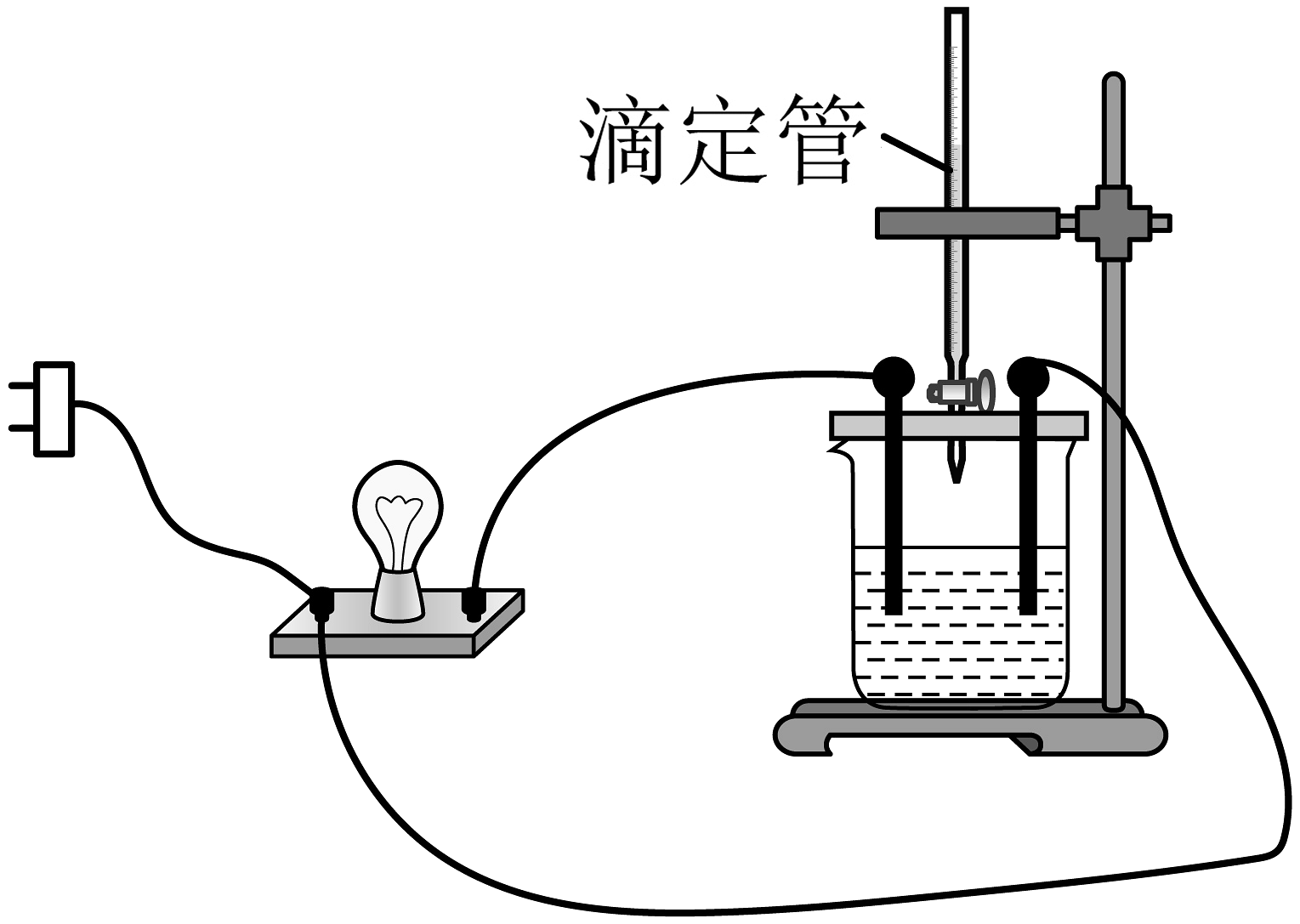
(1)按如图所示连接装置,并接通电源,发现灯泡变亮,某同学认为在电流的作用下,溶液电解离出了可导电的离子,此观点(填写“正确”或“错误”)。随着溶液的滴入,溶液中物质的量减小的主要微粒有。
(2)可观察到烧杯中溶液红色逐渐褪去,产生白色沉淀,小灯泡亮度变暗,该反应的离子方程式为。
(3)某同学认为用溶液代替溶液进行上述实验,结果发现灯泡变暗的程度不明显,推测当溶液刚好沉淀完全时候,溶液中还存在的导电主要微粒为。
Ⅱ.氧化还原反应
将锌片和石墨棒用导线连接,平行放置在硫酸铜溶液中,装置如图所示。观察到电流表指针偏转,锌片逐渐溶解,石墨棒上有红色物质析出。请回答下列问题:

(4)已知石墨棒上的反应式为: , 该反应类型为填“氧化反应”,“还原反应”或“氧化还原反应”);类比锌片上的反应,写出锌片棒上的反应式。该实验说明氧化还原反应的本质是电子的转移。
(5)实验过程中,兴趣小组同学发现一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如的拆写结果是:氧化反应为:;还原反应为:。
-
5、按要求完成下列各小题:(1)、下列有关物质的分类或归类说法正确的是。
①液氯、干冰、纯碱均为纯净物
②常温下,氯水和液氯均可用钢罐存放
③焰色实验使用的铂丝用盐酸洗涤,在灯焰灼烧至与原来灯焰颜色相同
④纳米材料一定为胶体
⑤离子反应只能代表强酸与强碱的中和反应
(2)、氢原子的物质的量相等的四种气体、、、 , 在同温同压下,此四种气体体积之比。(3)、在标准状况下,224mL某气体的质量为0.64g,该气体的摩尔质量为。(4)、用溶液配溶液,需量取溶液。(5)、现有下列8种物质:①②③盐酸④熔融⑤固体⑥液氯⑦胆矾晶体⑧蔗糖晶体。上述物质属于电解质的有(填序号)。 -
6、下列“实验结论”与“实验操作及现象”不相符的一组是
实验操作及现象
实验结论
A
向KI-淀粉溶液中滴加氯水,溶液变成蓝色
氧化性:
B
将钠放入热坩埚中加热燃烧,生成淡黄色固体
反应有生成
C
用玻璃棒蘸取氯水,点在湿润的pH试纸中间
可测得氯水的pH
D
向某溶液中加入几滴溶液,有白色沉淀生成,再加入少量稀硝酸,沉淀不溶解
溶液中可能含有
A、A B、B C、C D、D -
7、重铬酸铵[(NH4)2Cr2O7]受热分解的反应为氧化还原反应。下列对重铬酸铵受热分解的产物的判断符合实际的是( )A、NH3+CrO3+H2O B、NH3+Cr2O3+H2O C、N2+CrO3+H2O D、N2+Cr2O3+H2O
-
8、和的混合气体共0.1mol,通过足量的灼热的氧化铜,完全反应后,气体再全部通入足量的澄清石灰水中,得到的白色沉淀质量是A、5g B、10g C、15g D、20g
-
9、为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是
物质
试剂
分离方法
A
饱和碳酸
氢钠溶液
洗气
B
点燃
C
溶液
足量铁粉
过滤
D
NaOH溶液
洗气
A、A B、B C、C D、D -
10、用玻璃棒蘸取新制氯水滴在蓝色石蕊试纸中部,观察到的现象是




A
B
C
D
A、A B、B C、C D、D -
11、下列离子方程式书写不正确的是A、铁跟稀硫酸反应:Fe+2H+=Fe2++H2↑ B、铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag C、铁与氯化铜溶液反应:Fe+Cu2+=Fe2++Cu D、碳酸钙跟稀盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
-
12、以表示阿伏加德罗常数的值,下列说法中正确的是A、标准状况下个水分子所占的体积约为11.2L B、15.6g过氧化钠固体中含有的阴离子数目为 C、通入足量的水中充分反应转移的电子数为 D、与充分反应转移电子数为
-
13、欲配制100 mL 1.0 mol·L-1Na2CO3溶液,正确的方法是( )A、称量10.6 g Na2CO3溶于100 mL水中 B、称量10.6 g Na2CO3•10H2O溶于少量水中,再用水稀释至100 mL C、量取20 mL 5.0 mol·L-1Na2CO3溶液用水稀释至100 mL D、配制80 mL 1.0 mol·L-1Na2CO3溶液,则只需要称量8.5 g Na2CO3
-
14、化学与生产、生活密切相关。下列说法错误的是A、苏打可用于治疗胃酸过多 B、节日烟花与焰色试验的原理相同 C、过氧化钠可用于潜艇中氧气的来源 D、工厂中设计的静电除尘技术与胶体的性质有关
-
15、下列叙述中正确的是A、金属氧化物,一定是碱性氧化物 B、溶于水后能电离出氢离子的化合物都是酸 C、硫酸钡难溶于水,但硫酸钡属于强电解质 D、同一元素化合价越高,氧化性一定越强
-
16、将21.8gNa2O和Na2O2的固体混合物溶于水得到200mL溶液,所得溶液用100mL3.0mol/L稀硫酸恰好完全中和。回答下列问题:(1)、稀硫酸中溶质物质的量为mol。(2)、固体混合物与水反应后,所得溶液中溶质物质的量浓度mol/L。(3)、固体混合物中Na2O2的质量为g。
-
17、实验室以锈蚀程度较大的废铁屑为原料制备晶体的流程可简要表示如下:

试回答下列问题:
(1)、“酸溶”过程中发生主要反应有:①;
②;
③(用离子方程式表示)。
(2)、“氧化”过程可在如下图所示装置中进行。
①装置C的作用是。
②装置A中与浓盐酸反应生成和 , 请你写出另一个不同的实验室制氯气原理:(用离子方程式表示)。
③为使能充分发生反应,除在B中使用多孔球泡和搅拌外,实验中可采取的措施是。
(3)、某实验小组欲检测晶体中是否含 , 设计如下方案:取样溶解,加NaOH溶液,若产生的沉淀由白色迅速转化为灰绿色最终转化为红褐色,则含请判断该方案是否可行,并说明理由。 -
18、实验室需用溶液,现用NaOH固体配制该溶液。请回答下列问题:(1)、配制时需要使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、。(2)、用托盘天平准确称取固体。(3)、配制溶液时,有以下操作步骤:
①将容量瓶盖紧,振荡摇匀
②用托盘天平准确称量所需的NaOH,放入烧杯中,再加入适量水,用玻璃棒慢慢搅拌,使其溶解
③用适量水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中并摇匀
④改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
⑤将已冷却的溶液沿玻璃棒注入容量瓶中
⑥继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
这些操作步骤的正确顺序为(填序号)
A.②⑤③⑥④① B.②⑤③④⑥① C.②⑤③①⑥④
(4)、定容时的操作正确,将容量瓶的玻璃塞盖紧,颠倒摇匀后发现溶液的液面稍低于刻度线,此时(“需要”或“不需要”)向容量瓶中加水至液面与刻度线相切;取出10mL该NaOH溶液稀释至20mL,稀释后的NaOH溶液的物质的量浓度为。(5)、下列操作会造成所配溶液的浓度偏高的是(填序号)。①定容时俯视刻度线 ②称量固体时所用的砝码生锈
③溶解NaOH的烧杯未洗涤 ④溶解时有溶液溅出烧杯
-
19、化合物甲仅含两种元素,B为黄绿色气体,气体D能使湿润的红色石蕊试纸变蓝色,且标况下的密度为。在一定条件下有如下转化关系:

请回答
(1)、B的化学式为 , D的化学式为。(2)、写出B与水反应的离子方程式。(3)、甲的化学式为 , 甲与水反应的化学方程式为。 -
20、按要求回答下列问题。(1)、下列属于电解质的是(填序号)
①NaCl固体 ②Cu ③ ④
(2)、俗称“纯碱”,属于类(填“酸”,“碱”或“盐”),遇足量稀盐酸产生气泡,该反应的离子方程式为。(3)、用化学方程式表示除去固体中混入的固体杂质的方法。(4)、氯气与石灰乳反应的化学方程式:;该反应是制取漂白粉的原理,漂白粉有效成分是:。