相关试卷
-
1、下列实验方案中,不能测定出和混合物中质量分数的是A、取混合物充分加热,质量减少 B、取混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到固体 C、取混合物与足量稀硫酸充分反应,逸出气体用碱性的干燥剂碱石灰(主要成分是)吸收,质量增加 D、取混合物与足量溶液充分反应,得到溶液
-
2、类比是研究物质性质的常用方法之一,下列类比正确的是
①Cu与能化合生成 , 则Fe与能化合生成
②Mg在空气中燃烧生成MgO,则Na在空气中燃烧生成
③少量通入溶液生成 , 则少量通入NaClO溶液生成
④Fe可以置换出溶液中的铜,则Zn也可以置换出溶液中的铜
A、①② B、②③ C、①③ D、①④ -
3、下列离子方程式书写正确的是A、碳酸氢钙溶液与氢氧化钙溶液反应: B、向氯化钙溶液中通入少量CO2: C、工业制备漂白粉的离子方程式: D、硫酸氢钠在溶液中的电离方程式:
-
4、下列有关离子检验描述正确的是A、将干净的铂丝蘸取少量未知溶液在酒精灯上灼烧,观察火焰呈浅紫色,则该溶液中含有Na+ B、取样,先加稀盐酸无现象,再加BaCl2溶液出现白色沉淀,则该溶液中一定含有 C、取样,加入AgNO3溶液,若有白色沉淀产生,则该溶液中一定含有Cl- D、取样,滴加稀盐酸溶液,产生了能使澄清石灰水溶液变浑浊的气体,则该溶液中一定含有
-
5、设NA为阿伏加德罗常数的值,下列说法正确的是A、80 g NaOH溶于1 L水中,所得溶液中溶质的物质的量浓度为2 mol/L B、足量的MnO2与100 mL12 mol/L的浓盐酸充分反应可制得氯气的分子数为0.3NA C、常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA D、7.8 gNa2O2和Na2S混合物中所含的离子总数为0.3NA
-
6、下列说法正确的是
①将放入水中不能导电,所以是非电解质
②溶于水能导电,所以是电解质
③在熔融状态下不导电,所以是非电解质
④盐酸能导电,但其不是电解质,也不是非电解质
⑤盐酸的导电能力一定比醋酸溶液的导电能力强
⑥金属铜的导电能力较好,属于电解质
A、①② B、③④⑤ C、⑤⑥ D、④ -
7、下列各组物质,因反应条件或反应物用量改变可得到不同产物的是
①Na和 ②和盐酸 ③和 ④NaOH和
A、①③ B、②③ C、③④ D、①④ -
8、下列有关说法正确的是A、用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色,说明该溶液呈碱性 B、氧化钠可用作呼吸面罩或潜水艇的供氧剂 C、碳酸钠和碳酸氢钠的溶液均显碱性,可用作食用碱或工业用碱 D、火灾现场存放有大量钠时,可以用泡沫灭火器来进行扑灭
-
9、氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影3区域的是
 A、2HClO2HCl+O2↑ B、 C、 D、NaH+H2O=NaOH+H2↑
A、2HClO2HCl+O2↑ B、 C、 D、NaH+H2O=NaOH+H2↑ -
10、下列有关实验安全的叙述不正确的是A、观察活泼金属与H2O反应时,需要戴护目镜 B、GHS标准符号
 示意“毒性物质”
C、若不慎将碱沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸
D、中学实验室中可以将未用完的钠、钾和白磷等放回原试剂瓶
示意“毒性物质”
C、若不慎将碱沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸
D、中学实验室中可以将未用完的钠、钾和白磷等放回原试剂瓶
-
11、下列说法不正确的是A、侯德榜是我国著名化工专家,发明了侯氏制碱法 B、戴维发现了一种黄绿色气体,并确认该气体为氯气 C、瑞典化学卷阿伦尼乌斯研究电解质稀溶液的导电性,提出了电离模型 D、英国科学家道尔顿提出原子学说,为近代化学的发展奠定了坚实的基础
-
12、名称为“坩埚”的仪器是A、
 B、
B、 C、
C、 D、
D、
-
13、根据物质的组成与性质进行分类,属于A、酸 B、氧化物 C、碱 D、盐
-
14、完成下列计算。(1)、现有标准状况下CO和混合气体3.36L,其质量为5g,则混合气体中,CO和物质的量之比为。(2)、现有和的混合物,置于试管中加热到质量不再变化时,得到42.4g固体,则原混合物中和的物质的量之比为。(3)、用催化分解 , 当转移电子的个数为时,得到的在标准状况下的体积为。(4)、硫酸钠和硫酸铝的混合溶液中,测得浓度为 , 加入等体积的氯化钡溶液恰好使完全沉淀,则原混合溶液中浓度为。
-
15、
Ⅰ.如图为氯元素的“价-类”二维图。回答下列问题:
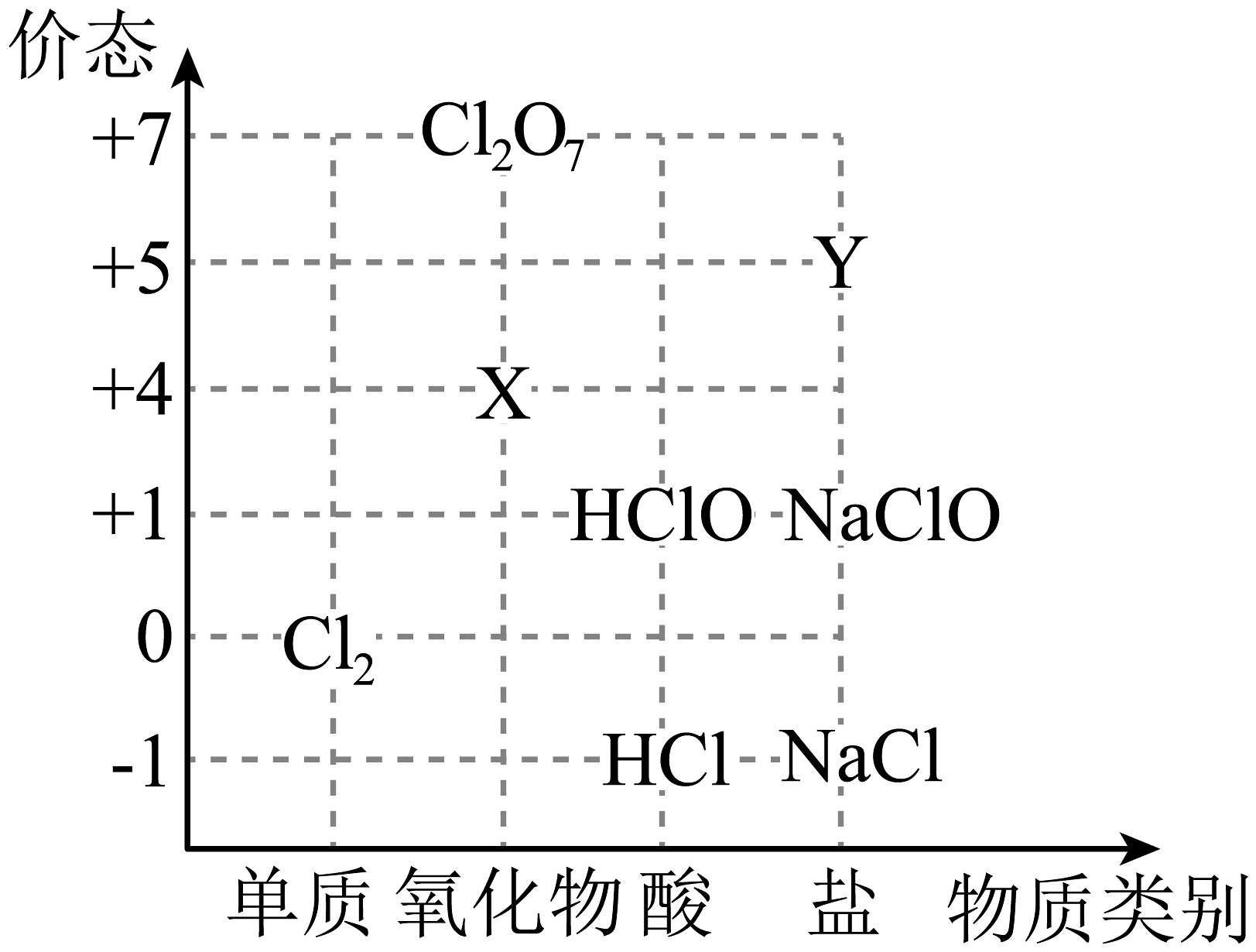
(1)X可以代替成为新时代自来水消毒剂,则X是________(填化学式,下同);Y的焰色试验呈紫色,则Y是________。
(2)从化合价角度看,HCl能与___________发生反应(填序号)。
A. NaClO B. Fe C. D. NaOH (3)一种酸性氧化物,写出与NaOH反应的化学方程式:________。
Ⅱ.青铜是金属冶炼史上最早冶炼的合金,我国出土了大量青铜器,体现了古代中国对人类文明的巨大贡献。青铜器在埋藏过程中会逐渐生锈,其修复工作是文物保护的重要环节。
(4)查阅资料得知铜锈的主要成分为 , 俗称铜绿,是由于铜长期放置在潮湿空气中所致,请写出该过程的化学方程式:________。
(5)铜绿可溶于酸,将少量的铜绿粉末加入足量的稀硫酸中,可观察到的现象为________,写出反应的离子方程式:________。
(6)继续查阅资料,了解到铜锈的成分很复杂,主要成分有和。结构如图所示:
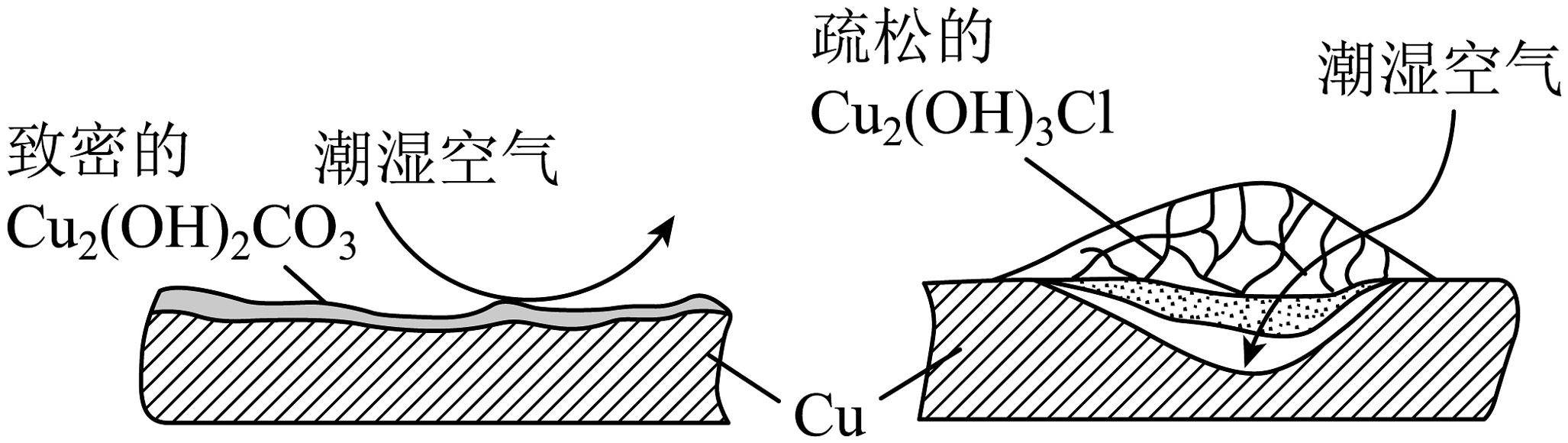
考古学家将铜锈分为“无害锈”和“有害锈”,“无害锈”形成后可阻止内部金属继续腐蚀,而“有害锈”则无法阻止腐蚀的深入。结合两种铜锈的结构推测,“有害锈”的主要成分为:________。
(7)青铜器的修复有多种方法,其中之一是碳酸钠法:将腐蚀文物置于含碳酸钠和碳酸氢钠的混合溶液中浸泡,使转化为。请写出该方法涉及的离子方程式________。
-
16、按要求写出下列反应的离子方程式。(1)、次氯酸见光分解:。(2)、澄清石灰水中加入过量溶液:。(3)、用醋酸()除去水垢:。(4)、实验室用与浓盐酸制取:。(5)、溶液与酸性溶液反应生成与 , 并用双线桥标出电子转移:。
-
17、某化学兴趣小组模拟侯氏制碱法进行实验,流程如图所示。下列说法正确的是
 A、气体N,M分别为和 B、气体可以循环利用,因此工业生产时理论上不需要进行补充 C、加入NaCl粉末的作用是增 , 促进结晶析出 D、加入NaCl粉末后所得“食盐水”中溶质只有NaCl
A、气体N,M分别为和 B、气体可以循环利用,因此工业生产时理论上不需要进行补充 C、加入NaCl粉末的作用是增 , 促进结晶析出 D、加入NaCl粉末后所得“食盐水”中溶质只有NaCl -
18、已知反应:①;②(浓);③。
下列说法正确的是
A、上述三个反应都是置换反应 B、氧化性由弱到强的顺序为 C、反应①中氧化剂与还原剂的物质的量之比为2:1 D、反应③中若反应 , 则还原剂得电子的物质的量为5mol -
19、关于实验室安全,下列表述错误的是A、如果不慎将碱沾在皮肤上,应立即用大量水冲洗,然后涂上1%的醋酸 B、具有
 标识的化学品为爆炸类物质,实验时不准敲击、摩擦和挤压
C、轻微烫伤或烧伤时,可先用洁净的冷水处理,然后涂上烫伤药膏
D、少量浓硫酸溅到皮肤上时,应用大量水冲洗并涂上稀的溶液
标识的化学品为爆炸类物质,实验时不准敲击、摩擦和挤压
C、轻微烫伤或烧伤时,可先用洁净的冷水处理,然后涂上烫伤药膏
D、少量浓硫酸溅到皮肤上时,应用大量水冲洗并涂上稀的溶液
-
20、下列有关氯气的叙述中,不正确的是A、为方便运输可用干燥的钢瓶储存液氯 B、工业上用电解饱和食盐水制备氯气 C、灼热的铁丝放入盛有干燥氯气的集气瓶中燃烧生成棕色的烟雾 D、干燥的氯气能使鲜花褪色