相关试卷
-
1、普利类药物是常用的一线降压药,EHPB是合成众多普利类药物的重要中间体。EHPB的其中一种合成方法如下:

回答下列问题:
(1)、化合物Ⅰ的名称为。化合物Ⅱ和物质X合成化合物Ⅲ的原子利用率为100%,则物质X的分子空间结构名称为。(2)、化合物Ⅵ到Ⅶ的转化反应是第一个以中国科学家命名的反应(黄鸣龙还原反应),该反应的部分机理如下:
其中①和②的反应类型分别为、。
(3)、根据化合物Ⅲ的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
①
②
(4)、关于上述示意图中的相关物质及转化,下列说法正确的有______A、化合物Ⅳ和Ⅶ的手性碳原子数相同 B、可以利用酸性高锰酸钾溶液鉴别化合物Ⅲ和Ⅳ C、化合物Ⅴ转化为Ⅵ,存在键的断裂和键的形成 D、化合物Ⅳ易溶于水,可能是因为其能与水形成分子间氢键(5)、化合物Ⅵ的某种同分异构体在核磁共振氢谱图上有3组峰,能发生银镜反应,且能使溶液显紫色,其结构简式为。(6)、以化合物Ⅰ和乙烯为有机原料,合成化合物M(如图)。基于设计的合成路线,回答下列问题:
①从乙烯出发,第一步反应的化学方程式为。
②最后一步反应的反应物为。
-
2、
Ⅰ.化学反应中,从反应物到生成物可有多种途径,但殊途同归。
(1)如图所示,已知:

则(用、和的代数式表示)。
Ⅱ.从分子、原子的角度认识物质的转化是化学区别于其他学科的显著特点。
(2)有机反应机理的研究可为人们展示微观粒子在反应中的变化过程。
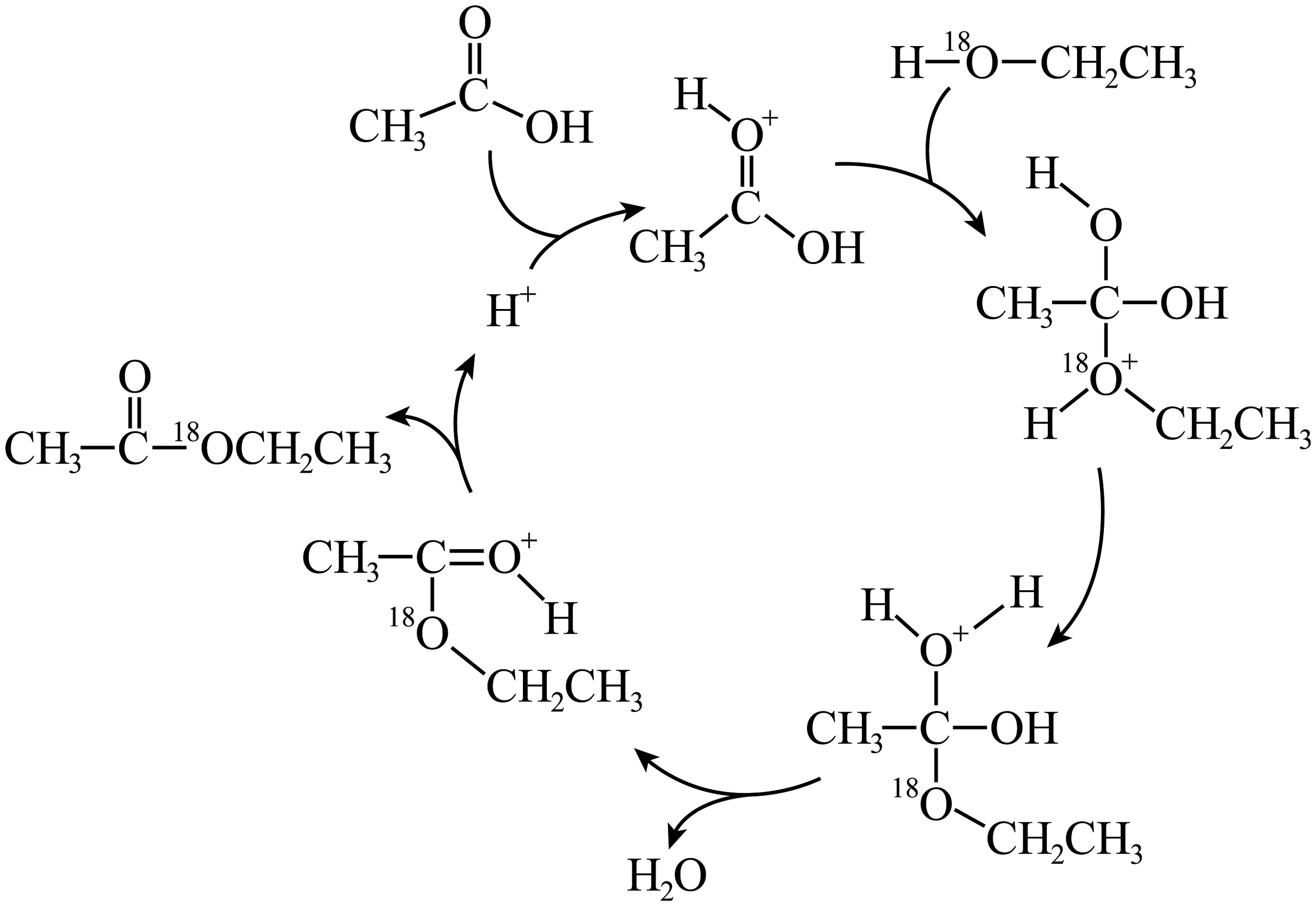
①根据上图所示反应机理,写出相应的化学方程式。
②关于上图所示反应,以下说法正确的是。
A.作为反应物参与该反应
B.能增大该反应速率
C.不能增大该反应的平衡转化率
D.若该反应在溶液中进行,升温、增压均可增大反应速率
Ⅲ.化学助力我国实现“碳达峰、碳中和”的目标。
(3)向体积为1L的密闭容器通入4mol和的混合气体,并发生反应:。
的平衡转化率与压强、温度及氢碳比的关系如下图所示。
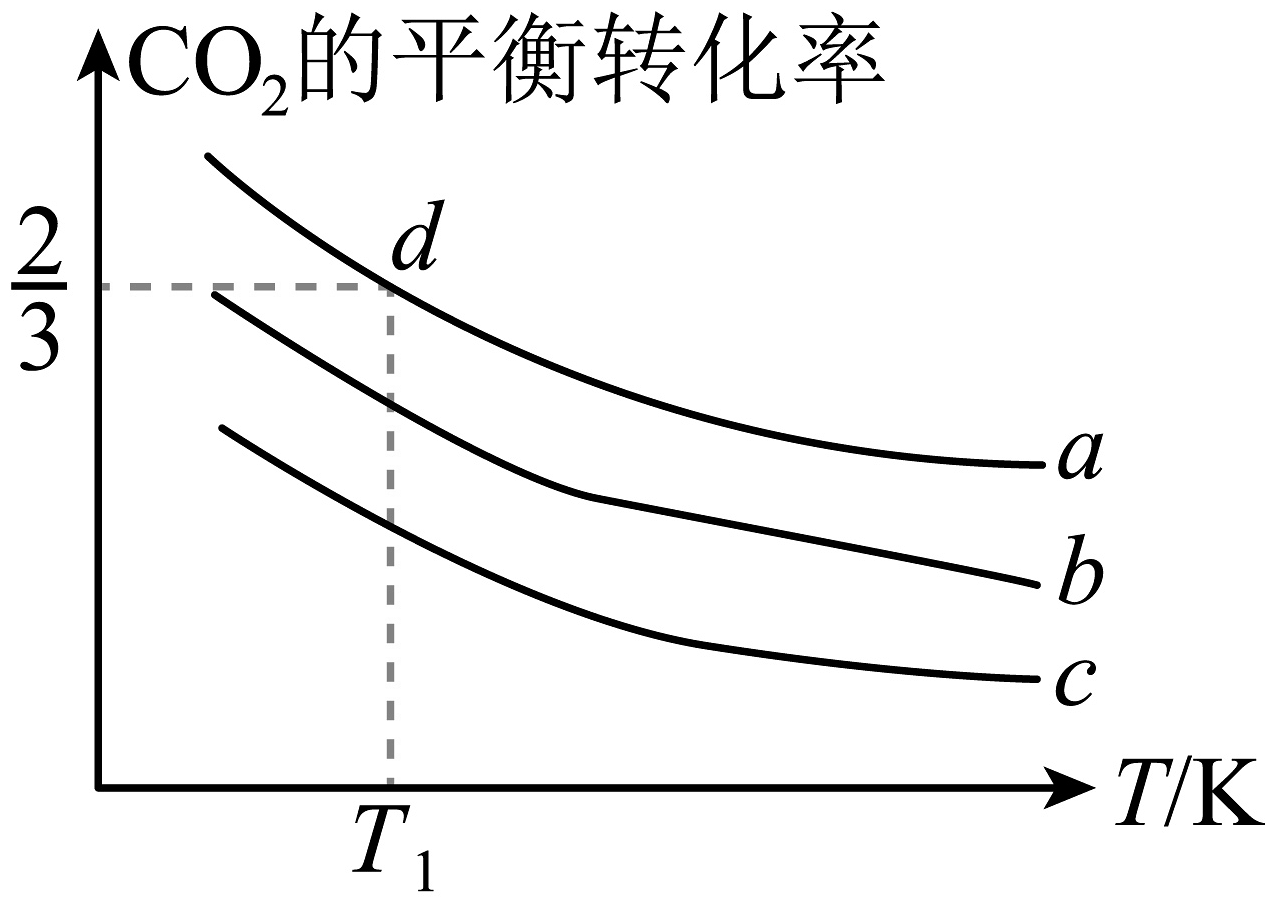
①其他条件相同,若a、b、c代表压强,则a、b、c从大到小的顺序为 , 该反应为(填“吸热”或“放热”)反应:其他条件相同,若a、b、c代表氢碳比,则a、b、c从大到小的顺序为。
②若d点时氢碳比为3∶1,求此温度下该反应的平衡常数K。(写计算过程)
③工业上可利用NaOH溶液捕获。将通入NaOH溶液中,若所得溶液 , 溶液pH=。(已知: , 该条件下,的;)
-
3、钒、钛、钨等金属的回收具有重要的经济和战略价值。利用废钒-钛系脱硝催化剂(含、、及少量的Si、P、Al等的化合物)回收钒、钛、钨的工艺流程如下图。
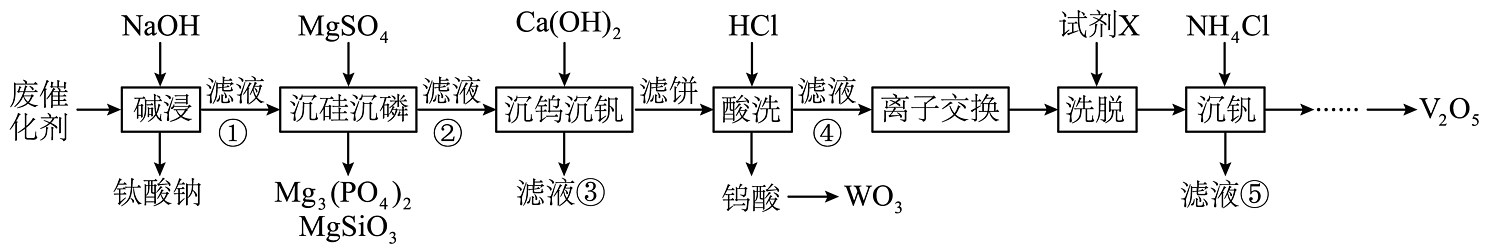
已知:和的溶解度随温度升高而增大。
回答下列问题:
(1)、钛酸钠()中Ti的化合价为。写出“碱浸”过程中反应生成的化学方程式:。(2)、在“沉硅沉磷”工序中,除磷率和除硅率变化如图所示。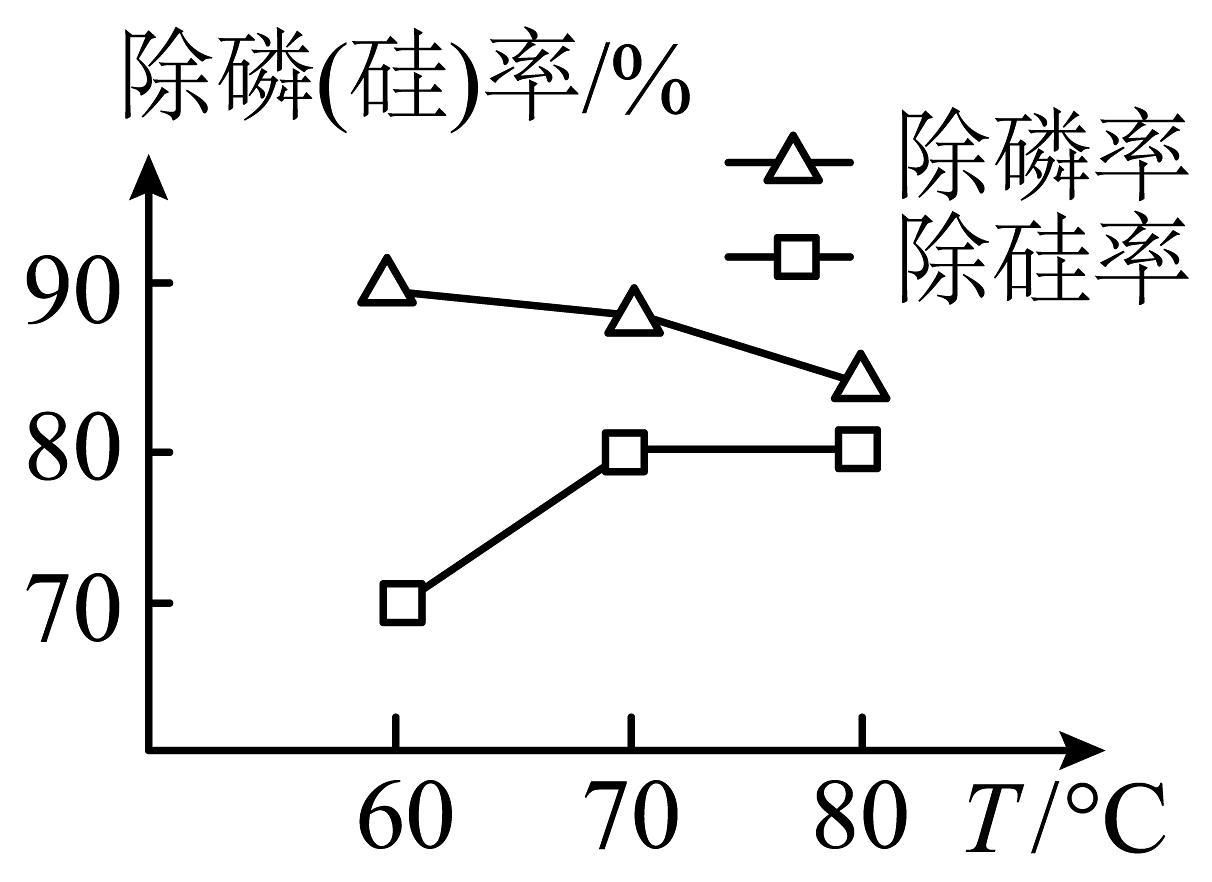
①“沉硅沉磷”最适合温度为。
②除硅率随温度升高而增大,因升温促进含硅物质的水解,最后硅元素以(填化学式)的形式沉淀分离出来。
③除磷率随着温度的升高而下降,其原因可能是。
(3)、“沉钨”时转化为沉降分离,已知温度为T时 , , 当溶液中恰好沉淀完全(离子浓度等于)时,溶液中。(4)、已知“酸洗”后钒以形式存在。“离子交换”过程可表示为: , 其中为强碱性阴离子交换树脂。“洗脱”时,试剂X应选用(填化学式)。(5)、①是常用的催化剂,其结构如图所示,该分子中σ键和π键数目比为。硫酸工业中,转化为的催化剂选用 , 催化过程经两步完成。
ⅰ:(写出化学方程式),ⅱ:。
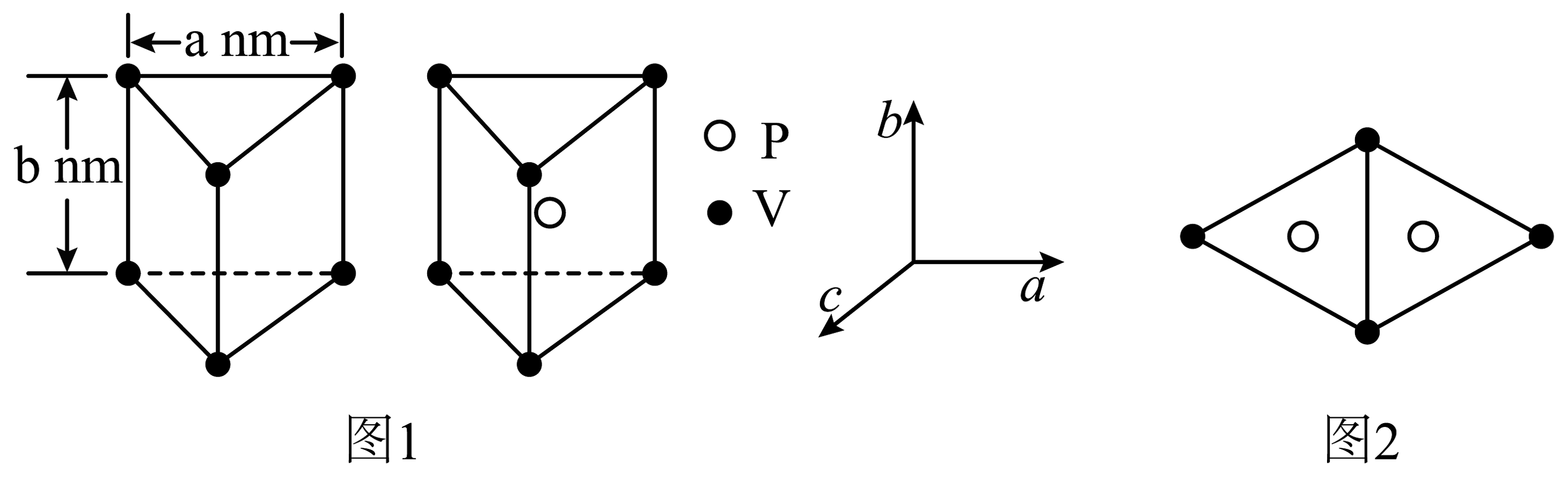
②磷化钒(VP)是另外一种新型催化材料,P交替地填入在V构成的正三棱柱中心,形成如图1所示结构单元。VP晶胞沿b轴投影图如图2所示,则该晶体的晶胞体积为。
-
4、
铜纳米线是制作柔性电子元件的重要材料,制作铜纳米线常见原料为硫酸铜。某学习小组设计实验探究铜纳米线的制备过程。
Ⅰ.硫酸铜的制备
(1)实验室可用铜和浓硫酸反应制备硫酸铜,反应方程式为。
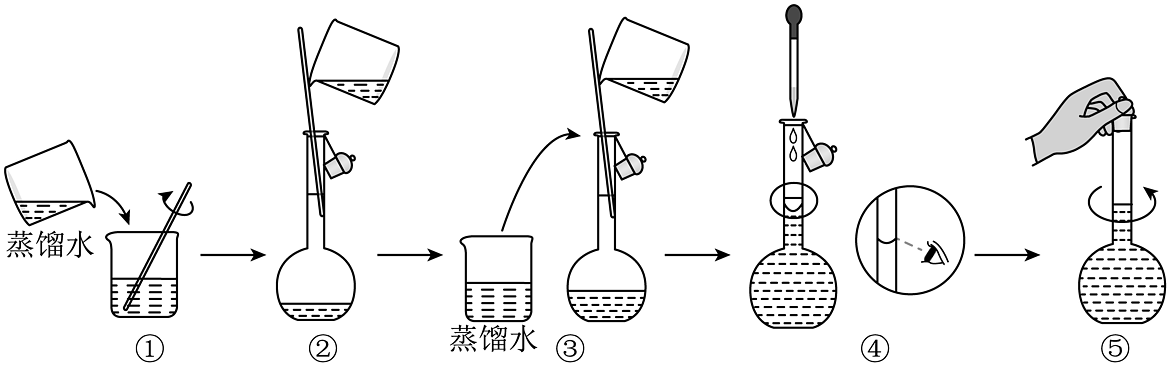
(2)硫酸铜溶液的配制
ⅰ.配制100mL 0.1硫酸铜溶液需称量g。
ⅱ.以下硫酸铜溶液的配制操作中,不正确的是(填序号)。
Ⅱ.铜纳米线的制备
铜纳米线的制备可采用化学还原法,如使用铁进行置换。学习小组设计实验探究Cu(Ⅱ)(二价铜)存在形式对所置换铜的颗粒度影响。
实验序号
实验操作
实验现象
①
往5mL 0.1硫酸铜溶液中放入一枚表面打磨光滑的铁钉
10分钟时观察到溶液颜色变浅,铁钉表面沉积一层粗糙的铜颗粒,试管底部有铜颗粒
②
往5mL 0.1硫酸铜溶液中滴加浓氨水至生成的淡蓝色沉淀刚好完全溶解,得深蓝色铜氨溶液,放入与实验①相同的铁钉
10分钟时无明显现象,10小时后观察到铁钉表面镀上一层红色的铜,试管底部有红褐色沉淀
学习小组通过查阅资料发现:
ⅰ.工业上常采用电沉积铜方法制备纳米铜,过程为Cu(Ⅱ)的扩散迁移并在电极上被还原为铜单质。
ⅱ.电沉积过程中:速率常数越大,沉积速率越快:扩散系数越大,溶液导电性越强。
学习小组模仿工业制备纳米铜的条件,设计实验验证Cu(Ⅱ)存在形式和溶液导电性对电沉积铜反应速率的影响。
实验设计与实施
实验
序号
Cu(Ⅱ)存在形式
(浓度均为5 mmol/L)
支持电解质
(提高溶液导电性)
实验测得
速率常数
含铜离子
扩散系数
③
0.5mol/L溶液
④
______
⑤
0.5mol/L溶液
k
表格中的速率常数和扩散系数为多次实验后测得数据的平均值。
(3)其中实验④中支持电解质为。
分析与讨论
(4)实验⑤中,k(填“>”、“<”或“=”)。
(5)已知铁与铜氨溶液反应: , 平衡常数。推测实验②在10分钟时无明显现象的原因是:。
结论:选用扩散系数更大Cu(Ⅱ)和提高溶液的导电性都可加快反应速率。
Ⅲ.铜纳米线的纯度检测
某铜纳米线样品质量为m g,经处理后完全转化为含的溶液,向其中加入过量的KI溶液,发生反应:。用的溶液滴定生成的 , 发生反应: , 消耗溶液V mL。
(6)滴定实验中可使用(填试剂名称)作为指示剂。滴定终点现象为:。
(7)该样品中铜的质量分数为(写计算式)。
-
5、有机电化学合成法具有绿色高效的特性,可将硝基苯合成对氨基苯酚的过程由原来的4步简化为1步,合成过程如图所示。下列说法正确的是
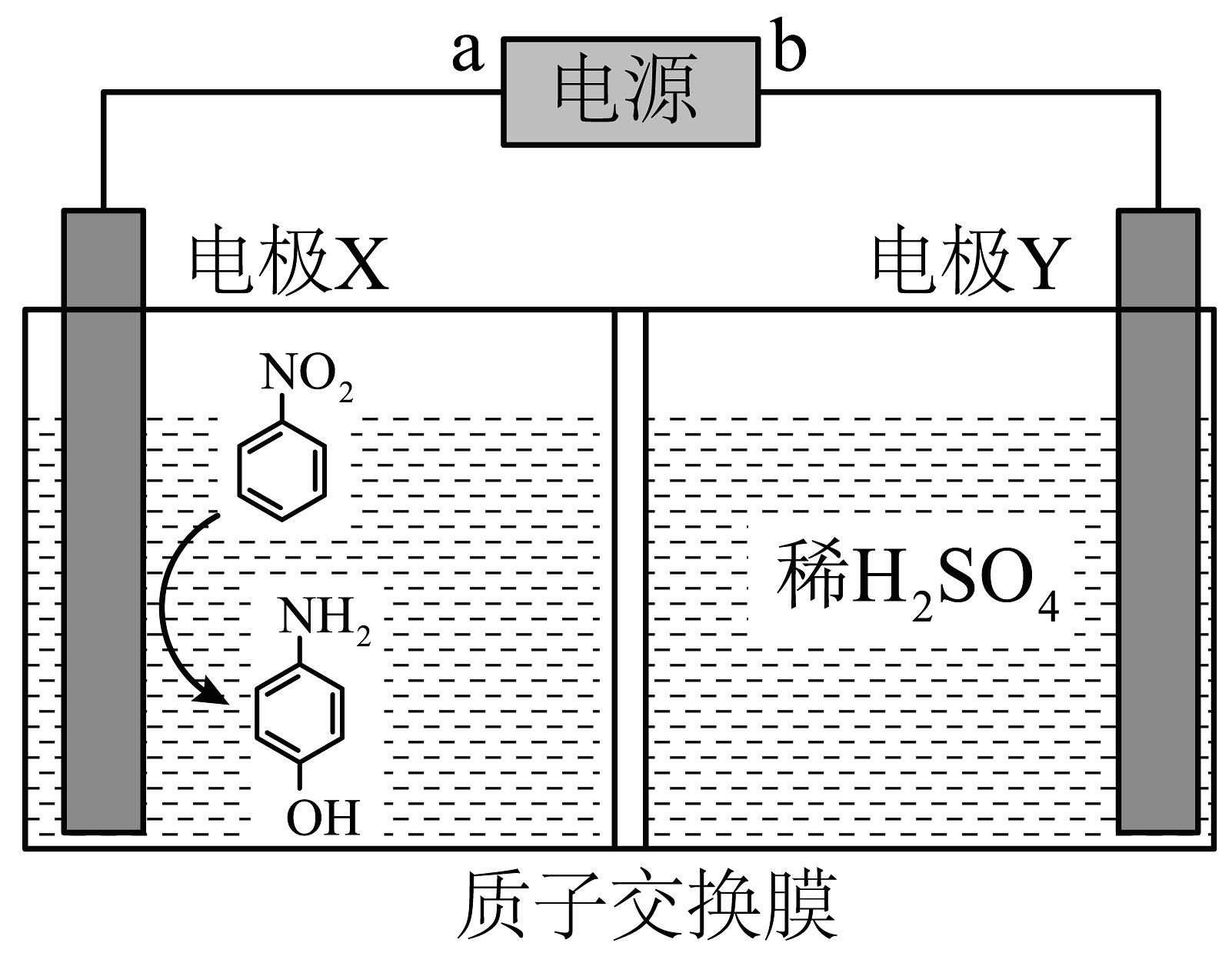 A、b是电源的负极 B、电解时,电子从左往右穿过质子交换膜 C、电解时每转移4mol电子,右室溶液质量减少32g D、电极X的电极反应式:
A、b是电源的负极 B、电解时,电子从左往右穿过质子交换膜 C、电解时每转移4mol电子,右室溶液质量减少32g D、电极X的电极反应式:
-
6、研究表明、两种双金属合金团簇用于逐步脱氢的部分能量变化如图所示(吸附在催化剂表面上的物种用*标注,TS1、TS2、TS3、TS4均表示过渡态)。下列说法不正确的是
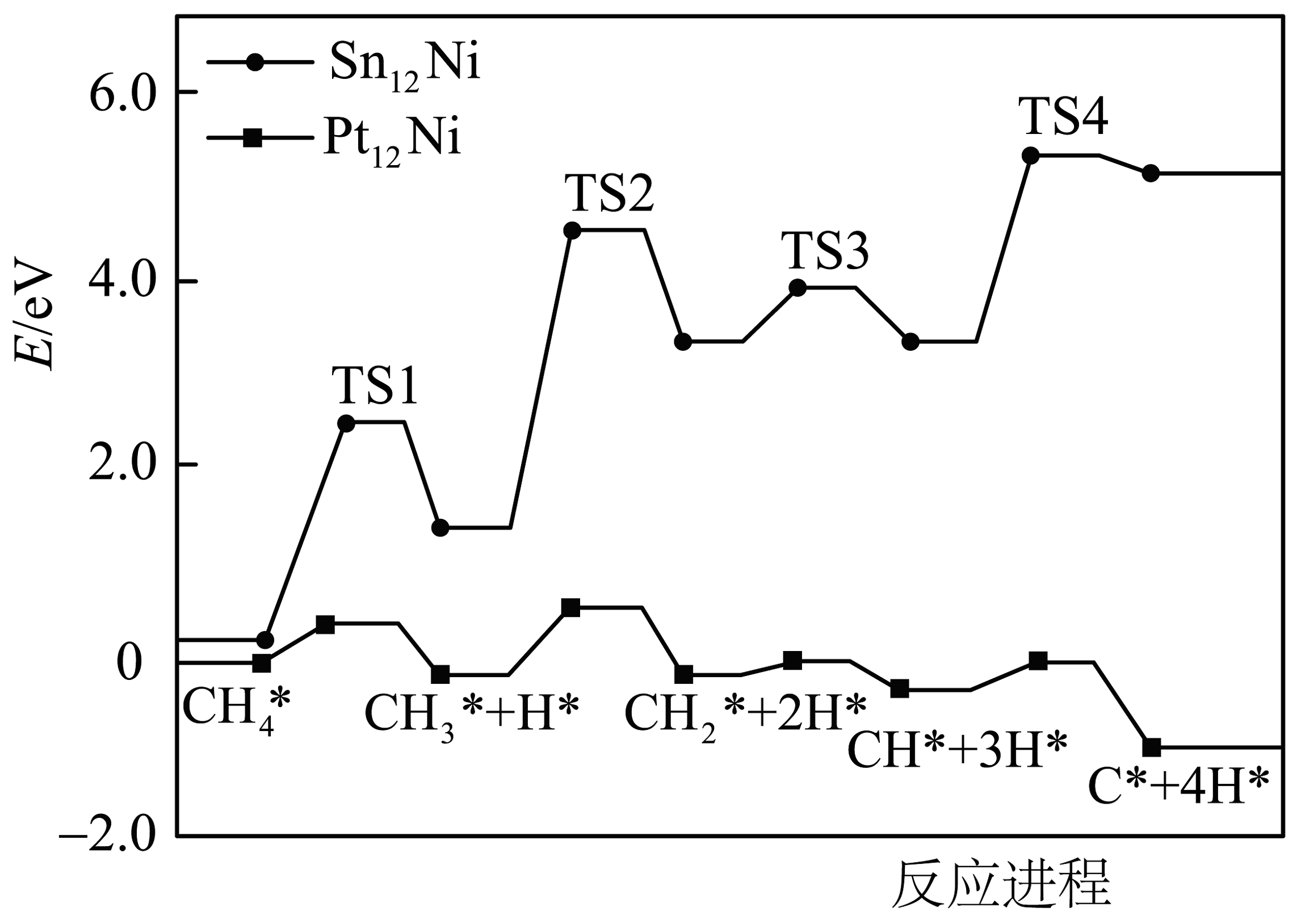 A、图中显示的历程分4步进行 B、如图甲烷脱氢过程中决定速率的步骤是: C、如图甲烷脱氢过程中催化剂活性较好的是 D、使用催化剂时的图示反应历程中涉及极性键的断裂
A、图中显示的历程分4步进行 B、如图甲烷脱氢过程中决定速率的步骤是: C、如图甲烷脱氢过程中催化剂活性较好的是 D、使用催化剂时的图示反应历程中涉及极性键的断裂 -
7、一种补充微量元素的食品添加剂的结构式如图所示,W、X、Y、Z、Q的核电荷数依次增大,X、Y、Z同周期,Q的价层电子排布式为。下列说法不正确的是
 A、沸点: B、此结构中存在配位键 C、第一电离能:X<Y<Z D、和的空间结构均为平面三角形
A、沸点: B、此结构中存在配位键 C、第一电离能:X<Y<Z D、和的空间结构均为平面三角形 -
8、设为阿伏加德罗常数的值。下列说法正确的是A、1mol苯中含有3个π键 B、1L 1mol/L的苯酚钠溶液中含个 C、与反应生成22.4L , 转移的电子数为2 D、1mol 与混合物中含碳原子数为2
-
9、某研究性学习小组欲检验浓硫酸与蔗糖反应的产物,设计如下图所示装置(部分夹持装置已略)。下列说法不正确的是
 A、Ⅰ中蒸发皿内的白色固体变黑,体现了浓硫酸的脱水性 B、Ⅱ中溶液褪色,证明产物中有 C、Ⅲ中溶液快速变为无色且Ⅳ中产生沉淀,证明产物中有 D、Ⅴ中溶液可吸收尾气,防止污染环境
A、Ⅰ中蒸发皿内的白色固体变黑,体现了浓硫酸的脱水性 B、Ⅱ中溶液褪色,证明产物中有 C、Ⅲ中溶液快速变为无色且Ⅳ中产生沉淀,证明产物中有 D、Ⅴ中溶液可吸收尾气,防止污染环境 -
10、下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
沸点:
 大于
大于
 存在氢键,
存在氢键, 不存在氢键
不存在氢键B
NaCl能使蛋白质变性
NaCl可用作食品防腐剂
C
键键能比键高
的沸点比高
D
对X射线透过率低且难溶于酸
医学上常用作X射线检查的内服药剂
A、A B、B C、C D、D -
11、新颖的曲面屏手机和折叠屏手机采用OLED显示技术,OLED是有机发光二极管的简称,如图有机物可用作OLED显示屏的发光材料。下列关于该有机物说法正确的是
 A、属于芳香烃 B、分子式为 C、分子中所有原子共面 D、分子中的碳原子均采用杂化
A、属于芳香烃 B、分子式为 C、分子中所有原子共面 D、分子中的碳原子均采用杂化 -
12、合成氨是人类科学技术发展史上一项重大成就。某兴趣小组利用以下装置进行氨气相关实验,其中难以达到预期目的的是


A.制备
B.干燥


C.收集
D.验证的溶解性
A、A B、B C、C D、D -
13、劳动铸就辉煌,汗水谱写华章。下列劳动项目与所述化学知识没有关联的是
选项
劳动项目
化学知识
A
环保工程师:监测大气中二氧化硫的浓度
二氧化硫有漂白性,可用于杀菌消毒
B
科研工作者:探索石墨转化成金刚石的条件
C
电池研发员:研发丙烷燃料电池
电池总反应:
D
营养师:建议炖排骨时加入适量的醋
醋酸可以溶解骨头中的含钙物质,利于人体吸收钙元素
A、A B、B C、C D、D -
14、提纯粗溴苯(含少量溴和苯)的过程如下。其中,操作X为
 A、冷却结晶 B、分液 C、蒸馏 D、过滤
A、冷却结晶 B、分液 C、蒸馏 D、过滤 -
15、中科院牵头研制的新概念潜水器——“鹿岭号”深海多位点着陆器,使用了镁,海水燃料电池,其总反应为:。下列有关说法正确的是A、金属镁作负极材料 B、放电时电解质溶液中向正极移动 C、可使用金属钠代替镁作钠—海水燃料电池电极材料 D、氧气在电极表面发生反应:
-
16、“为生活加速,为品质加码!”汽车已走入千家万户。关于汽车的下列说法不正确的是A、真皮座垫含蛋白质,蛋白质水解的最终产物是氨基酸 B、发动机由合金材料制成,合金都具有熔点高、硬度低的特性 C、车漆的成分之一是有机高分子,可通过单体的加聚或缩聚反应合成有机高分子 D、排气管中的催化剂提高了NO和CO的转化效率,催化剂可降低反应的活化能
-
17、深中通道是集“桥、岛、隧、地下互通”一体的跨海集群工程。下列说法不正确的是A、桥面中心位置,隐藏着一道抗强台风的玻璃墙,玻璃是非晶态固体 B、悬索主缆使用的中国自主研发2060兆帕镀锌铝钢丝,具有强抗腐蚀性 C、桥面铺装了耐高温的环氧沥青,沥青可通过石油裂化获得 D、用于密封沉管接头的可反复折叠M形橡胶止水带属于有机高分子材料
-
18、实验室分析仪器是探索微观世界的眼睛。下列对分析仪器重要部件的推测不正确的是A、X射线衍射仪的氧化铝X射线管:是两性氧化物 B、分光光度计的分光棱镜:可使用Si单质制作 C、核磁共振分析仪的铌钛线圈:属于金属材料 D、红外光谱仪的高压氦氖激光源:产生激光与电子跃迁有关
-
19、传统工艺承古韵,非遗文化见风采。下列非遗文化产品中,主要材质为无机非金属材料的是


A.开平灰塑
B.新会葵扇


C.新会陈皮
D.白沙茅龙笔
A、A B、B C、C D、D -
20、有机化合物 G 可用于治疗神经系统疾病,人工合成路线如下:
 (1)、H 中官能团的名称为。(2)、B→D 的反应类型为。(3)、的另一种产物的分子式为C7H8O,则结构简式为。(4)、G(填“存在”或“不存在”)顺反异构现象。(5)、C 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
(1)、H 中官能团的名称为。(2)、B→D 的反应类型为。(3)、的另一种产物的分子式为C7H8O,则结构简式为。(4)、G(填“存在”或“不存在”)顺反异构现象。(5)、C 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①能发生银镜反应
②分子中含有3个甲基
③分子中含有4种不同化学环境的氢原子
(6)、写出以CH3CH2OH和 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。