相关试卷
-
1、化工厂烟气中的SO2 , 会对空气造成一定程度的污染。用ZnO浆料吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。
已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、、的物质的量分数随pH的分布如图−1所示。
 (1)、搅拌下向氧化锌浆料中匀速缓慢通入SO2气体。
(1)、搅拌下向氧化锌浆料中匀速缓慢通入SO2气体。①下列操作一定能提高氧化锌浆料吸收SO2效率的有 (填序号)。
A.加快搅拌速率 B.水浴加热氧化锌浆料
C.通过多孔球泡向氧化锌浆料中通SO2 D.降低通入SO2气体的速率
②在开始吸收的40 min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图−2)。溶液pH几乎不变阶段,主要产物是(填化学式)。
 (2)、O2催化氧化。其他条件相同时,pH在6~8范围内,pH增大,浆料中ZnSO3的氧化速率增大,其主要原因是。(3)、氧化锌晶体的一种晶胞结构如图−3所示,O2-位于Zn2+构成的(填“四面体空隙”、“六面体空隙”或“八面体空隙”)中。若晶体中部分O原子被N原子替代后可以改善晶体的性能,Zn-O中离子键成分的百分数大于Zn-N键,原因是。
(2)、O2催化氧化。其他条件相同时,pH在6~8范围内,pH增大,浆料中ZnSO3的氧化速率增大,其主要原因是。(3)、氧化锌晶体的一种晶胞结构如图−3所示,O2-位于Zn2+构成的(填“四面体空隙”、“六面体空隙”或“八面体空隙”)中。若晶体中部分O原子被N原子替代后可以改善晶体的性能,Zn-O中离子键成分的百分数大于Zn-N键,原因是。 (4)、Zn、Fe及其化合物在生产、生活中应用比较广泛。工业上利用锌焙砂(主要含ZnO、ZnFe2O4 , 还含有少量FeO和CuO等杂质)制取金属锌的工艺流程如下:
(4)、Zn、Fe及其化合物在生产、生活中应用比较广泛。工业上利用锌焙砂(主要含ZnO、ZnFe2O4 , 还含有少量FeO和CuO等杂质)制取金属锌的工艺流程如下: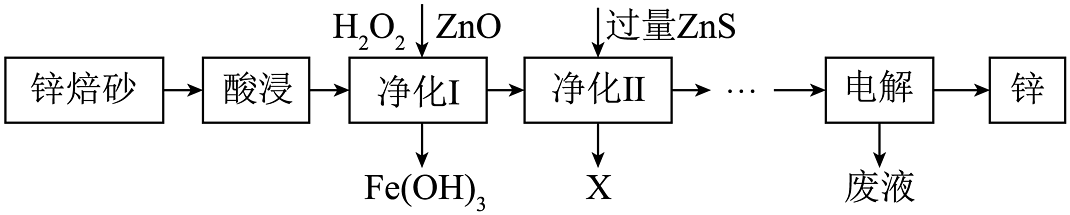
①若净化后的溶液中Cu2+浓度为1×10-12mol·L-1 , 则净化后溶液中Zn2+浓度为[已知:室温下Ksp(ZnS)=1.6×10-24 , Ksp(CuS)=6.4×10-36]。
②ZnFe2O4是一种性能优良的软磁材料,工业上常利用ZnFe2(C2O4)3·6H2O隔绝空气加热分解制备,该晶体的热分解化学方程式为。
-
2、室温下,用0.5mol·L-1Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知Ksp(CaSO4)=5×10-5 , Ksp(CaCO3)=3×10-9。下列说法正确的是A、0.5mol·L-1Na2CO3溶液中存在:2c(Na+)=c(CO)+c(HCO)+c(H2CO3) B、过滤后所得清液中一定存在:c(Ca2+)=且c(Ca2+)≤ C、反应CaSO4+COCaCO3+SO正向进行,需满足>×104 D、滤渣中加入醋酸发生反应的离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O
-
3、室温下,探究溶液的性质,下列实验探究方案能达到探究目的的是
选项
探究目的
探究方案
A
溶液中是否含有
向溶液中加入稍过量较浓的NaOH溶液,加热,将湿润的蓝色石蕊试纸放在试管口,观察试纸颜色变化
B
是否有还原性
向溶液中滴加几滴酸性溶液,观察溶液颜色变化
C
溶液中是否含有
向溶液中加入溶液,观察沉淀产生情况
D
是否水解
向溶液中滴加几滴甲基橙试液,观察溶液颜色变化
A、A B、B C、C D、D -
4、在指定条件下,下列选项所示的物质间转化不能实现的是A、(浓) B、 C、 D、(浓)
-
5、抗阿尔茨海默病药物多奈哌齐的部分合成路线如下,下列说法正确的是
 A、1mol X最多能与3 mol H2反应 B、Y存在顺反异构体且所有碳原子可能共平面 C、Z既能与NaOH溶液反应又能与盐酸反应 D、可用酸性KMnO4溶液鉴别X和Y两种物质
A、1mol X最多能与3 mol H2反应 B、Y存在顺反异构体且所有碳原子可能共平面 C、Z既能与NaOH溶液反应又能与盐酸反应 D、可用酸性KMnO4溶液鉴别X和Y两种物质 -
6、阅读下面的材料,完成下面小题
电池有铅蓄电池、燃料电池、锂离子电池等,它们可以将化学能转化为电能。NH3、CH4、NaBH4都可用作燃料电池的燃料。CH4的燃烧热为890.3 kJ·mol-1。电解则可以将电能转化为化学能,电解饱和NaCl溶液可以得到Cl2 , 用电解法可制备消毒剂高铁酸钠(Na2FeO4)。
(1)、下列说法正确的是A、BH中存在配位键 B、SO的空间构型为平面正方形 C、NH中的键角比NH3中的小 D、HClO中心原子的轨道杂化类型为sp2(2)、下列化学反应表示正确的是A、铅蓄电池的正极反应:Pb-2e-+SO=PbSO4 B、电解饱和NaCl溶液:2Na++2Cl-2Na+Cl2↑ C、CH4燃烧热:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 D、一定条件下NO2与NH3的反应:6NO2+8NH37N2+12H2O(3)、下列物质结构与性质或物质性质与用途具有对应关系的是A、LiOH可溶于水,可用作宇宙飞船中CO2吸收剂 B、氨极易溶于水,液氨可用作制冷剂 C、H2O分子之间形成氢键,的热稳定性比的高 D、Na2FeO4具有强氧化性,可用于杀菌、消毒 -
7、侯氏制碱法工艺流程中的主反应为: , 下列说法正确的是A、原子半径:H<C<N B、电负性:Na<H<Cl C、键角:CO2>H2O>NH3 D、第一电离能: C<N<O
-
8、下列说法正确的是


①
②


③
④
A、图①操作可从溶液中提取晶体 B、图②装置可用于实验室制取 C、图③装置可用于铜与浓硫酸反应并检验气态产物 D、图④装置可用于酒精萃取碘水中的碘单质 -
9、下列化学用语表述错误的是A、的电子式:
 B、Cl的原子结构示意图为:
B、Cl的原子结构示意图为: C、基态N原子的价层电子排布图:
C、基态N原子的价层电子排布图: D、NH3分子的VSEPR模型:
D、NH3分子的VSEPR模型:
-
10、
随着生活水平的提升,人们的卫生意识日益增强,消毒剂已走进千家万户,项目小组选择了两款市面上常见的含氯消毒剂进行制备和研究。
I.是一种高效广谱消毒剂,可有效灭活多种细菌病毒,极易溶于水,在碱性环境中稳定性较差,易分解,体积分数大于10%时可能爆炸,故工业上常用和NaOH混合溶液吸收 , 将其转化为便于运输保存,项目小组1查阅资料设计实验制备 , 装置和药品如下:

已知:①熔点-59℃,沸点11℃;②具有还原性,易被氧化,与浓硫酸反应会产生二氧化硫;③ORP是反映水溶液中所有物质表现出来的氧化-还原性,ORP值越大,氧化性越强。
请回答下列问题:
(1)用化学方程式表示装置B中发生的主要反应。
(2)装置B中须稍微过量,目的是。
(3)装置C中,和NaOH与反应制取的离子方程式为。
II.项目小组2探究84消毒液的性质,实验如下:
(4)若在制备84消毒液时,生成的产物中 , 则产物中=。
(5)①取少量84消毒液于试管中,滴加过氧化氢溶液,发现有大量气泡产生,写出相应的化学方程式。
②向2mL 84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
③向2mL 84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
④测得84消毒液在不同温度时ORP随时间的变化曲线如图所示。

(6)实验②③现象不同的原因是 , 由实验④可得不同温度下ORP值不同的原因可能是。
(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义为每克含氯消毒剂的氧化能力相当于多少克的氧化能力。以上三种含氯消毒剂、、NaClO,还原产物均为 , 这三种含氯消毒剂的有效氯含量由大到小的顺序为。
III.测定二氧化氯漂白液中的浓度,步骤如下:
①量取2.5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再向其中加入过量KI溶液,发生反应:;
②加入指示剂,向其中逐滴加入0.10的溶液至恰好完全反应,消耗溶液10mL,其中发生的反应为。
(8)该二氧化氯漂白液中的物质的量浓度为。
-
11、明矾[]在生产、生活中有广泛用途:饮用水的净化、造纸工业上作施胶剂、食品工业的发酵剂等。利用炼铝厂的废料一铝灰(含Al、及少量和)可制备明矾,工艺流程如图,回答下列问题:
 (1)、明矾净水的原理是(用离子方程式表示)。(2)、操作I是 , 操作II是蒸发浓缩、、过滤、洗涤、干燥。(3)、已知:在存在且加热条件下,可与反应生成 , 那么加入发生反应的离子方程式为。(4)、“酸浸”步骤需9mol/L溶液90mL,若由18mol/L浓溶液配制,则需浓溶液的体积为mL,配制所需的玻璃仪器除量筒(用于粗略量取18mol/L溶液的体积)、烧杯、玻璃棒外还有。下列操作会引起所配溶液浓度偏低的有(填字母)。
(1)、明矾净水的原理是(用离子方程式表示)。(2)、操作I是 , 操作II是蒸发浓缩、、过滤、洗涤、干燥。(3)、已知:在存在且加热条件下,可与反应生成 , 那么加入发生反应的离子方程式为。(4)、“酸浸”步骤需9mol/L溶液90mL,若由18mol/L浓溶液配制,则需浓溶液的体积为mL,配制所需的玻璃仪器除量筒(用于粗略量取18mol/L溶液的体积)、烧杯、玻璃棒外还有。下列操作会引起所配溶液浓度偏低的有(填字母)。A.用量筒量取浓硫酸溶液后未洗涤量筒
B.容量瓶未干燥就用来配制溶液
C.用胶头滴管加水定容时仰视刻度线
D.烧杯中稀溶液往容量瓶转移时,有少量液体溅出
(5)、为测定该明矾晶体样品中的含量,该实验小组称取a g明矾晶体样品溶于50mL稀盐酸中,加入足量溶液,使完全沉淀。用质量为m g的漏斗进行过滤,洗净滤渣后,将漏斗和滤渣一并干燥至恒重,测得质量为n g。该明矾晶体样品中的含量为(即每克明矾晶体中的物质的量)。 -
12、回答下列问题。(1)、现有以下物质:①酒精、②液态HCl、③固体、④熔融KCl、⑤蔗糖、⑥铜、⑦、⑧盐酸,其中属于电解质的有 , 属于非电解质的是 , 能导电的是。(2)、某元素R与形成的阴离子中,共含有x个电子,R原子的质量数为A,则一个该离子含有的中子数目是。(3)、漂白粉在使用时需加水浸泡片刻,才能发挥更好的漂白效果,请用化学方程式写出相应的反应原理。(4)、把V mL含有和的混合溶液分成两等份,一份加入含足量NaOH的溶液并加热,铵根离子完全反应生成a mol (已知);另一份加入含b mol 的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中的浓度为。(5)、某混合物由NaCl、、组成,已知Na、Mg、Al三元素的质量之比为46:12:27,含1.2mol 的该混合物中,的质量为。
-
13、有下列三个在溶液中发生的氧化还原反应:
①
②
③
请根据上述反应分析推断,下列说法不正确的是
A、、、、的还原性由强到弱依次是 B、③反应中HCl的作用有还原性和酸性,氧化剂和起还原剂作用的HCl的数目之比1:6 C、向溶液中通入少量反应的离子方程式可能为 D、常用将酸性废液中的还原成 , 反应的离子方程式为 -
14、配制450mL 0.100的NaCl溶液,部分实验操作示意图如下:

下列说法正确的是
A、实验中需用的仪器有天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等 B、上述实验操作步骤的正确顺序为①②④③ C、容量瓶用蒸馏水洗涤,必须干燥后才可用 D、定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低 -
15、已知X、Y、Z、W四种元素中,X元素原子核内没有中子;Y元素原子的最外层电子数是次外层电子数的3倍;Z元素原子失去1个电子后的电子层结构与氖原子相同,W元素原子得到1个电子后的电子层结构与氩原子相同。下列说法正确的是A、X元素的原子不存在同位素现象 B、Y单质具有强氧化性 C、Z单质和W单质反应产生白色烟雾 D、W元素在自然界以游离态形式存在
-
16、下列实验中,所选装置能达到实验目的的是
 A、用装置①除去NaCl溶液中的Fe(OH)3胶体 B、用装置②蒸干氯化锰溶液制MnCl2·4H2O C、用装置③选取乙醇做萃取剂萃取溴水中的溴 D、用装置④从碘的四氯化碳溶液中回收CCl4
A、用装置①除去NaCl溶液中的Fe(OH)3胶体 B、用装置②蒸干氯化锰溶液制MnCl2·4H2O C、用装置③选取乙醇做萃取剂萃取溴水中的溴 D、用装置④从碘的四氯化碳溶液中回收CCl4 -
17、根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
向淀粉碘化钾溶液中通入少量氯气,溶液变蓝
氧化性:
B
向溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊
溶液中一定有
C
用铂丝蘸取某溶液在火焰上灼烧,火焰的颜色为黄色
该溶液是钠盐
D
向溶液中滴加 , 溶液褪色
具有氧化性
A、A B、B C、C D、D -
18、设NA为阿伏加德罗常数的值,下列说法正确的是A、等体积、等物质的量浓度的NaCl、KCl溶液,两种溶液中阴、阳离子数目之和均为2NA B、100g46%的乙醇(C2H5OH)溶液中含有氧原子的数目为NA C、NO2和N2O4组成的46g混合气体中含有的原子数目为3NA D、1 mol Cl2和1 mol Fe加热充分反应,转移的电子数目为3NA
-
19、下列说法正确的一组是
①、MgO、均属于碱性氧化物
②海水、空气、胆矾、盐酸均为混合物
③已知氧化铝在熔融状态下能导电,则氧化铝在熔融状态下能电离
④苏打、碱石灰、醋酸、小苏打均为电解质
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
A、①②④ B、③④⑤ C、③⑤ D、②③ -
20、化学与生活密切相关。下列说法正确的是A、“84”消毒液具有强氧化性,能用于饮用水杀菌消毒 B、氯气泄露,可用浸有NaOH溶液的毛巾捂住口鼻,逃离现场 C、放映机到银幕间产生光柱是因为丁达尔效应 D、用盐酸除铁锈,是因为溶于水后,其溶液显碱性