相关试卷
-
1、中国“祝融号”火星探测器探测发现火星上存在矿物。该物质所含元素属于第二周期的是A、Mg B、Si C、Fe D、O
-
2、甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g)⇌CH3OH(g)。(1)、CO的平衡转化率与温度、压强的关系如图所示。
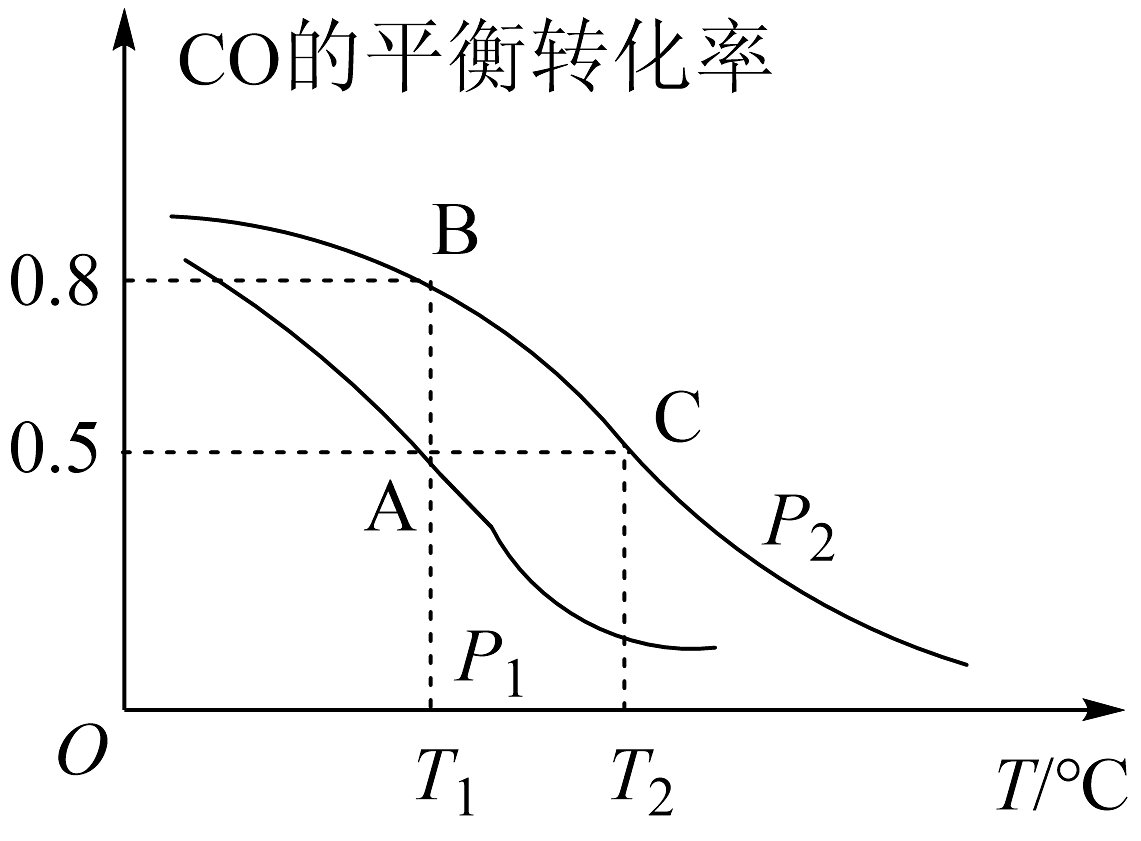
①p1、p2的大小关系是p1p2(填“>”“<"或"=”)。
②A、B、C三点的平衡常数KA、KB、Kc的大小关系是。
③下列叙述能说明上述反应能达到化学平衡状态的是(填字母)。
a.2v正(H2)=v逆(CH3OH)
b.CH3OH的体积分数不再改变
c.混合气体的平均摩尔质量不再改变
d.同一时间内,消耗0.04molH2 , 生成0.02molCO
(2)、在T2℃、p2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。①平衡时H2的体积分数是;平衡后再加入1.0molCO后重新到达平衡,则CO的转化率(填“增大""不变”成“减小”),CO与CH3OH的浓度比(填"增大”“不变"或“减小")。
②若以不同比例投料,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)v(逆)(填“”“<"或“=”)。
③若p2压强恒定为p,则平衡常数Kp=(Kp用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
-
3、甲醇是一种重要的化工原料,具有广阔的开发和应用前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇(CH3OH)。(1)、已知一定条件下,发生反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH1= -41.2 kJ/mol,CH3OH(g)+H2O(g)CO2(g)+3H2(g) ΔH2= +49.5 kJ/mol,该条件下,水煤气转化成甲醇的热化学方程式是 。
在体积可变的恒压密闭容器中投入0.5 mol CO和0.75 mol H2 , 不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量(n)随温度(T)、压强(p)的变化如图1所示。
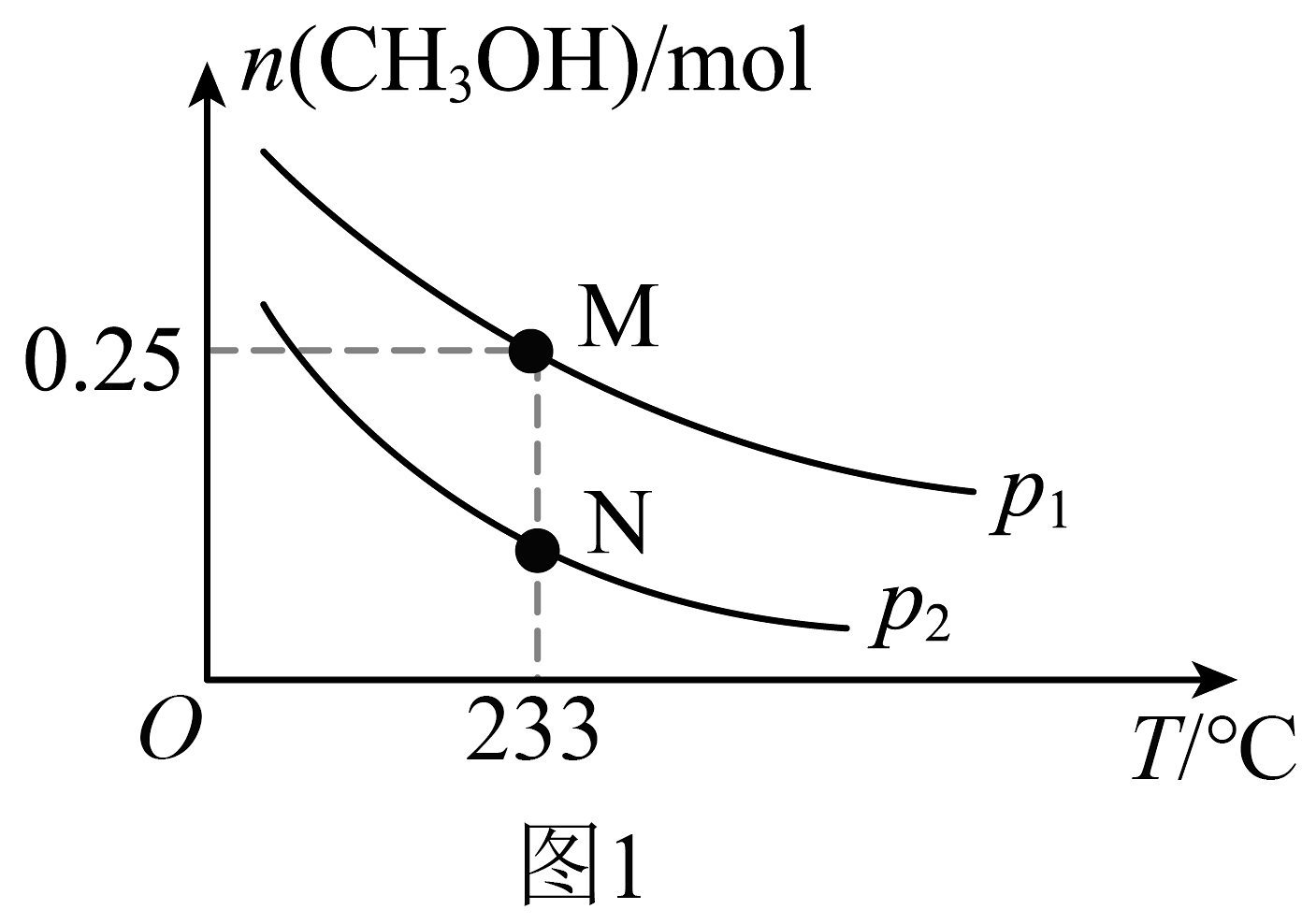 (2)、M点对应的平衡混合气体的体积为1 L,则233℃时,求反应的平衡常数K。(写出计算过程)(3)、工业上可利用甲醇茾基化法进一步制取甲酸甲酯:CH3OH(g)+CO (g)⇌HCOOCH3(g)。在容积不变的密闭容器中,投入等物质的量的CH3OH(g)和CO (g),在相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
(2)、M点对应的平衡混合气体的体积为1 L,则233℃时,求反应的平衡常数K。(写出计算过程)(3)、工业上可利用甲醇茾基化法进一步制取甲酸甲酯:CH3OH(g)+CO (g)⇌HCOOCH3(g)。在容积不变的密闭容器中,投入等物质的量的CH3OH(g)和CO (g),在相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。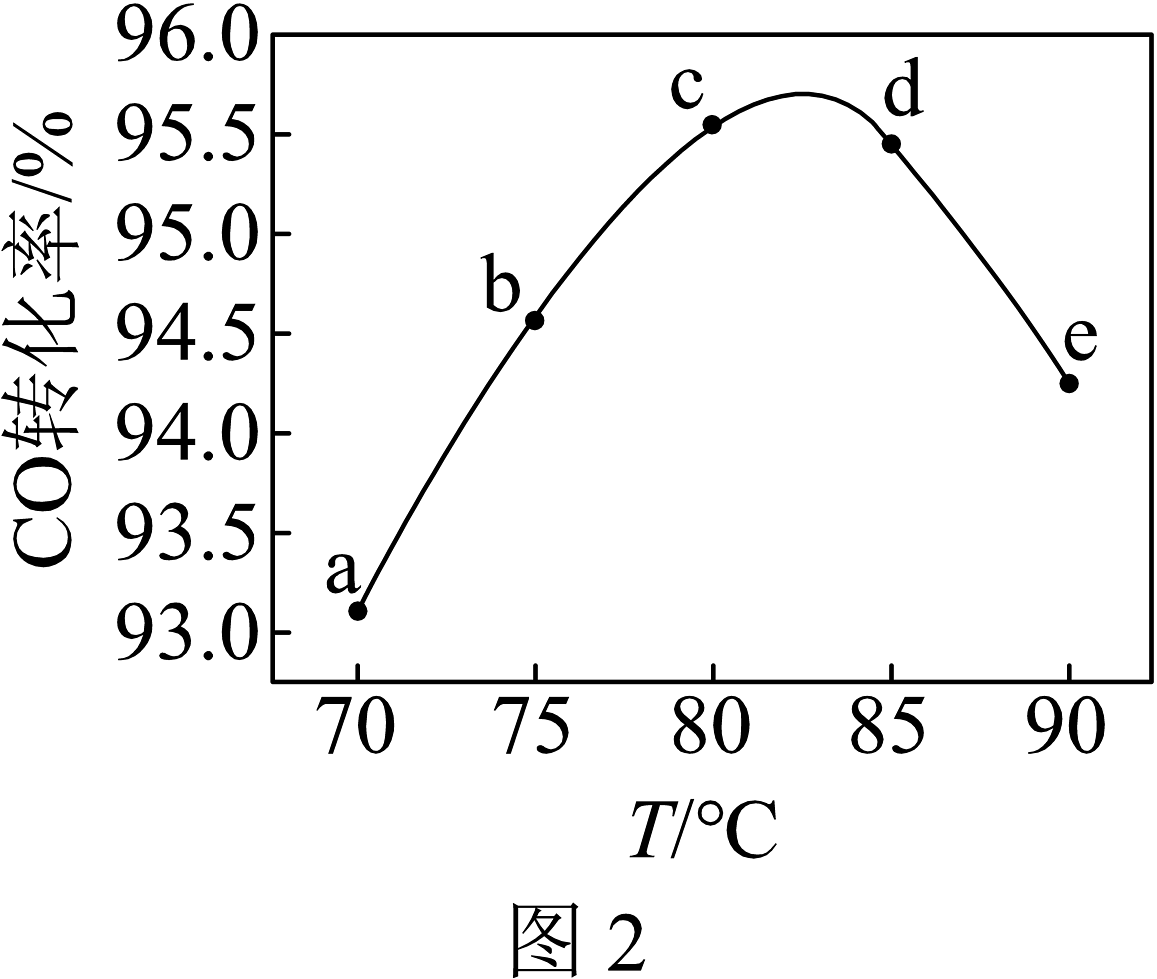
①b、c、d三点中,尚未达到化学平衡状态的点是。
②该反应是 (填“放热”或“吸热”)反应。
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由。
-
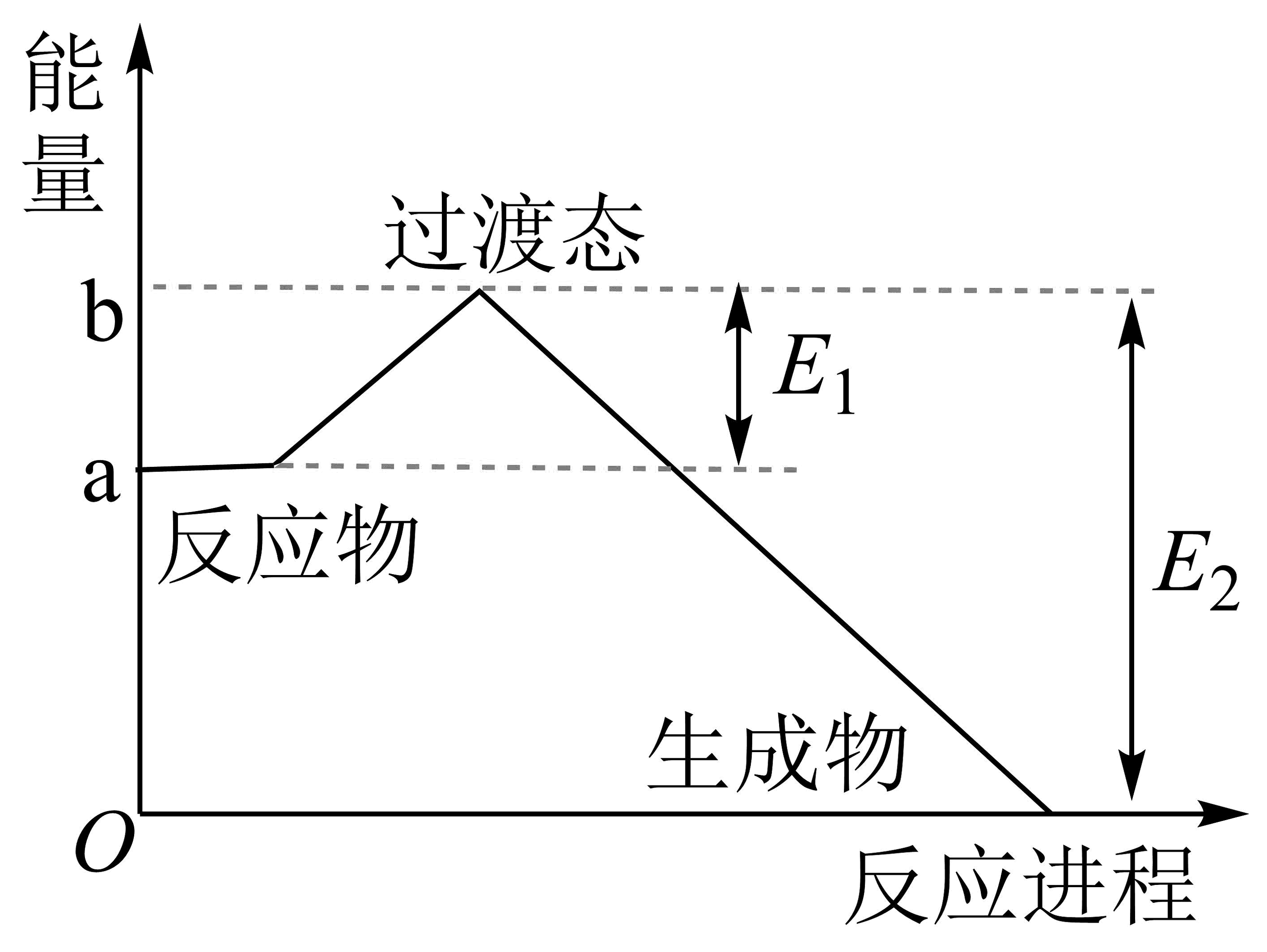
4、完成下列问题(1)、20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态,下图为是NO2和CO反应生成CO2和NO过程中能量变化示意图。在反应体系中加入正催化剂,E1和E2的变化是:E1 , E2(填“增大”、“减小”或“不变”),对反应热是否有影响?。
 (2)、中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(2)、中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题: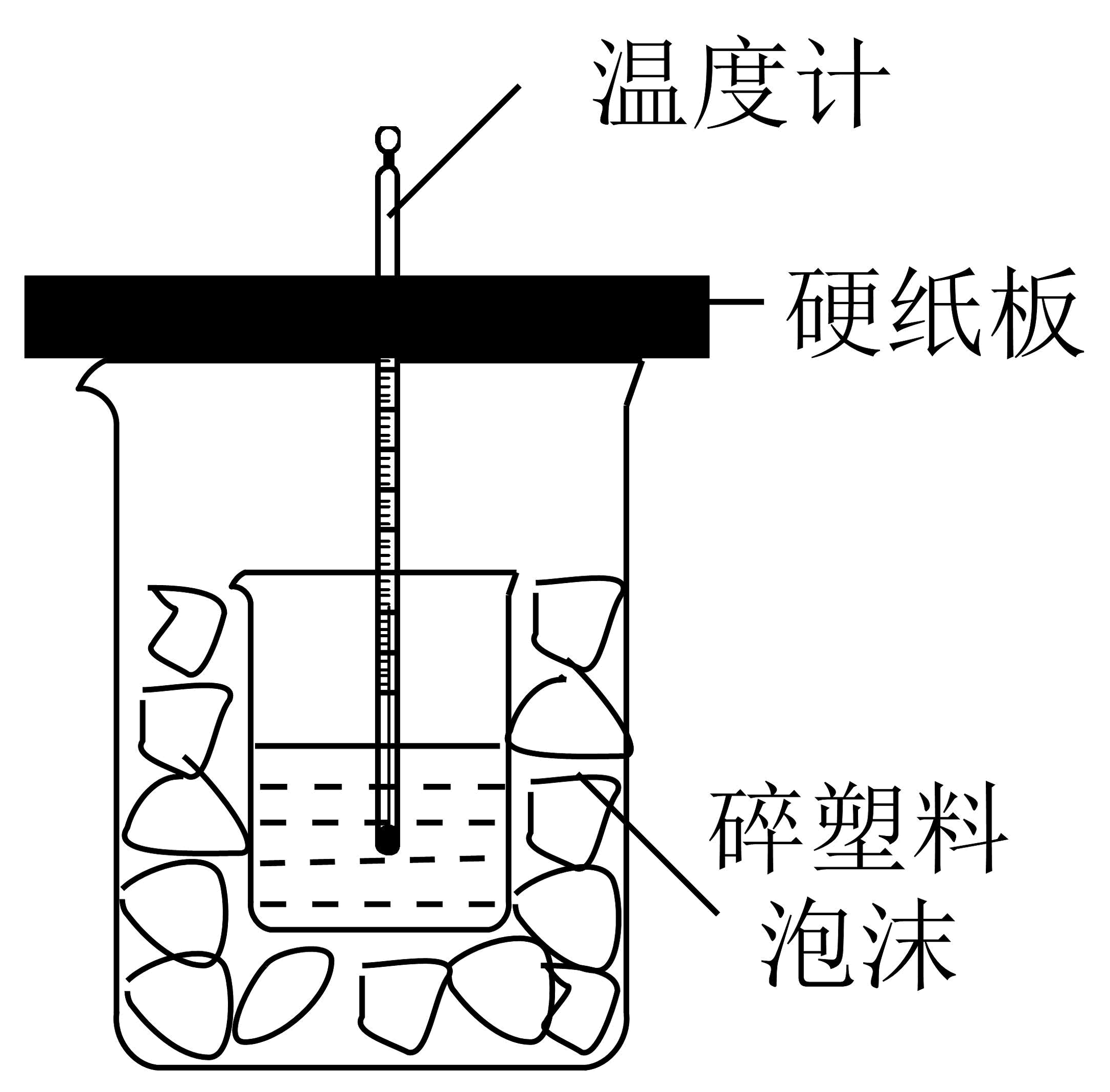
①从实验装置看,烧杯间填满碎塑料泡沫的作用是。
②大烧杯上如不盖硬纸板,则求得的中和热数值(填“偏大”、“偏小”、“无影响”)
③实验中改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热的数值(填“相等”或“不相等”)。
-
5、某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
实验编号
实验温度/℃
试管中所加试剂及其用量/mL
0.6 mol/LH2C2O4溶液
H2O
3 mol/L稀H2SO4溶液
0.05 mol/L KMnO4溶液
①
25
3.0
V1
2.0
3.0
②
25
2.0
3.0
2.0
3.0
③
30
2.0
V_2
2.0
3.0
(1)、该实验的原理是(用化学方程式表示):2KMnO4+5 H2C2O4+3 H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。该实验还需要测量的数据是。(2)、V1= , V2=。(3)、探究温度对化学反应速率的影响,应选择实验(填实验编号)。(4)、若实验①用时1.5 min则第一组实验的化学反应速率(用草酸表示)为。(5)、某同学绘制了瞬时速率和时间的图像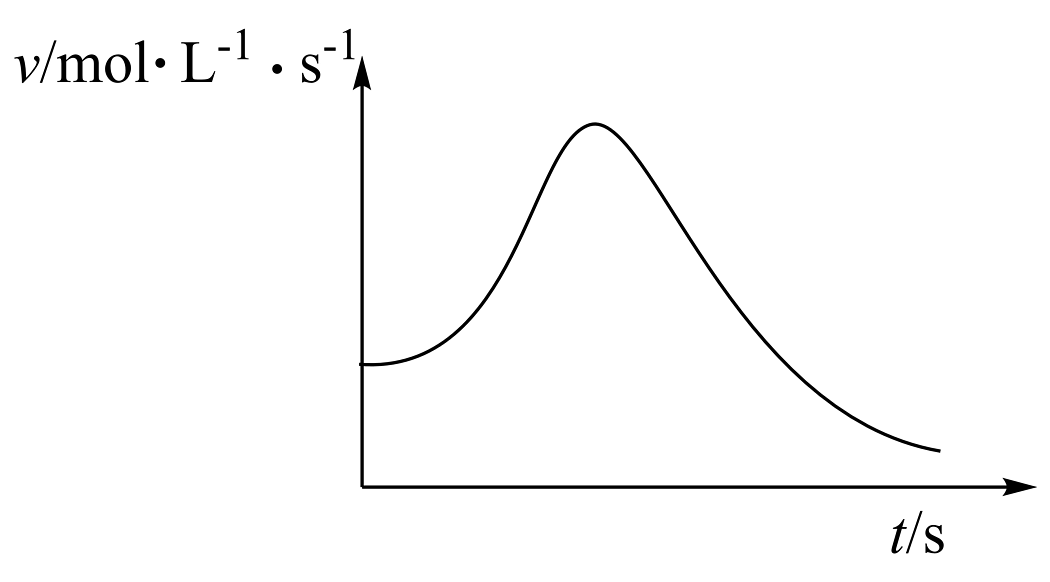
①该同学提出猜想
猜想a:温度上升导致速率快速上升
猜想b:反应产生了催化剂
该同学发现该反应前后体系温度上升了0.5℃,因此不成立(猜想a或猜想b)。
②该同学推测可能的催化剂是(填物质化学式)。
③验证猜想的方法是。
-
6、恒容密闭容器中,反应在不同温度下达到平衡时,各组分的物质的量如图所示。下列说法错误的是
 A、该反应的 B、为随温度的变化曲线 C、向平衡体系中充入惰性气体,平衡不移动 D、向平衡体系中加入的平衡转化率减小
A、该反应的 B、为随温度的变化曲线 C、向平衡体系中充入惰性气体,平衡不移动 D、向平衡体系中加入的平衡转化率减小 -
7、在金催化剂表面反应的历程如图所示。
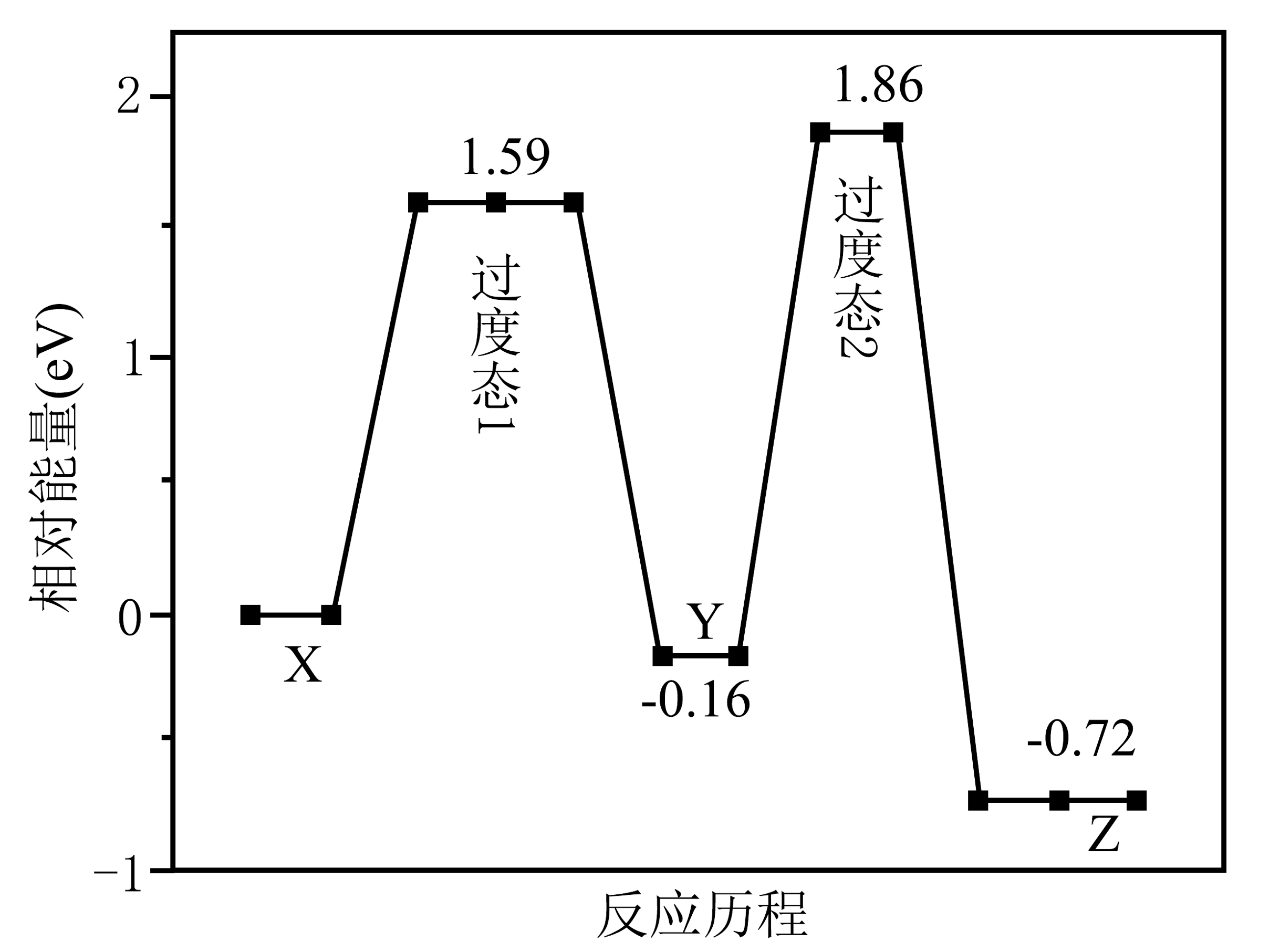
下列叙述错误的是
A、总反应分两步进行 B、总反应的 C、是中间产物 D、 -
8、合成氨的热化学方程式为 , 下列有关叙述错误的是A、反应物的总能量大于生成物的总能量 B、生成1mol (g)时放出19.3kJ的热量 C、形成化学键放出的总能量大于断裂化学键吸收的总能量 D、将1mol (g)与3mol (g)置于密闭容器中充分反应后放出热量为38.6kJ
-
9、对于可逆反应A(g)+3B(s)⇌2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是A、v(C)=0.2 mol·L-1·s-1 B、v(B)=0.4 mol·L-1·s-1 C、v(D)=6 mol·L-1·min-1 D、v(A)=5 mol·L-1·min-1
-
10、基本概念和理论是化学思维的基石。下列叙述错误的是A、理论认为模型与分子的空间结构相同 B、元素性质随着原子序数递增而呈周期性变化的规律称为元素周期律 C、泡利原理认为一个原子轨道内最多只能容纳两个自旋相反的电子 D、杂化轨道由1个s轨道和3个p轨道混杂而成
-
11、下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
①
②
③
④
⑤
⑥
⑦
⑧
(1)、元素Cs在周期表中的位置是 , ⑤的阳离子结构示意图为。(2)、元素Se在周期表中的位置如上方周期表所示,预测具有一定性(填写“氧化”、“还原”或“氧化和还原”)。Se与⑦的简单氢化物稳定性较强的是(填写化学式)。(3)、在元素周期表中,存在对角线相似,即某些主族元素与其右下方的主族元素的性质相似的(如锂和镁,铍和铝)。根据周期表对角线规律,金属Be单质及其化合物的性质与铝单质及其化合物的性质相似。写出Be与NaOH溶液反应的离子方程式________。(4)、M同学利用下图探究N、C、Si的非金属性大小,试剂X是________。 (5)、单质①在单质⑧中安静燃烧,火焰呈________色,可以证明燃烧反应不一定需要氧气参加。(6)、写出一条能证明④的非金属性强于③的实验事实________。
(5)、单质①在单质⑧中安静燃烧,火焰呈________色,可以证明燃烧反应不一定需要氧气参加。(6)、写出一条能证明④的非金属性强于③的实验事实________。 -
12、
I.实验小组利用传感器探究和的性质。
【查阅资料】越小,浓度越小,溶液碱性越弱。
【实验过程】
编号
实验操作
实验数据
实验①
测量下述实验过程的温度变化


实验②
测量下述实验过程的变化


【分析与解释】
(1)实验①中,溶解时吸收热量的物质是________。(填化学式)
(2)实验②中,未参与该反应的实验证据是________。
(3)实验②中,滴加溶液的pH变化与滴加溶液的有明显差异,原因是滴加溶液的烧杯中,参与反应的离子有________。
(4)工业上制得的纯碱中常含有一定量的 , 取质量为5.00g的纯碱样品,充分加热后,质量减少0.155g,此样品中的质量分数________。(保留3位有效数字)
II.可用和制备漂粉精,漂粉精常用于游泳池的消毒。已知微生物的细胞膜表面是带有负电荷的,池水的酸碱性对漂粉精的消毒效果影响明显。
(5)写出制备漂粉精的化学方程式________。
(6)新制氯水中,能透过细胞膜起消毒杀菌作用的微粒是________(填化学式),若池水碱性过强,消毒作用会________(填“增强”或“减弱”)。
(7)若池水酸性过强,会刺激眼睛和皮肤。有时加入小苏打以降低酸性,起到降低酸性作用的离子方程式是________。
-
13、明矾[]在造纸、净水等方面应用广泛,实验室以铝灰为原料制各明矾的流程下图所示。

已知:①铝灰含、为和少量;
②不溶于强酸;
③氨水的主要成分是 , 是一元弱城,其电离方程式:
④不同温度的溶解度:
温度/℃
0
10
20
30
40
60
80
90
/g
3.00
3.99
5.90
8.39
11.7
24.8
71.0
109
回答下列问趣:
(1)、“酸漫”后溶液中主要的金属离子有、。“滤渣I”的主要成分为。(填化学式)(2)、①“氧化”过程中的作用是(用离子方程式表示)。②的“氧化效率”与温度的关系如图所示,试解释温度过高,“氧化效率”降低的可能原因是。
 (3)、溶液的pH对铝、铁沉淀率的影响如图所示。“调pH”时应控制溶液的pH范围为________。(填编号)
(3)、溶液的pH对铝、铁沉淀率的影响如图所示。“调pH”时应控制溶液的pH范围为________。(填编号)
A.3.0~3.5 B.4.0~4.5 C.4.5~5.0
(4)、若某工厂研究小组为了避免滤液中含有 , 干扰明矾的制备,在“沉铝”中选择加入溶液至过量,发现铝沉淀量减少,原因是________(用离子方程式表示)。(5)、得到明矾晶体的“系列操作”包括、、过滤、洗涤、干燥。 -
14、实验制备收集干燥纯净的氯气,并探究其性质。所用仪器及药品如图所示:
 (1)、上述实验制取氯气的离子反应方程式为________。(2)、选择上述仪器制备收集干燥纯净的氯气,并按顺序连接(填各接口处的字母):a________i。(3)、如下图所示,在A处缓慢通入干燥的氯气。当打开B处的弹簧夹时,C处的红布条看不到明显现象;当关闭B处的弹簧夹后,C处的红布条逐渐褪色。则D瓶中盛放的溶液可能是___________。(填编号)
(1)、上述实验制取氯气的离子反应方程式为________。(2)、选择上述仪器制备收集干燥纯净的氯气,并按顺序连接(填各接口处的字母):a________i。(3)、如下图所示,在A处缓慢通入干燥的氯气。当打开B处的弹簧夹时,C处的红布条看不到明显现象;当关闭B处的弹簧夹后,C处的红布条逐渐褪色。则D瓶中盛放的溶液可能是___________。(填编号) A、饱和溶液 B、浓溶液 C、足量溶液 D、浓硫酸(4)、某学习小组拟用手持技术对新制饱和氯水进行检测,下列图像变化最不可能的是___________。(填编号)
A、饱和溶液 B、浓溶液 C、足量溶液 D、浓硫酸(4)、某学习小组拟用手持技术对新制饱和氯水进行检测,下列图像变化最不可能的是___________。(填编号) A、图1说明光照使氯水的酸性增强,新制氯水需避光保存 B、图2说明久置的氯水失去漂白能力 C、电导率是表示物质传输电流能力强弱的一种测量值,图3表示氯水的电导率随时间的变化趋势 D、图4说明光照时氯水中的某种成分分解产生氧气(5)、是一种灰黑色的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:取一定量的溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设。
A、图1说明光照使氯水的酸性增强,新制氯水需避光保存 B、图2说明久置的氯水失去漂白能力 C、电导率是表示物质传输电流能力强弱的一种测量值,图3表示氯水的电导率随时间的变化趋势 D、图4说明光照时氯水中的某种成分分解产生氧气(5)、是一种灰黑色的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:取一定量的溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设。假设1:被氧化
假设2:被氧化。
请你完成下表,验证假设:
实验操作
预期现象
得出结论
甲组
取少量黄色溶液于A试管中,滴加几滴淀粉溶液
①
假设1成立
乙组
取少量黄色溶液于B试管中,滴加几滴②
溶液变红
假设2成立
③甲组同学得出结论“可将氧化”,其反应的离子方程式为。
④丙组同学认为乙组实验不够严谨:加入少量的氯水,只能与还原性强的离子先反应;
丙组改进了实验:用煮沸冷却后的水配制溶液,向溶液中先加入煤油,再于液面下依次加入少量新制氯水和试剂②,溶液不变红,证明假设2不成立,证明了还原性:(填“>”、“<”或“=”),煮沸的作用是。
-
15、下列实验操作对应的现象和结论均正确的是
选项
实验操作
现象
结论
A
往某溶液中滴加酸性溶液
溶液紫色褪去
该溶液一定含
B
向盛有溶液的烧杯中滴加足量溶液,并用红色激光笔照射烧杯中液体
产生一条光亮的“通路”
生成氢氧化铁胶体
C
含有杂质的溶液进行焰色试验
直接观察火焰显黄色
溶液一定有
D
向粉末中加入过量浓盐酸
黑色粉末溶解,溶液呈黄绿色
属于碱性氧化物
A、A B、B C、C D、D -
16、下列各组澄清透明的溶液中,可以大量共存的离子组是A、 B、 C、 D、
-
17、下图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
 A、X元素只有一种氢化物 B、原子半径:W>Z C、最高价氧化物的水化物的酸性:R>W D、单质的沸点:Y>R
A、X元素只有一种氢化物 B、原子半径:W>Z C、最高价氧化物的水化物的酸性:R>W D、单质的沸点:Y>R -
18、部分含氯物质的分类与相应化合价关系如下图所示。下列说法正确的是
 A、液态的a中存在自由移动的离子 B、在充满b的集气瓶中安静地燃烧,发出苍白色火焰,瓶口出现白烟 C、c只有氧化性 D、可存在a→b→d→a的循环转化关系
A、液态的a中存在自由移动的离子 B、在充满b的集气瓶中安静地燃烧,发出苍白色火焰,瓶口出现白烟 C、c只有氧化性 D、可存在a→b→d→a的循环转化关系 -
19、每年10月23日上午6:02到晚上6:02被誉为“摩尔日”,这个时间的一种写法为6:02 10/23,形式与阿伏加德罗常数近似值相似。用代表阿伏加德罗常数的值,下列说法正确的是A、溶液中数目为 B、标准状况下,中含有质子数为 C、23gNa与足量反应生成的分子数目为 D、在中燃烧生成转移的电子数目为
-
20、下列陈述I与陈述Ⅱ均正确,且具有因果关系的是
选项
陈述I
陈述Ⅱ
A
分别加热和固体,试管内壁都有水珠
两种物质均受热分解
B
工人将模具干燥后再注入熔融钢水
铁与高温下会反应
C
钠钾合金作核反应堆的传热介质
碱金属化学性质活泼
D
久置空气中的漂白粉遇盐酸产生
漂白粉的有效成分是
A、A B、B C、C D、D