相关试卷
-
1、下列说法正确的是A、、、由气态到固态,是因为共价键越来越强 B、HI溶于水能电离出、 , 所以HI是离子化合物 C、的性质很稳定,与水分子间存在氢键有关 D、化合物中含有离子键、非极性共价键
-
2、Se、Br两种元素的部分信息如图所示,下列说法正确的是( )
 A、原子半径:Br>Se>P B、还原性:S2->Se2->Br- C、Se在元素周期表中位于第四周期ⅥA族 D、Se、Br位于同一主族
A、原子半径:Br>Se>P B、还原性:S2->Se2->Br- C、Se在元素周期表中位于第四周期ⅥA族 D、Se、Br位于同一主族 -
3、已知、、 , 且氧化性强弱顺序是。在和混合溶液中,通入一定量 , 溶液中存在的离子不合理的是A、、、 B、、、 C、、、 D、、、、
-
4、酸碱质子理论:凡是能够释放质子()的任何含氢原子的分子或离子都是酸;凡是能与质子结合的分子或离子都是碱。按照酸碱质子理论,下列粒子既可以看作酸又可以看作碱的是A、 B、 C、 D、
-
5、现有4种短周期主族元素X、Y、Z和Q,原子序数依次增大,相关信息见下表。下列说法正确的是
元素
相关信息
X
核外电子总数为1
Y
最高正化合价和最低负化合价之和为零
Z
原子有3个电子层,最外层电子数是最内层电子数的3倍
Q
同周期主族元素中原子半径最小
A、Y与X可形成分子 B、X单质只有还原性,没有氧化性 C、Y、Z、Q最高价氧化物对应水化物的酸性逐渐减弱 D、第四周期且与Q同主族的元素的单质在常温常压下呈固态 -
6、下列实验操作、实验现象和结论均正确且相符的是
选项
实验操作
实验现象
结论
A
将浓硫酸滴到蔗糖表面
固体变黑膨胀
浓硫酸有吸水性
B
向某溶液中滴加溶液
产生白色沉淀
溶液中含有
C
将浓硫酸和铜加热,冷却后用水稀释
产生有刺激性气味的气体,稀释后溶液呈蓝色
浓硫酸既表现氧化性,又表现酸性
D
将足量锌和浓硫酸共热,将气体通入品红溶液
产生有刺激性气味的气体,品红溶液褪色
产生的气体只有
A、A B、B C、C D、D -
7、下列事实中,能说明氯原子得电子能力比硫原子强的是
①盐酸的酸性比氢硫酸(H2S水溶液)酸性强②还原性:Cl-<S2-③Cl2与铁反应生成FeCl3 , 而S与铁反应生成FeS④Cl2能与H2S反应生成S
A、①③④ B、②④ C、②③④ D、①②④ -
8、硫元素的“价—类”二维图如下图所示。下列说法错误的是
 A、a点表示的物质所属的物质类别是单质 B、b点表示的物质可以是 , 也可以是 C、c点表示的物质的浓溶液可作为干燥剂 D、d点表示的可溶性物质能与溶液发生反应
A、a点表示的物质所属的物质类别是单质 B、b点表示的物质可以是 , 也可以是 C、c点表示的物质的浓溶液可作为干燥剂 D、d点表示的可溶性物质能与溶液发生反应 -
9、下列溶液能够鉴别和的是
①紫色石蕊溶液②溶液③酸性溶液④氯水⑤品红溶液
A、①②③ B、②③④ C、②③④⑤ D、①②④⑤ -
10、某实验需用溶液,配制该NaOH溶液的几个关键实验步骤和操作示意图如下。下列说法正确的是
 A、用分析天平和滤纸称取3.6000g氢氧化钠固体 B、NaOH在烧杯中完全溶解后,立即转移到容量瓶中 C、操作①时,若俯视容量瓶的刻度线,则使配得的NaOH溶液浓度偏低 D、上述操作的先后顺序是③②④⑥①⑤
A、用分析天平和滤纸称取3.6000g氢氧化钠固体 B、NaOH在烧杯中完全溶解后,立即转移到容量瓶中 C、操作①时,若俯视容量瓶的刻度线,则使配得的NaOH溶液浓度偏低 D、上述操作的先后顺序是③②④⑥①⑤ -
11、下列物质久置于空气中易发生化学变化的有
①氯水 ②碳酸钠晶体 ③烧碱 ④漂白粉 ⑤过氧化钠 ⑥碳酸氢钠
A、5 种 B、4 种 C、3 种 D、2 种 -
12、设为阿伏加德罗常数的值。下列说法正确的是A、被还原为转移的电子数为 B、1mol Fe溶于过量盐酸,转移的电子数为 C、与所含的硫原子数为 D、过氧化钠与水反应时,生成0.1mol氧气转移的电子数为
-
13、以下是侯式制碱法的简单流程,下列说法不正确的是
 A、反应(2)的化学方程式为 B、操作X为过滤,为增大过滤速率,过滤时用玻璃棒搅拌 C、侯式制碱法的主要原理是相同条件下的溶解度最小 D、溶液B中加入氯化钠粉末,并通入氨,可析出副产品
A、反应(2)的化学方程式为 B、操作X为过滤,为增大过滤速率,过滤时用玻璃棒搅拌 C、侯式制碱法的主要原理是相同条件下的溶解度最小 D、溶液B中加入氯化钠粉末,并通入氨,可析出副产品 -
14、下列俗名与化学式对应的是A、绿矾 B、石膏 C、苛性钠 Na D、芒硝
-
15、某学生利用如图所示的装置对电解质溶液的导电性进行实验探究。下列说法正确的是
 A、闭合开关K,电流表指针发生偏转,证明盐酸是电解质 B、闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流表指针不发生变化 C、闭合开关K,向溶液中加入固体电流表的示数明显减小 D、选取相同质量、相同溶质质量分数的硫酸替换盐酸,电流表的示数不同
A、闭合开关K,电流表指针发生偏转,证明盐酸是电解质 B、闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流表指针不发生变化 C、闭合开关K,向溶液中加入固体电流表的示数明显减小 D、选取相同质量、相同溶质质量分数的硫酸替换盐酸,电流表的示数不同 -
16、工业上以和为原料合成尿素,主要发生反应I:。
回答下列问题:
(1)、燃烧热是指在101kPa下,1mol纯物质完全燃烧生成指定产物时所放出的热量。、燃烧热测定中氮元素变为(填化学式)。(2)、焓变的计算方法有很多,仅从以下单项数据不能计算出反应I的的是_______(填标号)。A、各化学键的键能 B、各物质的燃烧热 C、正逆反应的活化能 D、各物质的相对能量(3)、一定条件下,的平衡转化率与温度,初始氨碳比[],初始水碳比[]的关系如图1和图2所示。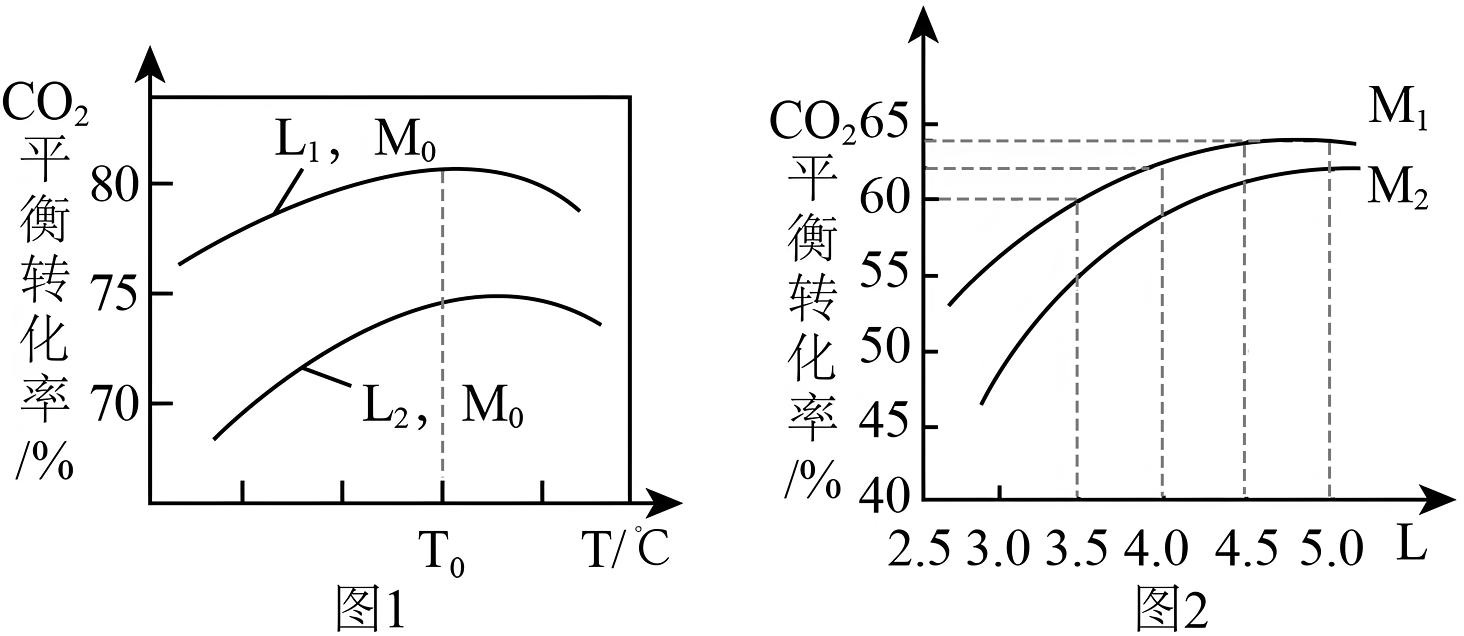
①(填“<”或“>”,下同),。
②已知反应的焓变会随温度的变化而变化,根据图1中平衡转化率随温度变化关系,请从焓变与平衡的角度,简述平衡转化率随温度变化原因:。
③改变初始水碳比对合成尿素反应有利有弊,从化学平衡角度解释增大初始水碳比不利于合成尿素的原因:。
(4)、① , 向2L恒容容器中加入和发生反应I,平衡时,转化率为;相同温度,在体积为的恒容容器中发生该反应(起始投料与上述容器相同),平衡时转化率为 , 则L。②恒温恒容下,以投料发生反应I,从反应开始至反应恰好达到平衡时,体系中混合气体的平均摩尔质量随时间变化趋势为(填标号)。
A.逐渐变大 B.逐渐变小 C.保持不变 D.无法判断
(5)、利用电解装置可以将汽车尾气中的NO转化为尿素[],工作原理如图。
阴极的电极反应式为。
-
17、马拉维若(K)是一种具有新型作用机制的抗HIV口服药,可由下列路线合成(部分试剂和条件省略)。

已知:Bn—代表苄基(
 )。
)。回答下列问题:
(1)、E中含氧官能团有酰胺基、(写官能团名称)。(2)、的反应类型是。(3)、J的结构简式是。(4)、根据流程信息,下列说法正确的是_______(填标号)。A、物质B的碳原子杂化类型为、 B、所有原子共平面 C、1mol物质F最多能与反应 D、物质J中有1个手性碳原子(5)、写出A在一定条件下发生缩聚反应的方程式:。(6)、G可由L( )经七步反应合成。L的二氯代物有种结构(不考虑取代芐基上的氢,不考虑立体异构)。 (7)、已知醇和氯代酯在一定条件下可发生如下反应: , 请设计合适的路线,利用甲苯和
)经七步反应合成。L的二氯代物有种结构(不考虑取代芐基上的氢,不考虑立体异构)。 (7)、已知醇和氯代酯在一定条件下可发生如下反应: , 请设计合适的路线,利用甲苯和 合成BnOOCCl:。
合成BnOOCCl:。 -
18、工业上以铬铁矿( , 含、、的氧化物等杂质)为主要原料制备的工艺流程如图。

已知:矿物中相关元素可溶性组分的物质的量浓度的对数与pH的关系如图所示。当溶液中可溶组分浓度时,可认为已除尽。

回答下列问题:
(1)、基态的价层电子排布式为。(2)、“焙烧”的目的是将转化为并将、氧化物转化为可溶性钠盐,“焙烧”时气体与矿料逆流而行,目的是;“焙烧”过程中发生的化学反应方程式为。(3)、时.已知、; 。工艺流程中“调pH”和“净化”调换顺序后,是否还能得到“滤渣3”,请分析并说明理由:。(4)、“滤渣2”的成分主要为(填化学式)。(5)、“酸化”时发生反应的离子方程式为。(6)、有关物质的溶解度如图所示。向“酸化”后的溶液中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到固体。冷却到(填标号)得到的固体产品最多。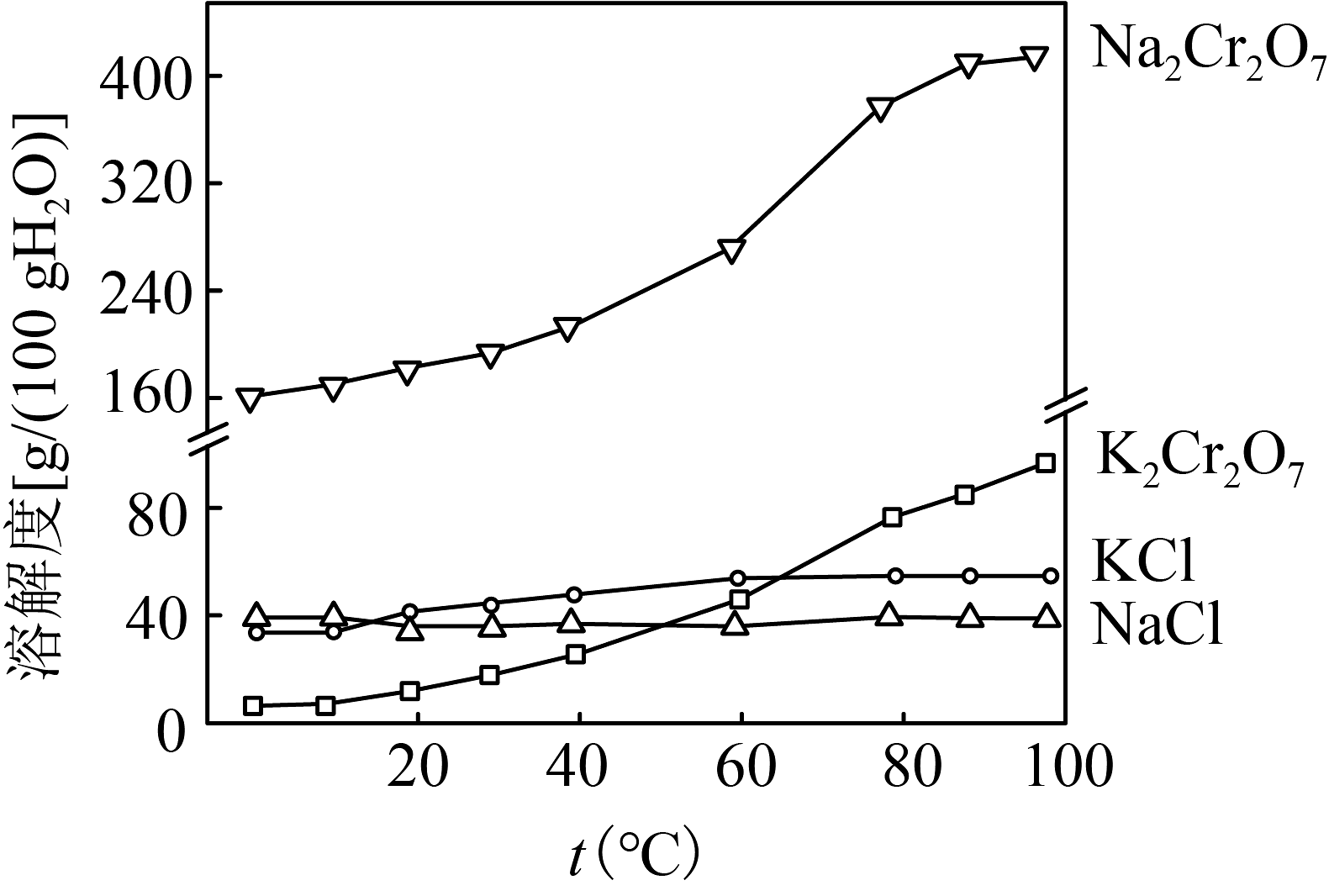
a. b. c. d.
-
19、二氯异氰尿酸钠[]为白色固体,难溶于冷水,是一种高效,安全的氧化性消毒剂。实验室用如图所示装置(夹持装置已略去)制备二氯异氰尿酸钠。回答下列问题:
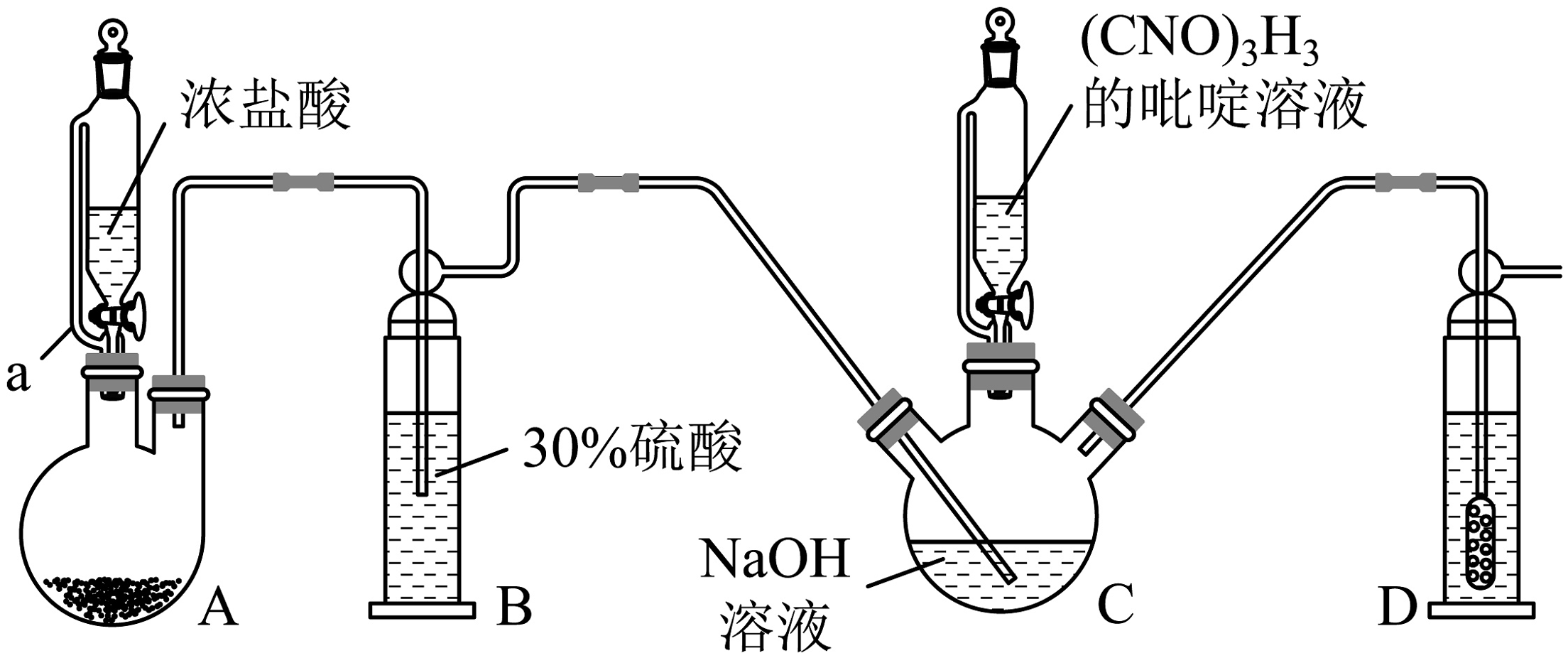
已知:实验原理为。
(1)、仪器a的名称为 , 装置A中的药品不能选择(填标号)A. B. C. D.
(2)、装置B的作用是 , 用平衡原理解释B中不用蒸馏水而选用硫酸的原因:。(3)、加入溶液,实验过程中C的温度必须保持在, , pH控制在 , 则该实验的控温方式是。若温度过高,pH过低,会生成 , 写出生成的离子方程式:。(4)、二氯异氰尿酸钠缓慢水解可产生HClO消毒灭菌,通过下列实验检测二氯异氰尿酸钠样品的有效氯。准确称取样品,用容量瓶配成100mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液。密封,在暗处静置5min;用标准溶液滴定至溶液呈微黄色,加入淀粉。继续滴定至终点,消耗溶液。[、]
已知:该样品的有效氯。
①样品的有效氯测定值为%(用含m、V的代数式表示)。
②下列操作会导致样品的有效氯测定值偏高的是(填标号)。
A.盛装标准溶液的滴定管未润洗 B.滴定管在滴定前无气泡,滴定后有气泡
C.碘量瓶中加入的稀硫酸偏少 D.滴定结束的时候仰视读数
-
20、一定条件下,分别向体积为1L的恒容密闭容器中充入气体,发生反应 , 测得实验①、②、③反应过程中体系压强随时间的变化曲线如图所示。下列说法不正确的是
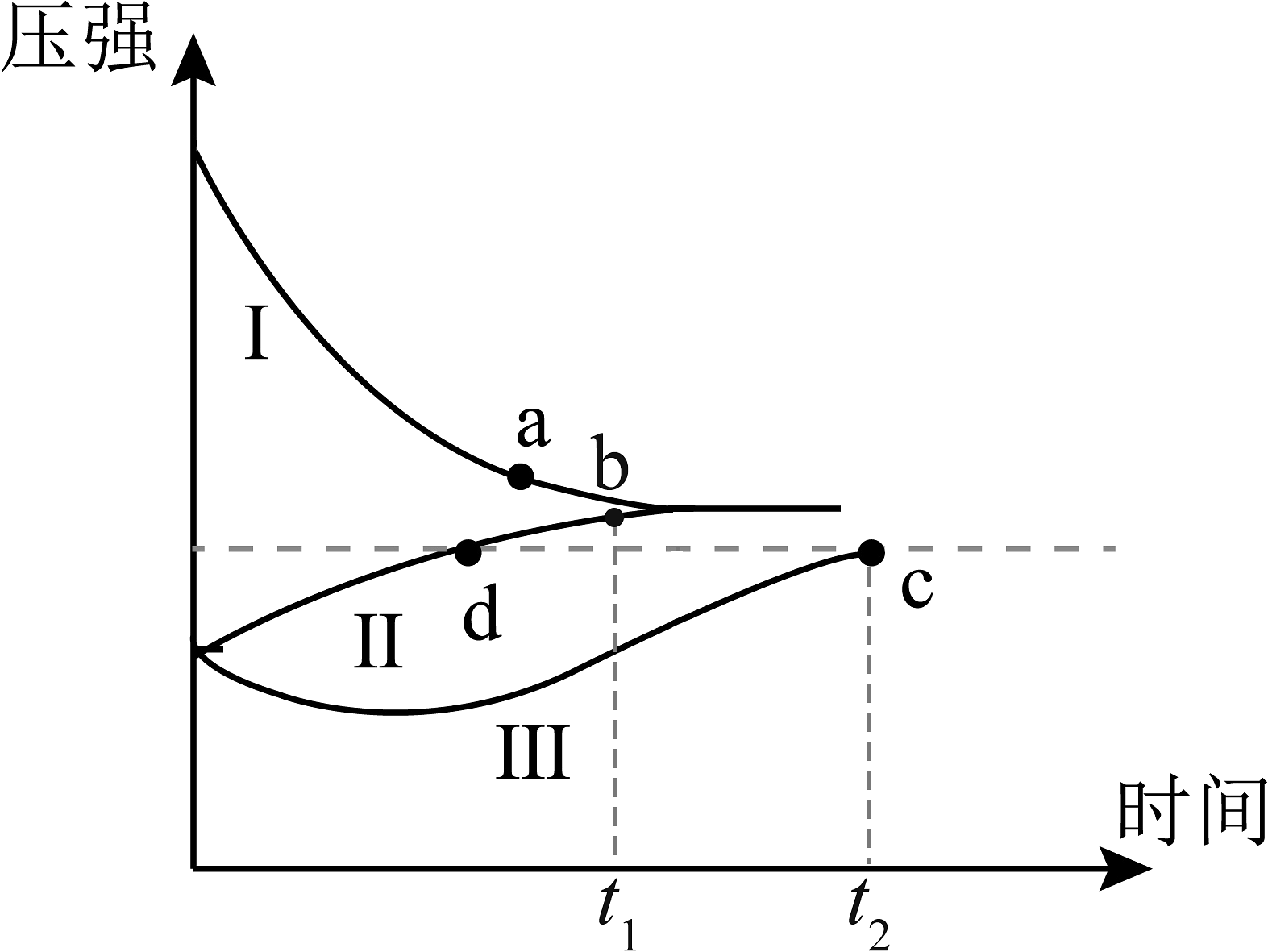
实验
充入气体量
反应过程条件
反应物转化率
①
恒温
②
恒温
③
绝热
A、实验①、②中X的浓度相等时,反应处于平衡状态 B、时间内,实验②、③中Z的平均反应速率:前者后者 C、图中c、d两点的气体的总物质的量: D、实验①、②、③平衡时反应物的转化率: