相关试卷
-
1、下列微观结构或现象不能解释其性质的是
选项
性质
结构因素
A
细胞膜的双分子膜层头向外,尾向内排列
细胞膜由大量两性分子(一端有极性,另一端无极性)组装而成
B
HCOOH的酸性强于CH3COOH
烷基是拉电子基团
C
原子光谱是不连续的线状谱线
原子核外电子的能量是量子化的
D
椅式环己烷(C6H12)比船式环己烷稳定
分子空间结构不同,椅式的空间位阻小
A、A B、B C、C D、D -
2、为达到实验目的,下列实验设计及现象都合理的是
选项
实验设计
实验目的
A
已知CuCl2溶液中存在平衡:[Cu(H2O)4]2+(蓝色)+4Cl−[CuCl4]2-(黄色)+4H2O,加热某浓度的CuCl2溶液,溶液由蓝色变为黄绿色
证明该平衡反应的正反应是吸热反应
B
加热使I2(s)升华
除去Fe粉中的I2
C
向丙烯醛溶液中滴加溴水,溴水褪色
验证丙烯醛中含碳碳双键
D
将SO2通入品红溶液中,品红溶液褪色,加热褪色后的溶液,溶液恢复红色
验证SO2的不稳定性
A、A B、B C、C D、D -
3、下列有关方程式书写不正确的是A、用处理含的废液,其离子方程式为: B、电解精炼铜的阴极反应:Cu2++2e−=Cu C、将SO2通入酸性KMnO4溶液中: D、证明NH3对Cu2+的配位能力强于H2O:
-
4、下列有关实验操作规范,说法不正确的是A、使用聚四氟乙烯活塞的滴定管为酸碱通用滴定管 B、将结块的硝酸铵置于研钵中用研杵敲碎,研细 C、磨口玻璃瓶塞洗净、晾干后应在瓶塞处垫一张纸条以免瓶塞与瓶口粘连 D、制取氧气后,剩余的高锰酸钾固体需要配成溶液或转化为其它物质后排放
-
5、下列化学用语或图示表示正确的是A、晶态和非晶态SiO2粉末的X射线衍射图谱对比:
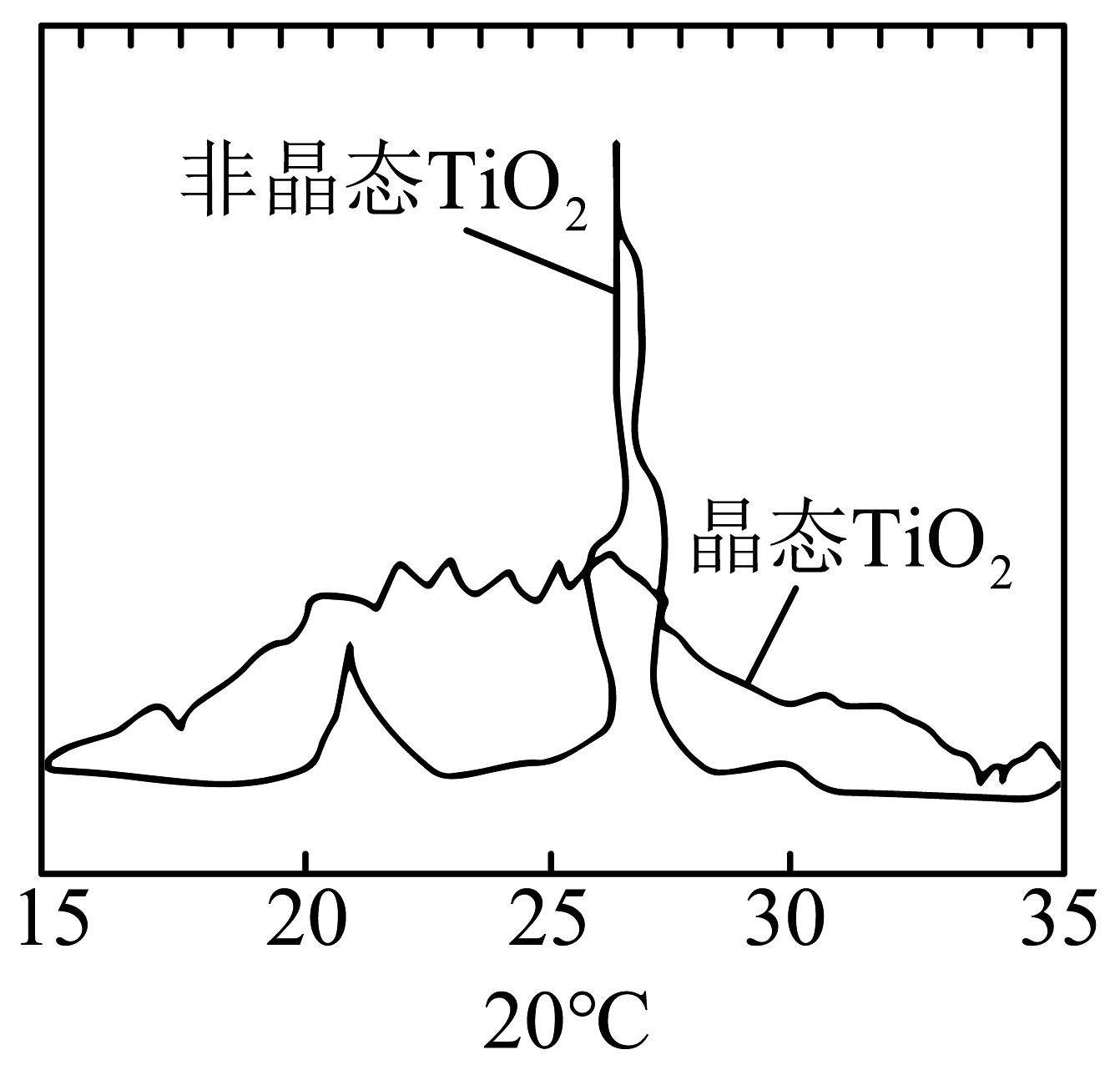 B、基态29Cu原子的价层电子轨道表示式:
B、基态29Cu原子的价层电子轨道表示式: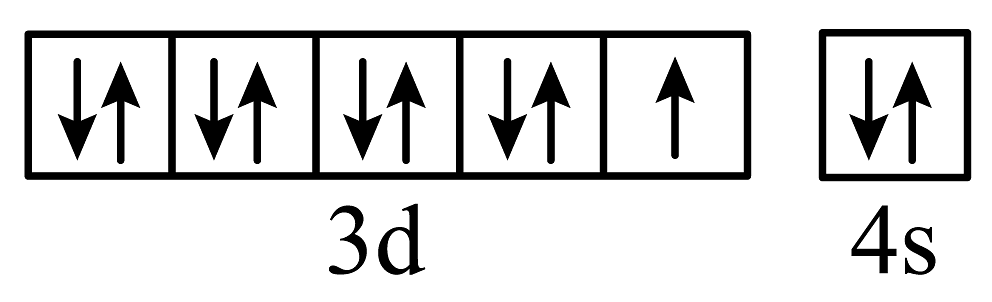 C、中子数为20的Ca原子:Ca
D、SO的VSEPR模型为:
C、中子数为20的Ca原子:Ca
D、SO的VSEPR模型为: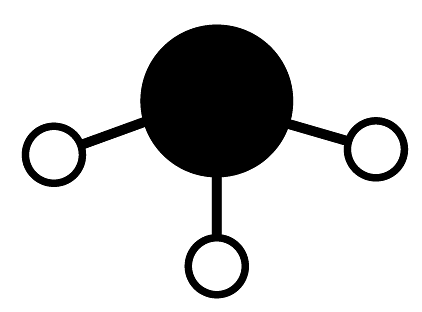
-
6、2025年央视春晚精彩纷呈,硬科技霸屏。下列有关说法正确的是A、机器人使用二氧化硅制造出的芯片,完美呈现舞蹈效果 B、歌曲《山鹰和兰花花》传达了对生态环境的关注,二氧化碳能引起温室效应,是常见的空气污染物 C、春晚展示的非物质文化遗产“打铁花”,利用了铁元素的焰色 D、《山水霓裳》中李子柒的服装采用丝绸制成,丝绸的主要成分是蛋白质
-
7、某研究小组按下列路线可以合成药物氯氮平的中间体H。

已知:①
 ;②
;② 。
。请回答下列问题:
(1)、化合物D的官能团名称是。(2)、化合物B的结构简式是。(3)、下列说法不正确的是___________。A、硝化反应的试剂可用浓硝酸和浓硫酸 B、中间H的分子式为C18H19ClN4O C、化合物B具有两性 D、从C→E的反应推测,化合物D中硝基间位氯原子比邻位的活泼(4)、写出E→G的化学方程式。(5)、写出同时符合下列条件的化合物C的同分异构体的结构简式。①属于芳香族化合物;
②能在NaOH溶液中发生水解;
③1H-NMR谱和IR谱检测表明:分子中共有4种不同化学环境的氢原子。
(6)、设计以CH2=CH2和CH3NH2为原料合成F( )的路线(用流程图表示,无机试剂任选)。
)的路线(用流程图表示,无机试剂任选)。 -
8、
环己烯是重要的化工原料。其实验室制备流程如下:

请回答下列问题:
I.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为 , 现象为。
(2)操作1的装置如图所示(加热和夹持装置已略去)。

①烧瓶A中进行的可逆反应化学方程式为。
②浓硫酸也可作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为(填序号)。
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
(3)操作2用到的玻璃仪器是。
(4)将操作3(蒸馏)的步骤补齐:。(填写序号)
___________→___________→___________→___________→___________→弃去前馏分,收集83℃的馏分
①检验装置的气密性 ②点燃酒精灯,加热 ③加入待蒸馏的物质和沸石 ④接通冷凝水 ⑤安装蒸馏装置
Ⅱ.环己烯含量的测定
在一定条件下,向a g环己烯样品中加入b mol Br2(过量),与环己烯充分反应后,剩余的Br2与足量KI作用生成I2 , I2与Na2S2O3标准溶液反应,最终消耗c mol·L-1Na2S2O3标准溶液V mL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①Br2+

②Br2+2KI=I2+2KBr
③I2+2Na2S2O3=2NaI+Na2S4O6
(5)样品中环己烯的质量分数为(用字母表示)。
-
9、锰氧化物具有较大应用价值,请回答下列问题:(1)、基态Mn原子的简化电子排布式:;同周期中,基态原子未成对电子数比Mn多的元素是(填元素符号)。(2)、Mn的某种氧化物MnOx的四方晶胞及其在xy平面的投影如图1所示,该氧化物化学式为;锰离子的配位数(紧邻的阴离子数)为。
 (3)、[BMIM]+BF(见图2)是MnOx晶型转变的诱导剂。BF的空间构型为;[BMIM]+中咪唑环存在大π键,则N原子采取的轨道杂化方式为。
(3)、[BMIM]+BF(见图2)是MnOx晶型转变的诱导剂。BF的空间构型为;[BMIM]+中咪唑环存在大π键,则N原子采取的轨道杂化方式为。 (4)、MnOx可作HMF转化为FDCA的催化剂(见下图3)。FDCA的熔点远大于HMF,其主要原因是。
(4)、MnOx可作HMF转化为FDCA的催化剂(见下图3)。FDCA的熔点远大于HMF,其主要原因是。 (5)、锰的部分含氧酸结构如下图4,酸性:HMnO4H2MnO4(填“>”或“<”),理由是。
(5)、锰的部分含氧酸结构如下图4,酸性:HMnO4H2MnO4(填“>”或“<”),理由是。
-
10、前四周期元素A、B、C、D、E、F的原子序数依次增大,其相关性质如表所示:
A
原子核外有6种运动状态不同的电子
B
元素原子的核外p电子数比s电子数少1个
C
地壳中含量最多的非金属元素
D
基态原子核外有6个原子轨道排有电子,且只有1个未成对电子
E
E3+第三周期中半径最小的简单离子
F
基态F+各能级电子全充满
请回答下列问题:
(1)、F是区的元素;写出D2C2化合物的电子式:。(2)、A、B、C元素中,电负性最大的是;第一电离能最大的是。(填元素符号)(3)、B单质分子中σ键和π键的个数比 , C的简单氢化物在同族元素的简单氢化物中沸点出现反常,其原因是。(4)、写出E元素的最高价氧化物与D的最高价氧化物对应水化物反应的离子方程式。(5)、实验室合成一种由A和B两种元素形成的化合物,该化合物具有三维骨架结构。其中每个A原子与4个B原子形成共价键,每个B原子与3个A原子形成共价键,其化学式为。 -
11、以淀粉为基本原料可制备许多物质,如:

请回答下列问题:
(1)、上述①-⑤反应中,属于消去反应的是;属于氧化反应的是。(填写序号)(2)、若乙醇中的O原子用18O标记(乙酸中的O不需标记),写出乙醇与乙酸反应生成乙酸乙酯的化学方程式:。(3)、下列有关说法不正确的是___________。A、可用碘水检验淀粉是否水解完全 B、淀粉是生物大分子物质,反应①的反应条件是:稀硫酸,加热 C、乙烯、聚乙烯分子中均含有碳碳双键,均可被酸性KMnO4溶液氧化 D、可利用红外光谱或核磁共振氢谱来区别葡萄糖和乙醛(4)、将3.00 g某有机物(仅含C、H、O元素,相对分子质量为150)样品置于燃烧器中充分燃烧,依次通过吸水剂、CO2吸收剂,燃烧产物被完全吸收。实验数据如下表:吸水剂
CO2吸收剂
实验前质量/g
20.00
26.48
实验后质量/g
21.08
30.00
①燃烧产物中水的物质的量为mol。
②该有机物的分子式为。
-
12、下列方案设计、现象和结论正确的是
选项
目的
方案设计
现象和结论
A
探究用“相似相溶”规律理解I2的溶解性
将一小粒碘晶体溶于约5mL蒸馏水中,观察碘在水中的溶解性。加入约1mL乙醇,振荡试管,观察溶液颜色变化
溶液分层,观察到紫红色的碘的乙醇溶液,说明碘易溶于有机溶剂
B
检验乙醇与浓硫酸在170℃下反应的气体产物
将乙醇与浓硫酸在170℃下反应的气体通入溴水中
溴水褪色,说明乙醇发生消去反应生成乙烯
C
探究苯环与烷基的相互作用
分别向盛有2mL苯和2mL甲苯的试管中加入几滴酸性KMnO4溶液,振荡
甲苯中KMnO4溶液褪色,苯中KMnO4溶液不褪色,说明甲基活化了苯环
D
检验有机物中是否含有卤素原子
取2mL样品于试管中,加入5mL20%
NaOH水溶液混合后加热,反应完全后,待反应液冷却,加入足量稀硝酸,再滴加AgNO3溶液
无沉淀生成,说明有机物中不含卤素原子
A、A B、B C、C D、D -
13、Mg2Si具有反萤石结构,晶胞结构如图所示,其晶胞参数为a nm。下列叙述正确的是
 A、基态Mg核外电子有3种不同的空间运动状态 B、每个硅原子周围有4个镁原子 C、Mg与Si之间的最近距离为nm D、Mg2Si的密度计算式为
A、基态Mg核外电子有3种不同的空间运动状态 B、每个硅原子周围有4个镁原子 C、Mg与Si之间的最近距离为nm D、Mg2Si的密度计算式为 -
14、强酸HBF4 可由如下反应制备,HF + BF3 = HBF4。下列说法正确的是A、相同条件下,HBF4 酸性弱于HF B、HBF4的电离方程式:HBF4 = H+ + BF C、BF3的空间结构是三角锥形 D、HBF4 中含有离域π键
-
15、物质微观结构决定宏观性质,进而影响用途。下列结构或性质不能解释其用途的是
选项
结构或性质
用途
A
硫化剂以二硫键将顺丁橡胶的线型结构连接为网状结构
硫化交联程度越大,获得弹性越好的顺丁橡胶
B
聚乙炔存在共轭大π键体系为电荷传递提供了通路
聚乙炔可用于制备导电高分子材料
C
聚丙烯酸钠(
 )中含有亲水基团
)中含有亲水基团聚丙烯酸钠可用于制备高吸水性树脂
D
冠醚18-冠-6空腔直径(260-320pm)与直径K+(276pm)接近
冠醚18-冠-6可识别K+ , 能增大KMnO4 在有机溶剂中的溶解度
A、A B、B C、C D、D -
16、下列反应的离子方程式正确的是A、硫酸铜溶液与过量氨水反应:Cu2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 4H2O B、向银氨溶液中加盐酸:[Ag(NH3)2]+ + 2H+= Ag+ + 2NH C、将乙醇与足量酸性K2Cr2O7溶液混合:Cr2O+ 3CH3CH2OH + 8H+ →3CH3CHO + 2Cr3+ +7H2O D、苯酚钠溶液通入少量的CO2:2
 +CO2+H2O→2
+CO2+H2O→2 +
+
-
17、关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物,下列说法正确的是A、配位体是Cl-和H2O,配位数是8 B、中心离子是Ti3+ , 配离子是[TiCl(H2O)5]2+ C、该配离子中含有的化学键有离子键、共价键、配位键、氢键 D、在1 mol该配合物中加入足量AgNO3溶液,可以得到3 mol AgCl沉淀
-
18、X、Y、Z、M四种主族元素,原子序数依次增大,分别位于三个不同短周期,Y与M同主族,Y与Z核电荷数相差2,Z的原子最外层电子数是内层电子数的3倍。下列说法不正确的是A、热稳定性:X2Z>YX4 B、键角:YX>YX C、分子的极性:Y2X2>X2Z2 D、共价晶体熔点:Y>M
-
19、NA为阿伏加德罗常数,下列说法正确的是A、1 mol C2H4O中含σ键数目最多为6NA B、标准状况下,11.2L CCl4含有分子数目为0.5NA C、6 g金刚石晶体中含有碳碳键的数目为2NA D、14 g乙烯和丙烯的混合气体中总原子数目为3NA
-
20、下列说法不正确的是A、单一波长的X射线通过水晶时,记录仪上会产生明锐的衍射峰 B、某些金属盐灼烧呈现不同焰色是因为电子从低能级跃迁至较高能级吸收光的波长不同 C、CS2在CCl4中的溶解度远大于H2O是因为H2O为极性分子,而CS2、CCl4为非极性分子 D、CF3COOH酸性大于CH3COOH是因为F的电负性大,导致CF3COOH羟基极性大,易电离