相关试卷
-
1、下列关于基本营养物质的说法不正确的是A、动物脂肪在碱性条件下水解,可得到高级脂肪酸和甘油 B、淀粉、纤维素、麦芽糖在一定条件下都可转化为葡萄糖 C、加入少量的硫酸铵能促进蛋白质的溶解 D、核酸是由磷酸、戊糖、碱基通过一定方式形成的生物大分子
-
2、下列物质的性质或相关数据与氢键无关的是A、氨气易液化 B、二甲醚微溶于水,而乙醇可与水以任意比例混溶 C、HF(g)分解时吸收的热量比HCl(g)分解时吸收的热量多 D、邻羟基苯甲酸(
 )熔点为159℃,对羟基苯甲酸(
)熔点为159℃,对羟基苯甲酸( )熔点为213℃
)熔点为213℃
-
3、下列说法正确的是A、可以用浓溴水来除去苯中混有的少量苯酚 B、可以用饱和NaOH溶液来除去乙酸乙酯中混有乙酸 C、溴水和酸性高锰酸钾溶液都可以用来除去乙烷中的乙烯 D、只用新制氢氧化铜(可加热)可以区分乙醇、乙醛、乙酸
-
4、关于乙炔的说法不正确的是A、碳原子的价层电子的轨道表示式
 , 违反了泡利原理
B、基态碳原子核外有3种能量不同的电子
C、乙炔分子中的C原子间采用sp杂化轨道形成了一个σ键和两个π键
D、乙炔分子内含极性键、非极性键,是非极性分子
, 违反了泡利原理
B、基态碳原子核外有3种能量不同的电子
C、乙炔分子中的C原子间采用sp杂化轨道形成了一个σ键和两个π键
D、乙炔分子内含极性键、非极性键,是非极性分子
-
5、下列化学用语正确的是A、SO3的VSEPR模型:
 B、
B、 的系统命名为:2,2,3-三甲基丁烷
C、甲酸甲酯的结构简式:C2H4O2
D、KCl的形成过程:
的系统命名为:2,2,3-三甲基丁烷
C、甲酸甲酯的结构简式:C2H4O2
D、KCl的形成过程:
-
6、
回答下列问题:
Ⅰ.甲醇是重要的化工原料之一,也可作燃料,利用合成气(主要成分为CO、CO2和H2)可以合成甲醇,涉及的反应如下:
反应i:
反应ii:
(1)反应i在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。

在有催化剂下,该反应历程中决速步骤的化学方程式为 , 催化剂使该步骤的活化能降低eV。
(2)现将6molCO2和8molH2充入2L的恒温刚性密闭容器中,若只发生反应i , 测得的氢气物质的量随时间变化如图中实线所示:

①该反应在下能自发进行(填“高温”或“低温”)。
②下列说法能表明该反应已经达到平衡状态的是(填选项字母)。
A.混合气体中c(CO2):c(H2):c(CH3OH)=1:3:1
B.混合气体的密度保持不变
C.压强保持不变
D.
③a点正反应速率(填“大于”、“等于”或“小于”)b点逆反应速率,前4min内,用表示的平均反应速率为(保留两位有效数字)。
④仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是。
⑤一定条件下,单位时间内不同温度下测定的CO2转化率如图乙所示。温度高于710K时,随温度的升高转化率降低的原因可能是。

(3)将一定量的和充入密闭容器中并加入合适的催化剂,只发生反应ii和iii.一定条件下,测得的平衡转化率、的选择性和CO的选择性随压强的变化曲线如图所示。
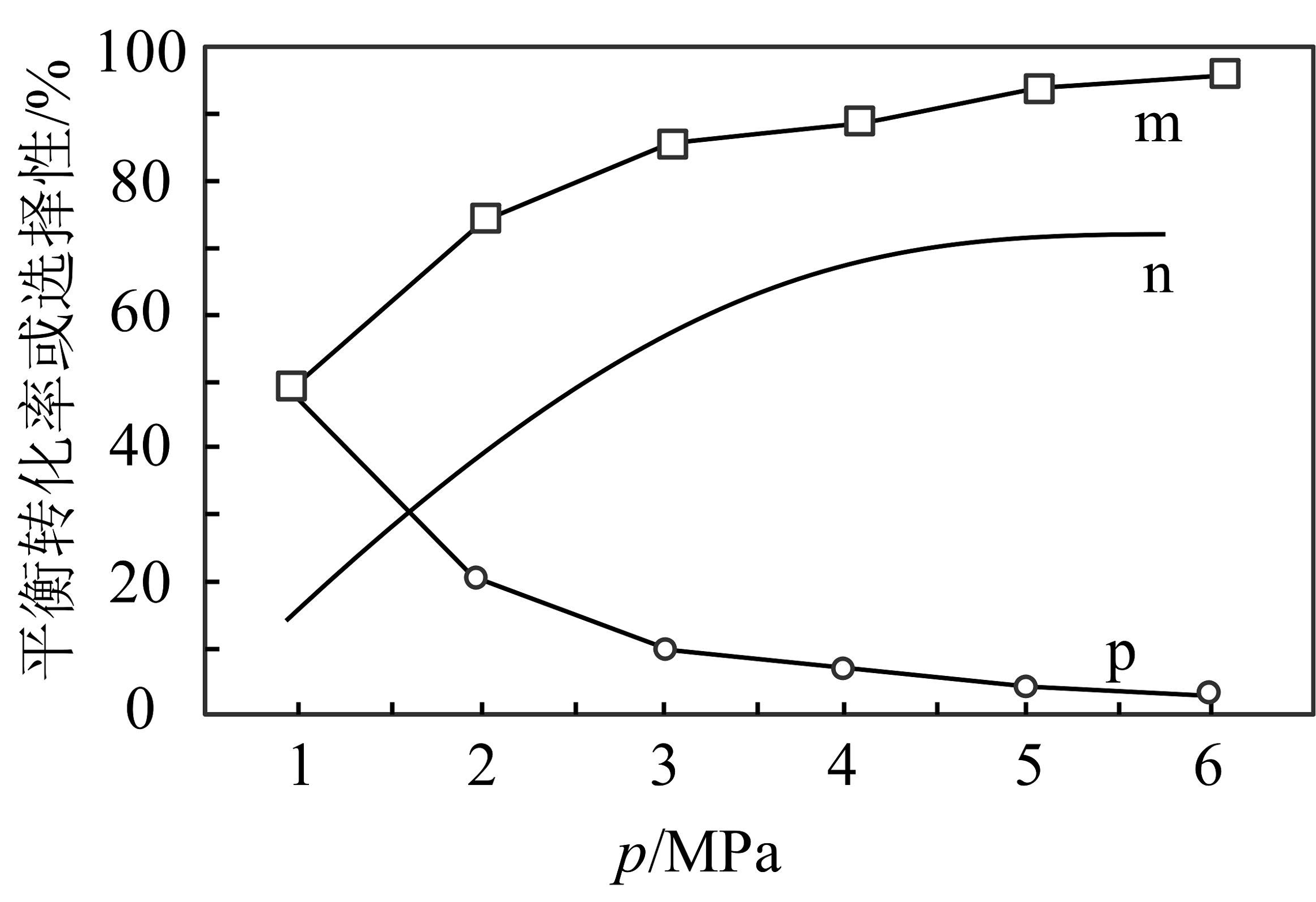
图中表示CH3OH的选择性曲线是。有利于提高甲醇选择性的条件是。
A.低温高压 B.低温低压 C.高温高压 D.高温低压
Ⅱ.自然界中的固氮反应是将转化为含氮氧化物。在100kPa时,反应中NO的平衡转化率与温度的关系曲线如图2,反应中的平衡转化率与温度的关系曲线如图3.
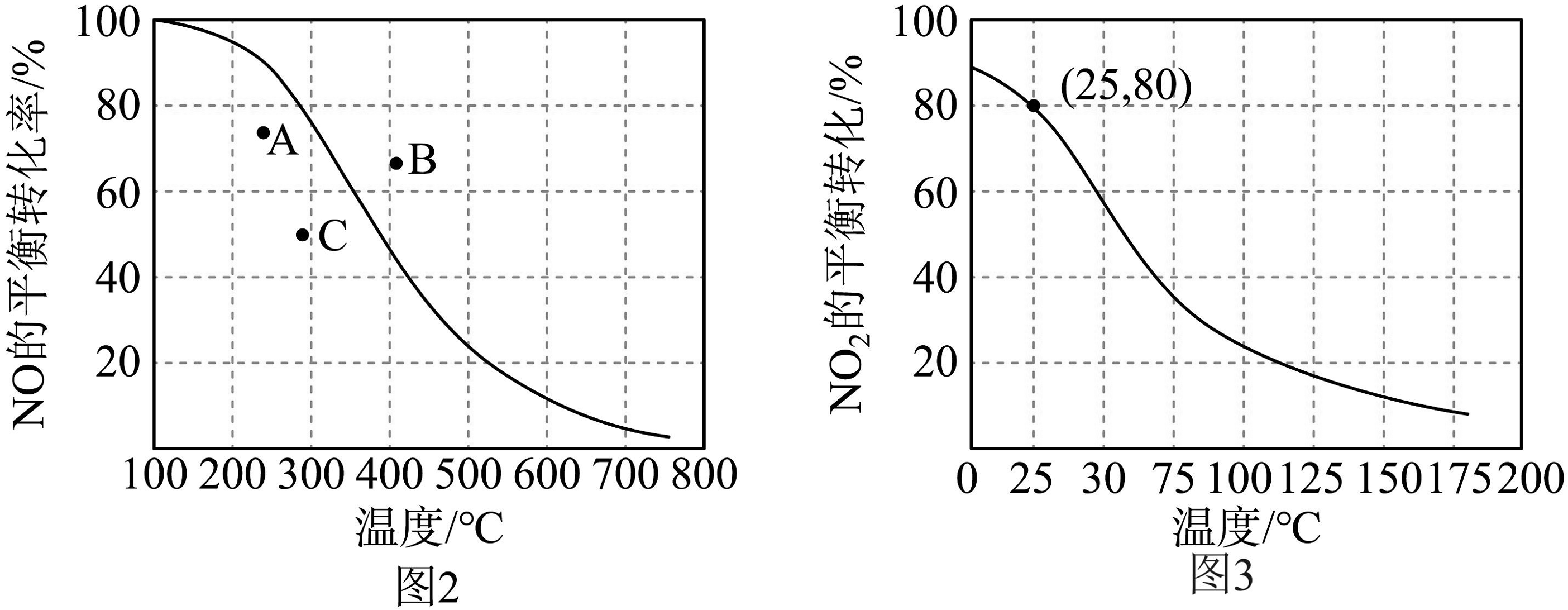
(4)图2中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则点对应的压强最大。
(5)100kPa、25℃时,平衡体系中,列式计算平衡常数(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
-
7、
育才中学的部分同学利用课余时间分成两个兴趣小组,进行化学实验探究。
Ⅰ.第一组:以过氧化氢()为对象进行实验。回答下列问题:
已知:纯过氧化氢()是淡蓝色的黏稠液体,可与水以任意比混合,为无色透明液体。
(1)该小组的同学查阅资料后发现为二元弱酸, , 。①写出在水溶液中的电离方程式:。
②如果常温下溶液pH=7,的酸式酸根离子与的浓度比为。
(2)测定某瓶过氧化氢溶液中的含量①取20.00mL试样置于锥形瓶中,用装有0.1000mol·L-1的酸性标准溶液的棕色式滴定管滴定。反应的离子方程式为。
②滴定达到终点的现象为 , 记录数据。重复滴定两次,每次消耗的酸性标准溶液体积如下表所示:
实验次数
第一次
第二次
第三次
体积
则试样中过氧化氢的浓度为。(保留两位有效数字,下同)
③若实验测得的浓度比该瓶试剂标签上的数据低,下列哪些是造成偏低的可能原因:。
A.滴定终点读数时俯视读数
B.滴定管水洗后直接倒入KMnO4溶液进行滴定
C.锥形瓶水洗后未干燥
D.滴定时有几滴KMnO4溶液溅落在锥形瓶外
Ⅱ.第二组:已知溶液和溶液可发生反应:。为探究反应速率与的关系,该组同学设计下表进行四组实验,排水法收集N2.用秒表测量收集1.0mLN2所需的时间。每组实验过程中,其他反应物浓度变化很细心奥,忽略其对反应速率测定的影响。实验数据如下表所示。
实验编号
溶液
溶液
醋酸
水
1
4.0
4.0
8.0
334
2
4.0
4.0
150
3
8.0
4.0
4.0
4.0
83
4
12.0
4.0
4.0
0.0
38
(3)① , 。②该反应的速率方程为 , k为反应速率常数。利用实验数据计算得(填整数)。
-
8、25℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数如下所示:
化学式
CH3COOH
HClO
H2CO3
电离平衡常数
K=
K=
(1)、用离子方程式表示Na2CO3溶液可以去油污的原因:。(2)、同浓度的、ClO-、、在溶液中结合的能力最强的是。(3)、下列能使醋酸溶液中的电离程度增大,而电离平衡常数不变的操作是。A.升高温度 B.加水稀释 C.加少量的固体
D.加少量冰醋酸 E.加氢氧化钠固体
(4)、判断CO2通入次氯酸钠溶液是否发生反应,如果不能说出理由,如果能发生反应请写出相应的化学方程式:。(5)、取等体积等物质的量浓度的醋酸、盐酸两溶液,分别与等浓度的NaOH溶液中和,则消耗NaOH溶液的体积大小关系为:V(醋酸)V(盐酸)(填“>”、“<”或“=”)。(6)、在新制氯水中加入少量的NaCl固体,水的电离平衡移动(填“正向”、“逆向”或“不”)。(7)、已知:H+(aq)+OH-(aq)═H2O(l)△H1=-57.3kJ/mol,每mol醋酸在水溶液中电离吸收0.3kJ热量。则稀醋酸与稀NaOH溶液反应的热化学方程式为。(8)、在水溶液中会发生自偶电离:(的 , ),该反应的平衡常数是(用K1、K2表示)。 -
9、25℃时,pH=3的盐酸和醋酸溶液各1mL分别加水稀释,溶液导电能力随溶液体积变化的曲线如图所示。下列说法不正确的是
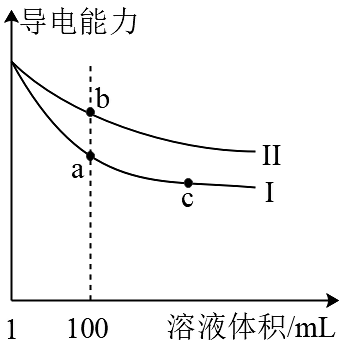 A、曲线Ⅰ代表盐酸的稀释过程 B、分别将a、b点溶液与镁条反应,a点溶液的起始速率与b点相等 C、b点溶液中和氢氧化钠的能力强于a点溶液 D、将a、b两点所示溶液加热至30℃,的值变小
A、曲线Ⅰ代表盐酸的稀释过程 B、分别将a、b点溶液与镁条反应,a点溶液的起始速率与b点相等 C、b点溶液中和氢氧化钠的能力强于a点溶液 D、将a、b两点所示溶液加热至30℃,的值变小 -
10、根据实验目的,实验方法、操作或现象均正确的是
实验
实验方法、操作或现象
A
探究FeCl3溶液与KI溶液的反应
取5mL0.1mol/LKI溶液,加入1mL0.1mol/LFeCl3溶液,充分反应后滴入5滴15%KSCN溶液,观察实验现象
B
取20.00mL盐酸
在25mL酸式滴定管中(经盐酸润洗后)装入盐酸,调整初始读数为5.00mL后,将剩余盐酸放入锥形瓶
C
测定中和反应的反应热
往烧杯中缓慢加入NaOH溶液,用温度传感器采集烧杯内溶液的温度的变化
D
探究温度对化学平衡的影响
在试管中加入2mL0.5mol/L的CuCl2溶液,加热试管,观察到溶液从黄色变成蓝色
A、A B、B C、C D、D -
11、K2Cr2O7在水溶液中存在平衡:Cr2O(橙)+H2O2CrO(黄)+2H+ , 下列说法正确的是A、该反应是氧化还原反应 B、加入适量NaHSO4固体,平衡逆向移动 C、加入浓NaOH溶液,溶液呈橙色 D、向体系中加入适量水,平衡不移动
-
12、下列说法中错误的是A、活化分子之间发生的碰撞一定是有效碰撞 B、对有气体参加的化学反应,增大压强使容器容积减小,可使单位体积内活化分子数增多,因而化学反应速率增大 C、升高温度,可使反应物分子中活化分子的百分数增大,因而增大化学反应速率 D、加入适宜的催化剂,可使反应物分子中活化分子的百分数增大,因而增大化学反应速率
-
13、下列叙述中能证明醋酸为弱电解质的是A、白醋中滴入石蕊试液后呈红色 B、10 mL 1 mol·L-1的醋酸溶液恰好与10 mL 1 mol·L-1的溶液完全反应 C、室温下,将等浓度、等体积的盐酸和醋酸钠溶液混合,若混合溶液pH<7,证明醋酸是弱酸 D、用玻璃棒沾0.1mol·L-1的醋酸钠溶液滴在pH试纸上,测得pH约为8.6
-
14、盐类水解与生活密切联系,下列做法与盐类水解无关的是A、实验室配制FeCl3溶液时,应先将其溶解在盐酸中,而后加水稀释 B、除去MgCl2中的Fe3+ , 可以加入NaOH固体 C、用浓NaHCO3溶液与浓Al2(SO4)3溶液混合作灭火剂 D、加热蒸干AlCl3溶液得到Al(OH)3固体
-
15、设为阿伏加德罗常数的值。下列说法中正确的是A、0.1mol·L-1HClO4溶液中含有的H+离子数为 B、浓度均为0.1mol·L-1的磷酸钠溶液和磷酸,当体积为1L时,磷酸根离子数均为 C、25℃时1LpH=13的溶液中含有的离子数为 D、0.1molN2和0.3molH2于密闭容器中充分反应后分子总数为
-
16、下列溶液一定呈中性的是A、pH=7的溶液 B、c(H+)=c(OH-)=10-6mol·L-1溶液 C、使石蕊试液呈紫色的溶液 D、酸与碱恰好完全反应生成正盐的溶液
-
17、将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
 (1)、原混合物中Mg和Al的质量之比为。(2)、加入NaOH溶液的物质的量浓度为。(3)、稀硫酸的物质的量浓度为。
(1)、原混合物中Mg和Al的质量之比为。(2)、加入NaOH溶液的物质的量浓度为。(3)、稀硫酸的物质的量浓度为。 -
18、元素周期律反映了元素性质的周期性变化规律。(1)、元素的性质,特别是化学性质,取决于元素的原子结构。磷、硫、氯元素形成的最高价氧化物对应的水化物中,酸性最强的是(填化学式)。(2)、碱金属元素中,和之间的关系是互为。金属钾的氧化物有多种,写出与反应的化学方程式:。(3)、中国“奋斗者”号载人潜水器的壳体为含钛、铝等元素的钛合金材料,该合金材料的熔点比其成分金属的(填“高”或“低”)。下列方法可以比较钠和铝金属性强弱的是(填字母)。
a.比较两种金属单质的硬度和熔点
b.用钠置换氯化铝溶液中的铝
c.比较等物质的量的两种金属单质与足量盐酸反应失去的电子数
d.比较等物质的量的两种金属单质分别与水反应的剧烈程度
(4)、为了清理路面积雪,人们常使用一种融雪剂,主要成分的化学式 , X、Y均为元素周期表前20号元素,阳离子和阴离子的电子层结构相同,且含有54mol电子。该融雪剂的电子式是。 -
19、铁常见的化合价有0、+2、+3,某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物,请回答下列问题:
 (1)、A、B、E三个装置中应先点燃处的酒精(喷)灯,反应结束时,应先熄灭处的酒精(喷)灯。(2)、装置C的作用是。(3)、E处的装置可以用(填“甲”或“乙”)代替;实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入该装置中。(4)、B装置硬质玻璃管中发生反应的化学方程式为。(5)、反应结束后,取B装置硬质玻璃管中的固体物质,用足量稀盐酸溶解得溶液X,向溶液X中加入少量KSCN溶液,无明显现象,请解释原因。(6)、碱性环境下与强氧化剂作用可以生成 , 完成并配平下列反应的离子方程式:。
(1)、A、B、E三个装置中应先点燃处的酒精(喷)灯,反应结束时,应先熄灭处的酒精(喷)灯。(2)、装置C的作用是。(3)、E处的装置可以用(填“甲”或“乙”)代替;实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入该装置中。(4)、B装置硬质玻璃管中发生反应的化学方程式为。(5)、反应结束后,取B装置硬质玻璃管中的固体物质,用足量稀盐酸溶解得溶液X,向溶液X中加入少量KSCN溶液,无明显现象,请解释原因。(6)、碱性环境下与强氧化剂作用可以生成 , 完成并配平下列反应的离子方程式:。_____________________(_______)_____________________(_______)
-
20、按要求完成下列填空:(1)、下列给定的物质中:①NaCl晶体:②;③镁条;④氨气;⑤液态的HCl。属于非电解质的是(填编号)。(2)、写出金属铝投入氢氧化钠溶液中反应的化学方程式。(3)、比较稳定性:(填“>”、“<”、“=”)。