相关试卷
-
1、时,用溶液滴定同浓度的溶液,被滴定分数[]与pH、微粒分布分数[ , X表示、或]的关系如图所示,下列说法不正确的是
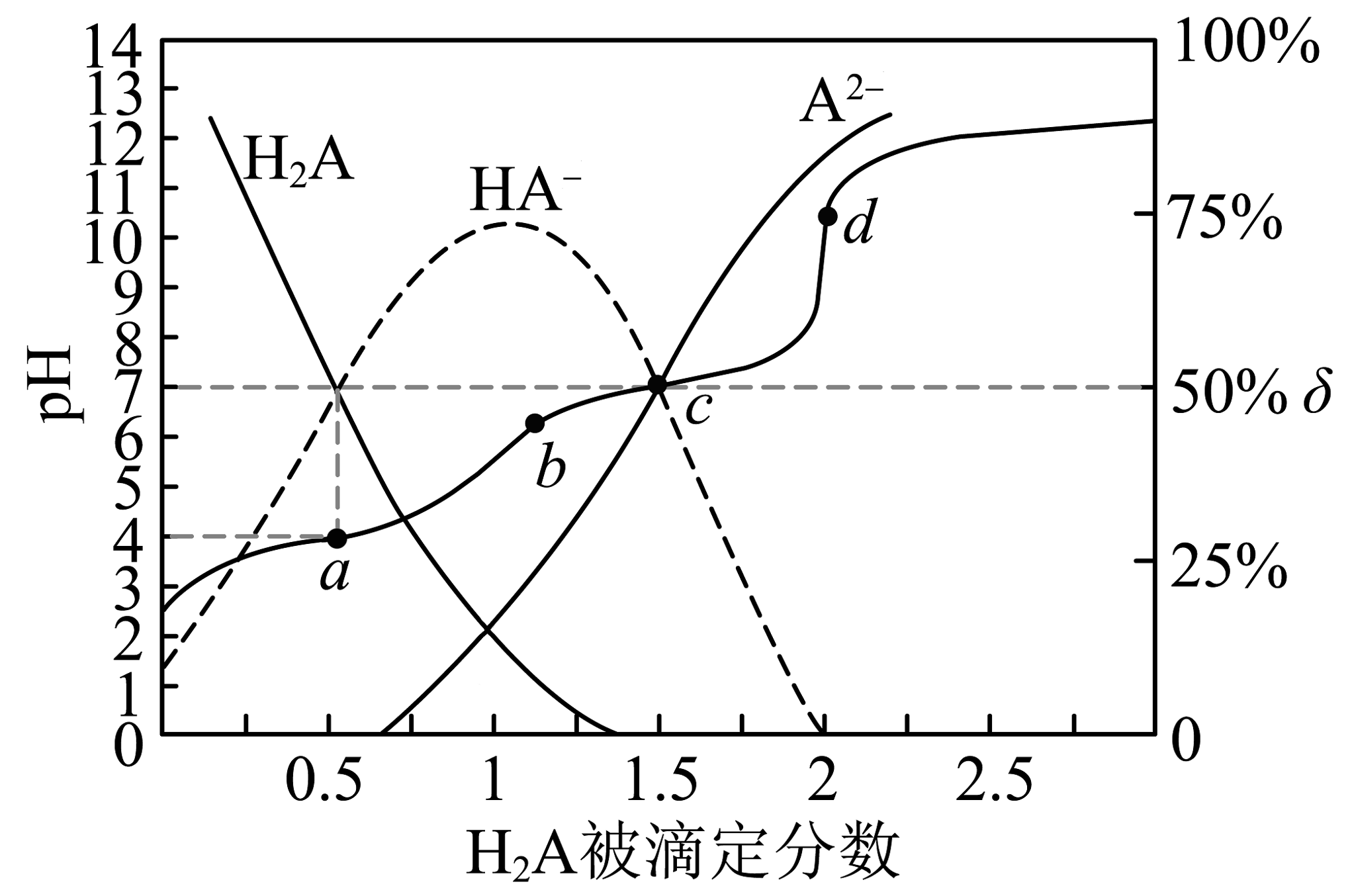 A、可以选酚酞作为此滴定实验第二滴定终点的指示剂 B、时,第一步电离平衡常数 C、c点 D、时,溶液中
A、可以选酚酞作为此滴定实验第二滴定终点的指示剂 B、时,第一步电离平衡常数 C、c点 D、时,溶液中 -
2、黄铁矿主要成分的晶体的立方晶胞如图所示,晶体密度为 , 是双原子离子,因此同一晶胞中存在多种取向的 , 下列说法不正确的是
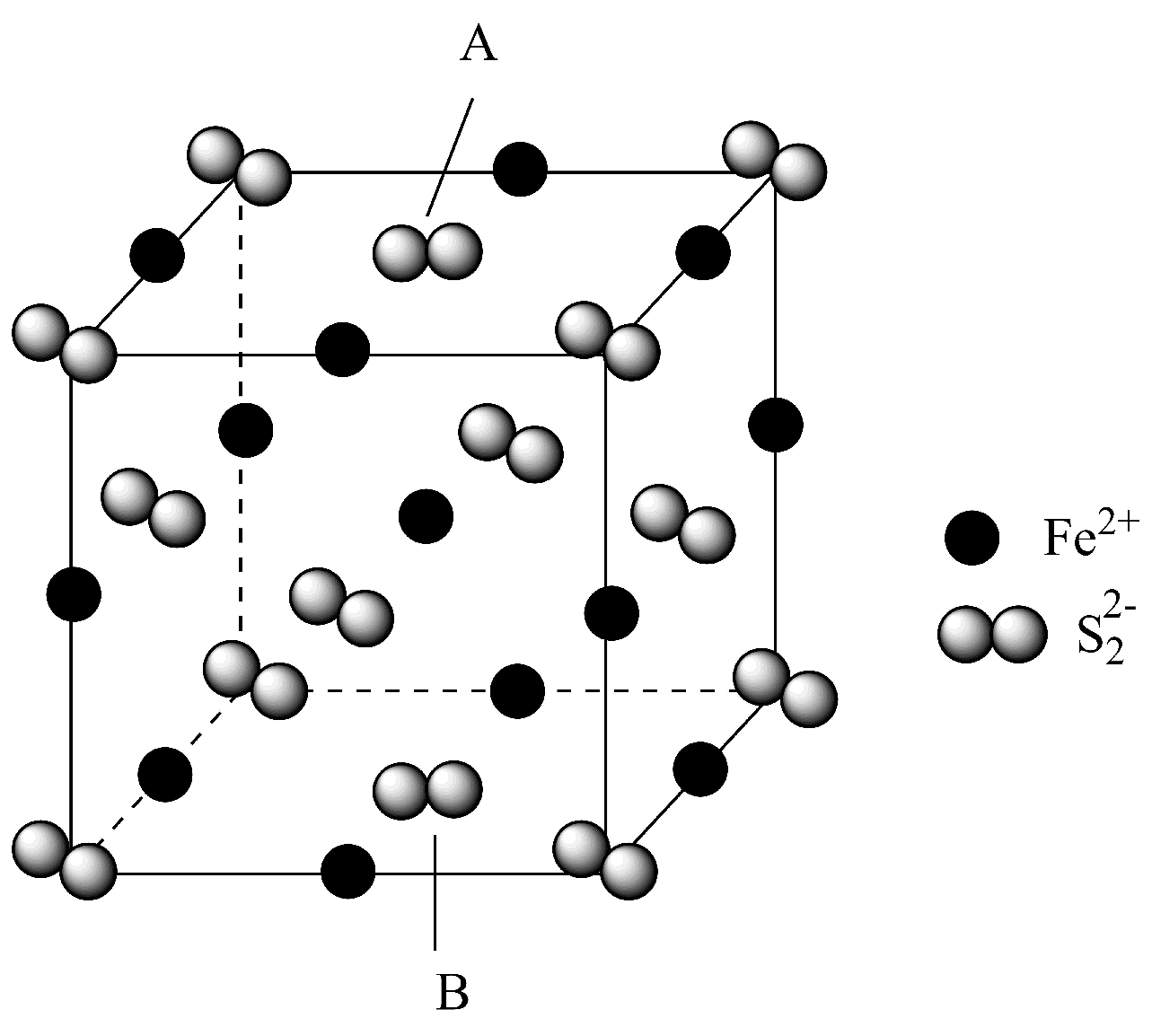 A、A、B两处的的取向可能不同 B、位于由距离最近的形成的正八面体空隙中 C、晶胞中与等距离且最近的有12个 D、晶胞边长为
A、A、B两处的的取向可能不同 B、位于由距离最近的形成的正八面体空隙中 C、晶胞中与等距离且最近的有12个 D、晶胞边长为 -
3、铜阳极泥(含有、、等元素)是一种含贵金属的可再生资源,回收贵金属的化工流程如下:
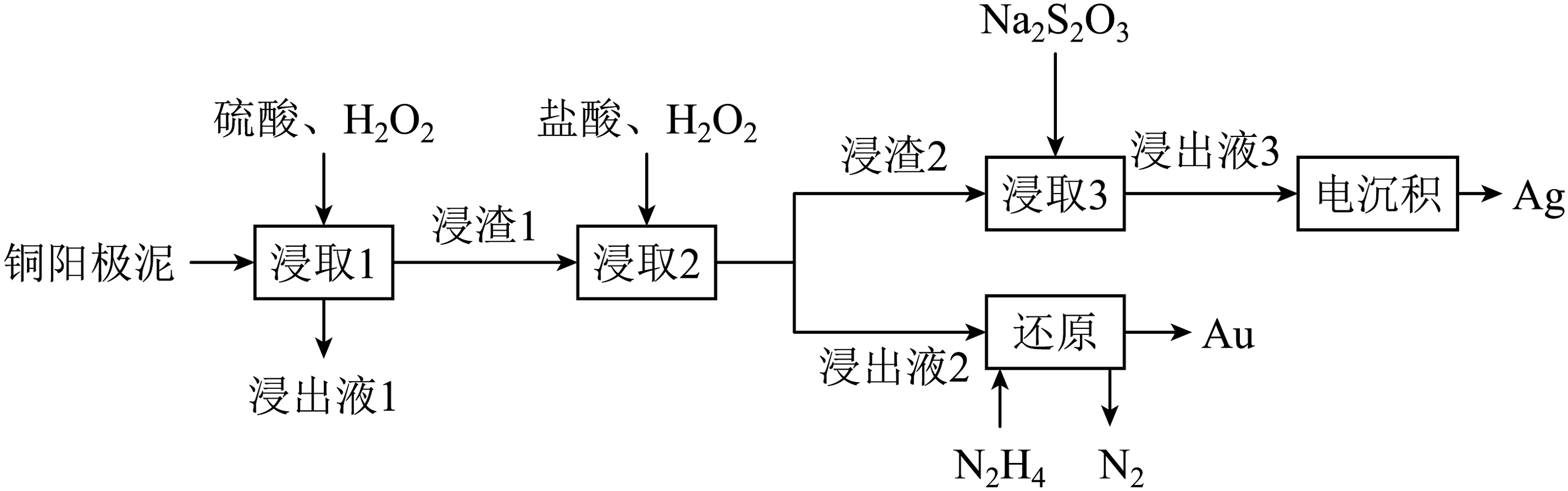
已知:①;
②“浸取2”步骤中,单质金转化为;
③“浸取3”步骤中,“浸渣2”中的AgCl转化为。
下列说法正确的是
A、“浸出液1”中含有的金属离子主要是 , 说明在“浸取1”步骤中增强了的氧化性,促进和Cu发生反应 B、“浸取2”步䯅中,应加入过量的HCl使Ag充分转化为AgCl C、“还原”步㻮中,被氧化的与产物Au的物质的量之比为 D、“真金不怕火炼”说明金的熔点高 -
4、2019年10月9日诺贝尔化学奖授予在锂离子电池方向研究有突出贡献的三位科学家。磷酸铁锂()电池是新能源汽车的主流电池,其放电时工作原理如图所示。下列说法正确的是
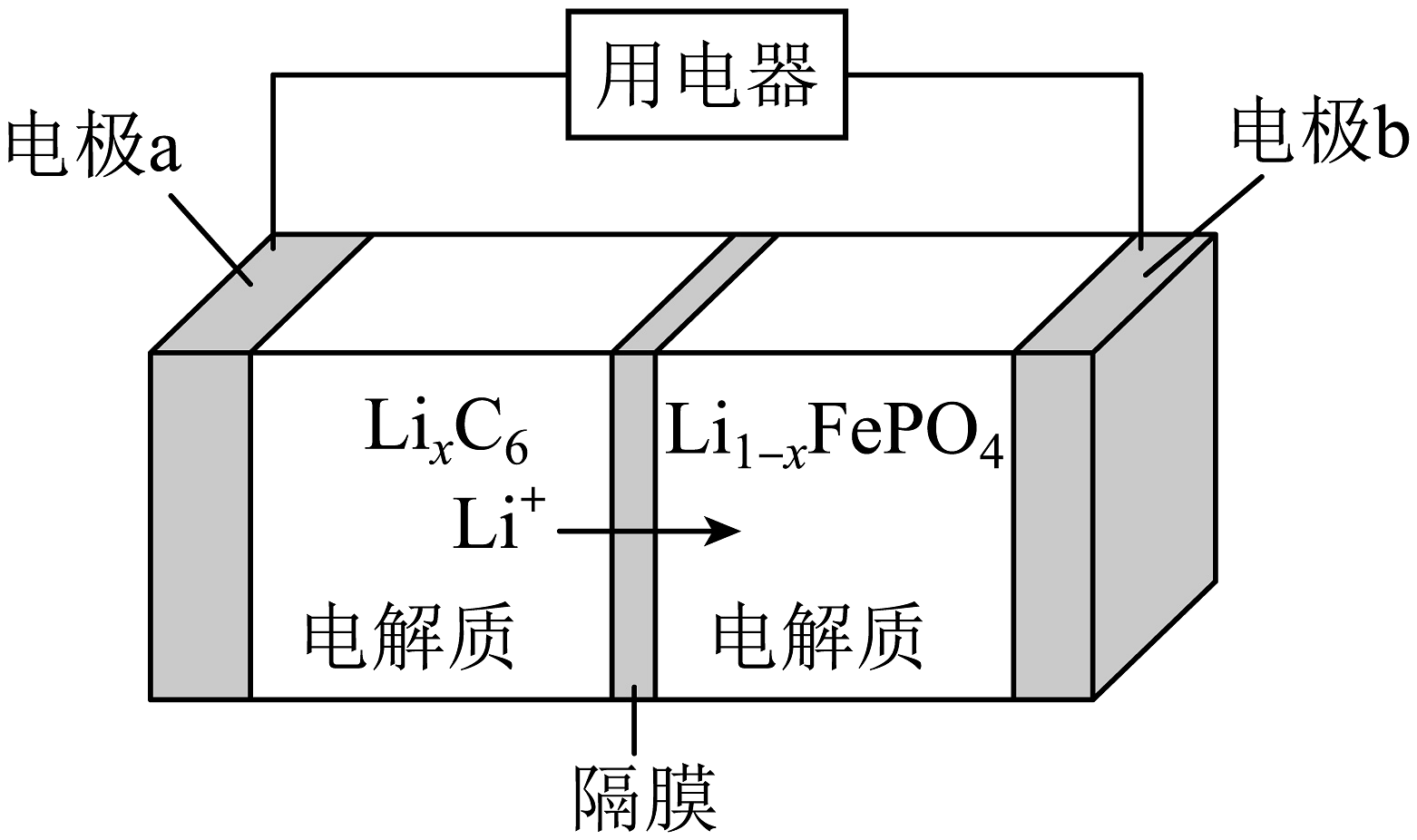 A、为了增强导电性,电解质可以配成水溶液 B、充电时,电极a与电源正极相连 C、充电时,电极b的反应式为 D、电池驱动汽车前进时,负极材料减重14g,理论上电路中转移电子
A、为了增强导电性,电解质可以配成水溶液 B、充电时,电极a与电源正极相连 C、充电时,电极b的反应式为 D、电池驱动汽车前进时,负极材料减重14g,理论上电路中转移电子 -
5、一种可为运动员补充能量的物质的分子结构式如图。已知:R、W、Z、X、Y为原子序数依次增大的短周期主族元素,Z和Y同族。下列说法正确的是
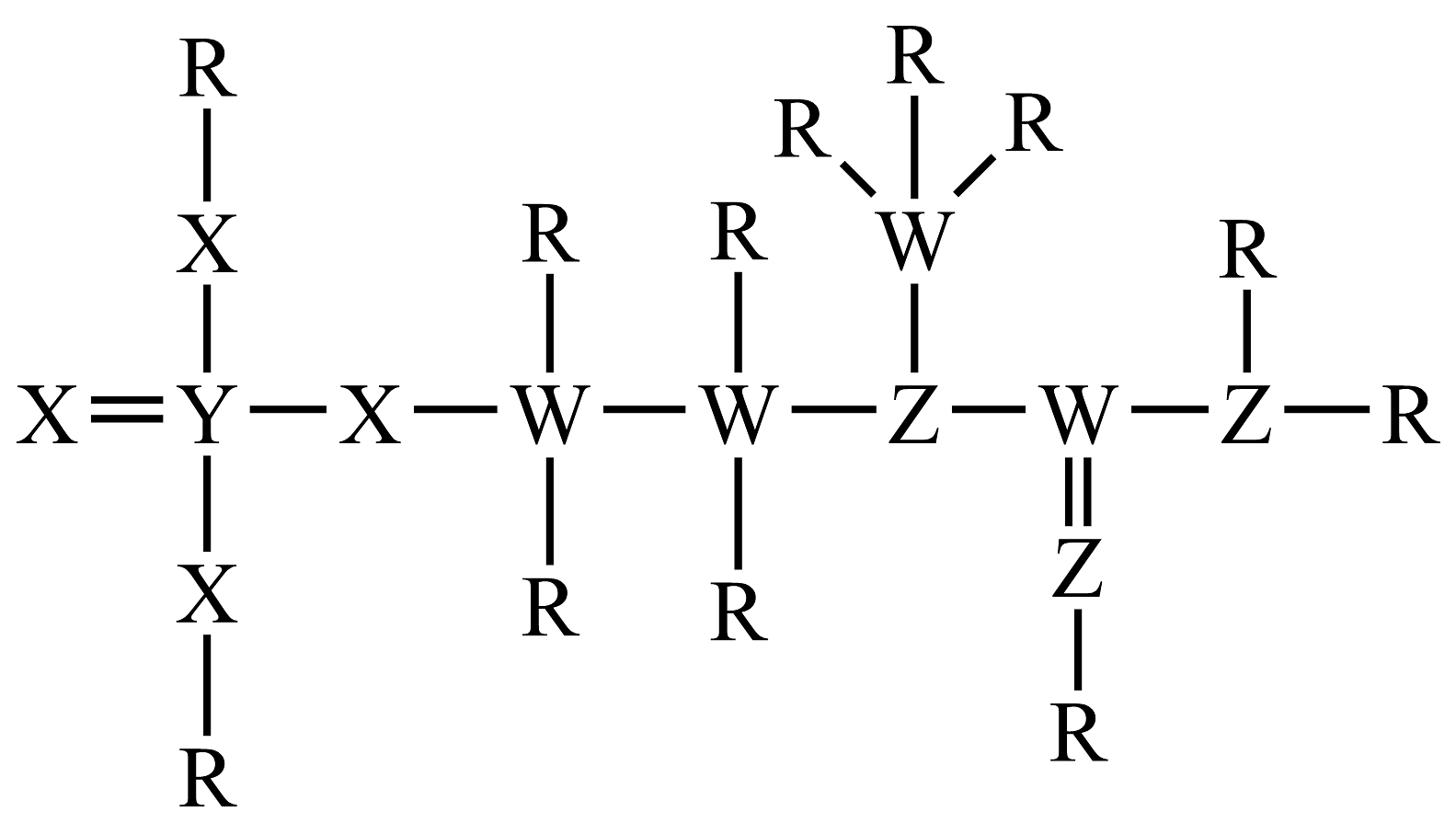 A、与两分子中的键能相同 B、第一电离能: C、为非极性分子 D、Y的最高价氧化物对应的水化物无强氧化性
A、与两分子中的键能相同 B、第一电离能: C、为非极性分子 D、Y的最高价氧化物对应的水化物无强氧化性 -
6、催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图甲所示。有氧条件下,催化还原NO的反应历程如图乙所示。下列说法正确的是
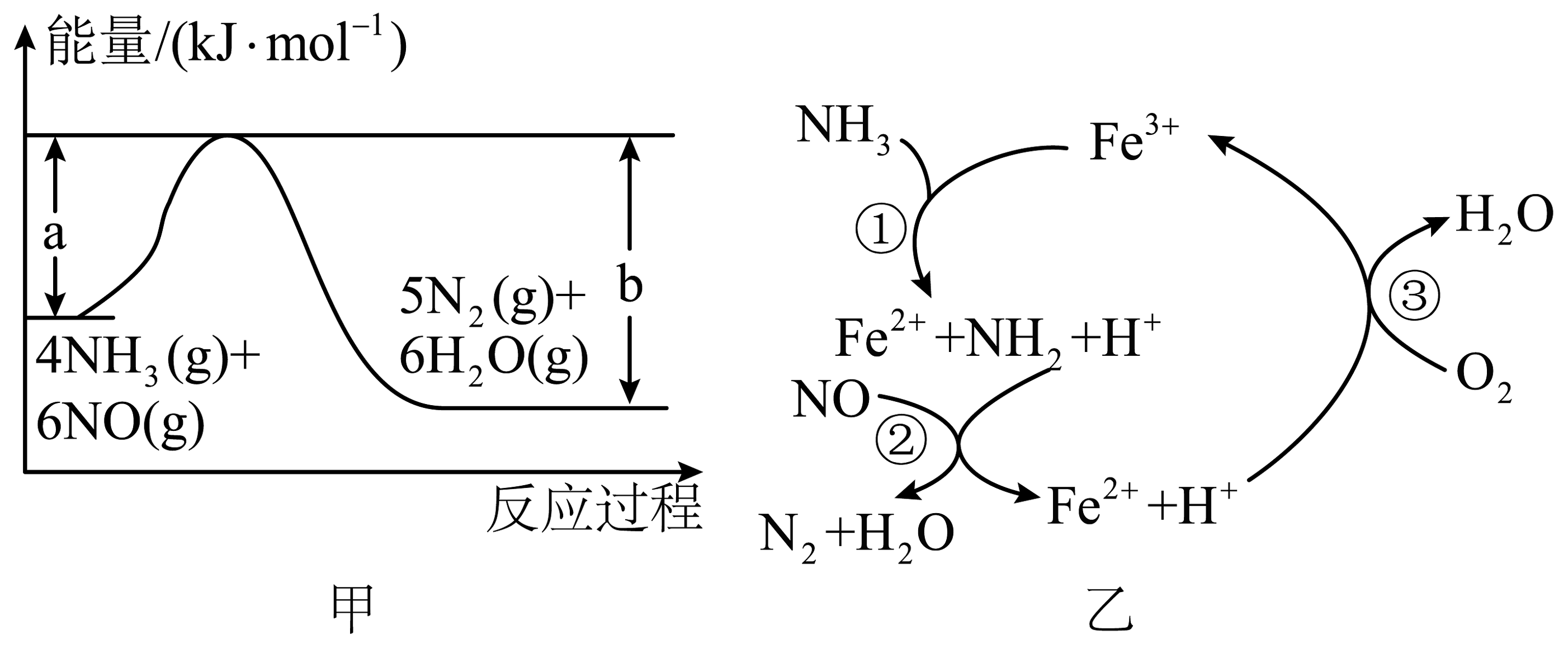 A、图甲所示热化学方程式为 B、图甲反应中既有极性共价键的断裂和形成,又有非极性共价键的断裂和形成 C、图乙所示反应③中氧化剂与还原剂物质的量之比为 D、图乙中总反应为
A、图甲所示热化学方程式为 B、图甲反应中既有极性共价键的断裂和形成,又有非极性共价键的断裂和形成 C、图乙所示反应③中氧化剂与还原剂物质的量之比为 D、图乙中总反应为 -
7、硫酸亚铁铵晶体[]是分析化学中的重要试剂,其晶体的微观结构如图1,某小组用硫酸铵和硫酸亚铁制备硫酸亚铁铵,实验装置如图2(夹持装置略),下列说法正确的是
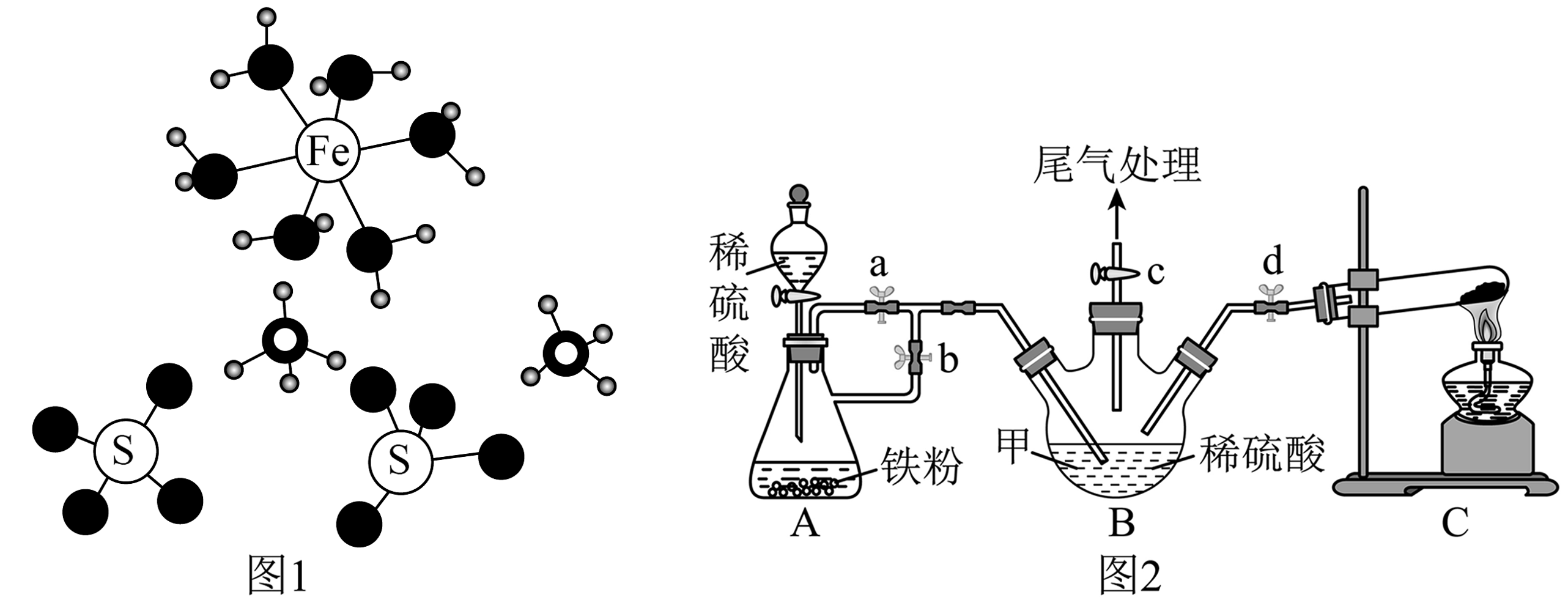 A、硫酸亚铁铵晶体中的配位数为6,微粒间的相互作用只有离子键,共价键和配位键 B、图2装置C处的试管中可加入固体制备氨气 C、图2装置A进行实验时,先打开止水夹a一段时间,再关闭a,打开止水夹b D、充分反应后,将装置B中溶液转移至蒸发皿中,经过一系列操作后,过滤、洗涤得硫酸亚铁铵晶体,为了减少产品的氧化,过滤、洗涤的速度都要尽可能快
A、硫酸亚铁铵晶体中的配位数为6,微粒间的相互作用只有离子键,共价键和配位键 B、图2装置C处的试管中可加入固体制备氨气 C、图2装置A进行实验时,先打开止水夹a一段时间,再关闭a,打开止水夹b D、充分反应后,将装置B中溶液转移至蒸发皿中,经过一系列操作后,过滤、洗涤得硫酸亚铁铵晶体,为了减少产品的氧化,过滤、洗涤的速度都要尽可能快 -
8、下列方程式书写正确的是A、在水中易转化为四羟基合铝酸钠{},Al与NaOH溶液反应的离子方程式: B、联氨()是一种二元弱碱,在水溶液中发生水解的离子方程式: C、乙酰胺在盐酸中发生反应的化学方程式: D、氮化硅()可由石英与焦炭在高温的氮气流中制备,该过程的化学方程式:
-
9、天冬氨酰苯丙氨酸甲酯是一种具有甜味的食品添加剂,又称阿斯巴甜,其稀溶液的甜度约为蔗榶的100~200倍,结构如图所示,下列关于阿斯巴甜的说法不正确的是
 A、阿斯巴甜易与水形成氢键,所以它可溶于水,但难溶于乙醇 B、阿斯巴甜含有四种官能团 C、阿斯巴甜不适合碱性条件下烘焙的食品 D、阿斯巴甜可在体内代谢为天冬氨酸(
A、阿斯巴甜易与水形成氢键,所以它可溶于水,但难溶于乙醇 B、阿斯巴甜含有四种官能团 C、阿斯巴甜不适合碱性条件下烘焙的食品 D、阿斯巴甜可在体内代谢为天冬氨酸( )、苯丙氨酸和甲醇
)、苯丙氨酸和甲醇
-
10、用红色激光笔分别照射溶液和胶体,在与光束垂直的方向进行观察,胶体中观察到丁达尔效应,而溶液无此现象,下列说法不正确的是A、胶体中观察到丁达尔效应的原因是:胶体粒子的直径为 , 小于可见光的波长,能使光波发生散射 B、激光的产生与原子核外电子跃迁释放能量有关 C、由于呈蓝色,故溶液显蓝色 D、向溶液中滴加过量氨水,溶液颜色变深蓝色
-
11、下列相关仪器或装置使用不正确的是
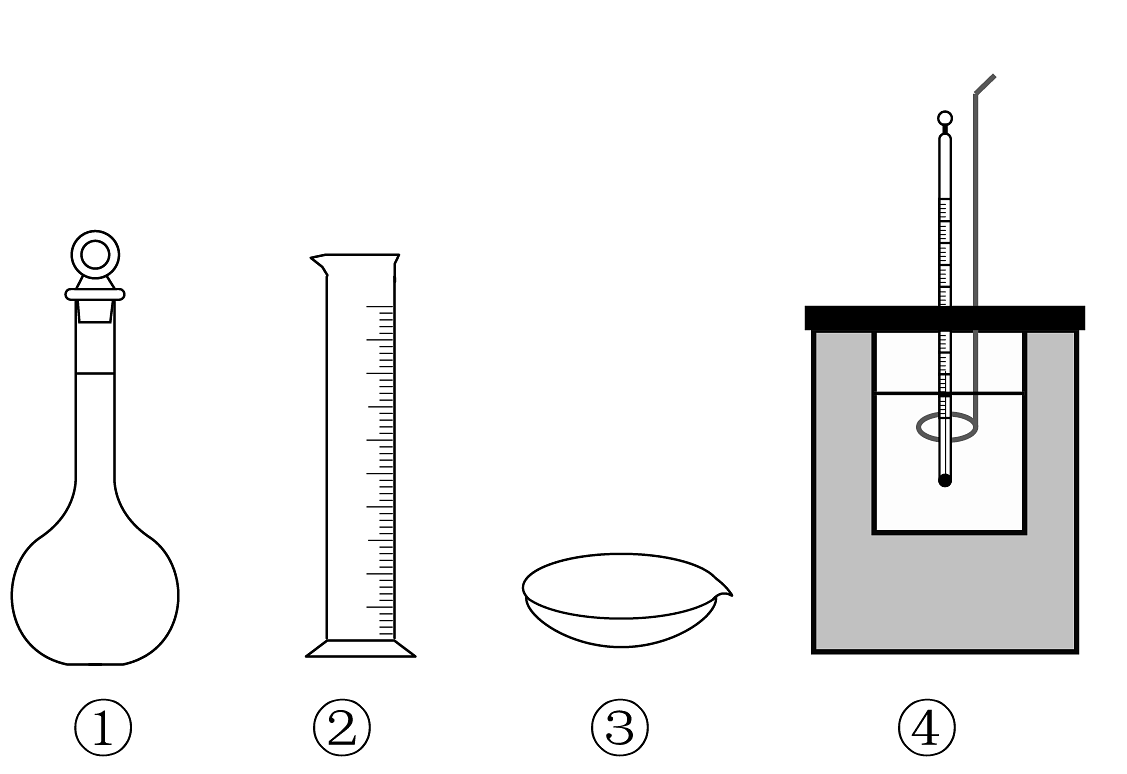 A、仪器①使用完毕,洗净,晾干后应在磨口玻璃瓶塞和瓶口处垫一张纸条,以免瓶塞和瓶口粘连 B、在中和滴定实验中,可以用仪器②量取待测液 C、将硫黄粉末放置仪器③中,加热至熔融,自然冷却获得硫晶体 D、装置④可用于中和热的测定
A、仪器①使用完毕,洗净,晾干后应在磨口玻璃瓶塞和瓶口处垫一张纸条,以免瓶塞和瓶口粘连 B、在中和滴定实验中,可以用仪器②量取待测液 C、将硫黄粉末放置仪器③中,加热至熔融,自然冷却获得硫晶体 D、装置④可用于中和热的测定 -
12、下列化学用语表示不正确的是A、的电子式:
 B、的球棍模型:
B、的球棍模型: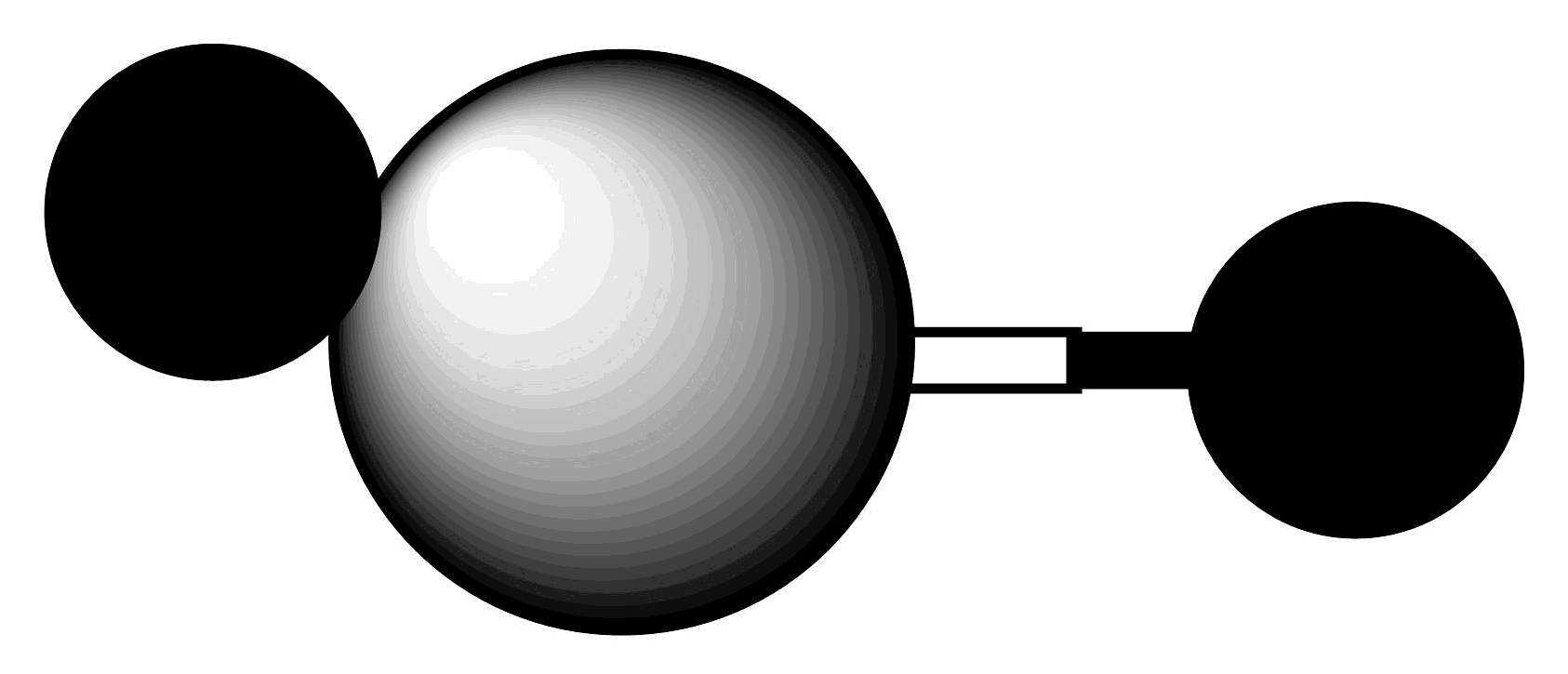 C、晶体的微观投影图:
C、晶体的微观投影图: D、分子中键的形成:
D、分子中键的形成: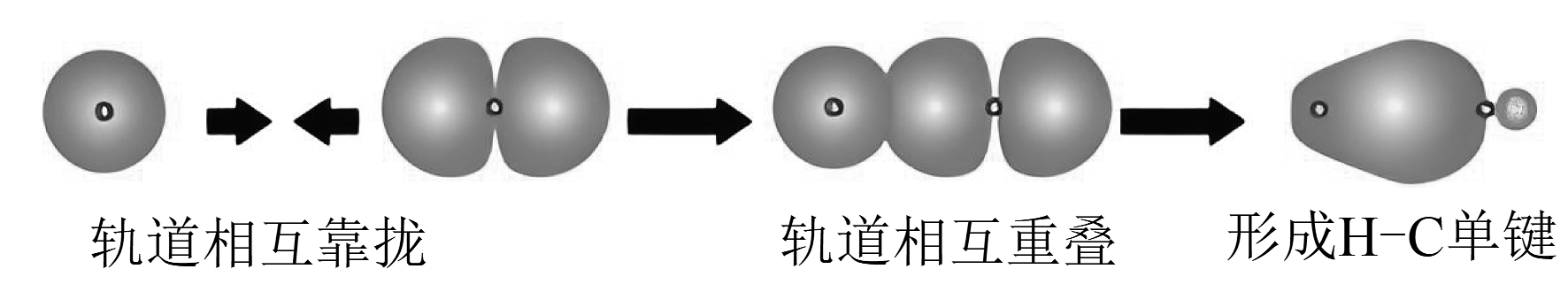
-
13、资源的开发与利用是当今社会重要的研究主题之一,化学在海水资源的开发利用中发挥着重要的作用。下列说法正确的是A、蒸馏法淡化海水,历史悠久,技术,工艺成熟,能耗最低 B、反渗透法淡化海水,所使用的高分子分离膜主要为有机高分子材料 C、电渗析法淡化海水过程中,化学能转化为电能 D、海水中含量最多的化学元素为Cl和Na
-
14、化合物H是一种合成药物中间体,一种合成化合物H的人工合成路线如图所示。

已知:Ⅰ.同一个碳原子上连两个羟基时不稳定,易发生反应:
 ;
;Ⅱ.。
请回答下列问题:
(1)、A(填“存在”或“不存在”)顺反异构体。(2)、B→C经历了先加成再消去的反应过程,中间产物的结构简式为。(3)、反应③所加试剂及条件为 , 反应④的反应类型为。(4)、由G生成H的化学方程式为。(5)、E的含氧官能团的名称是。满足下列条件的E的同分异构体有种(不考虑立体异构),写出其中核磁共振氢谱有5组峰,且峰面积之比为的结构简式为。a.苯环上有两个对位的取代基 b.其中一个取代基为
(6)、根据以上题目信息,写出以苯和丙酮为原料制备 的合成路线流程图(无机试剂和有机溶剂任用)。
的合成路线流程图(无机试剂和有机溶剂任用)。 -
15、工业上可以利用合成 , 主要涉及以下两个反应。
反应Ⅰ.
反应Ⅱ.
(1)、已知反应Ⅲ的平衡常数 , 则反应Ⅲ的(用含的式子表示)。(2)、在催化剂作用下,将和混合充入一恒容密闭容器中同时发生反应Ⅰ和反应Ⅱ,达到平衡时的转化率和容器中混合气体的平均相对分子质量随温度变化如图。
①分析可知,反应I的正反应为(填“吸热”或“放热”)反应。
②时,容器中气体总的物质的量为 , 反应Ⅱ的化学平衡常数。
③同时提高的平衡转化率和平衡时的选择性,应选择的反应条件为(填字母)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
④若向3.0MPa恒压密闭容器中通入体积比的混合气体,在1mol催化剂作用下只发生反应Ⅰ: , 测得时空收率(表示单位物质的量催化剂表面物质的平均生成速率)随温度的变化曲线如图所示。则169℃与223℃时,的平均反应速率之比为。甲醇时空收率随温度升高先增大后减小,请解释减小的可能原因是。
 (3)、通过电催化将转化为的装置如图所示。
(3)、通过电催化将转化为的装置如图所示。
①Pt电极是(填“阴极”或“阳极”)。
②若忽略电解液体积变化,电解过程中阴极室的浓度基本不变,写出阴极电极反应式。
-
16、乙烯利(
 )是一种农用植物生长调节剂,广泛应用于农作物增产和储存。常温下,乙烯利为固体,具有一定的腐蚀性,易溶于水,所得溶液显酸性。某实验小组同学用40%乙烯利溶液和稍过量的NaOH固体为原料制备乙烯。
)是一种农用植物生长调节剂,广泛应用于农作物增产和储存。常温下,乙烯利为固体,具有一定的腐蚀性,易溶于水,所得溶液显酸性。某实验小组同学用40%乙烯利溶液和稍过量的NaOH固体为原料制备乙烯。回答下列问题:
(1)、部分实验仪器及药品的选择和使用。①配制100g40%乙烯利溶液时,下图所示仪器不需要的是(填仪器名称)。

②装瓶时,不小心将乙烯利溶液滴到手上,应先用大量水冲洗,再涂抹(填序号)。
A.生理盐水 B.医用酒精 C.烧碱溶液 D.3%~5%的小苏打溶液
(2)、根据反应原理设计下图所示的装置制备乙烯气体。
①已知电负性 , 乙烯利中P的化合价为。
②用40%乙烯利溶液与NaOH固体反应(磷转化为)生成乙烯的化学方程式为。
③当观察到时,即可关闭活塞1,打开活塞2,用气囊收集乙烯气体。
(3)、实验室也可以使用乙烯利固体与强碱溶液混合制备乙烯。分别使用KOH溶液、NaOH溶液与乙烯利固体混合制备乙烯气体,现象如下:试剂
现象
溶液
产气速率快,气流平稳,无盐析现象
溶液
产气速率快,气流平稳,有盐析现象
①通过上述现象分析可知,应选用30%(填“KOH”或“NaOH”)溶液与乙烯利固体混合制备乙烯气体,原因是。
②在实验中,乙烯利固体的质量为10.0g(强碱溶液足量),制得的乙烯气体恰好能使含的酸性高锰酸钾溶液完全褪色,则产品的产率为[已知M(乙烯利)]。
-
17、在钐钴永磁材料的成型加工过程中,会产生合金渣(含有Sm、Co、Cu、Fe)。从该合金渣提取钴(Co)和钐(Sm)的一种工艺流程如下。

已知:是一种稀土元素,活动性介于Na与Al之间。
回答下列问题:
(1)、与Co同周期同族的元素还有Fe和(填元素符号)。(2)、工业上可通过(填“电解”“热还原”或“热分解”)法制备Sm。(3)、“浸渣”的主要成分是;“破碎酸浸”过程中Sm发生反应的化学方程式为。(4)、“沉铁”过程中加入氨水的主要目的是调节pH。结合图中实验数据可知,溶液的最佳pH为。的实际用量通常要大于理论用量,原因是。 (5)、“”隔绝空气“灼烧”得 , 反应的化学方程式为。(6)、Sm、Ni、O形成的稀土镍基氧化物的晶胞结构中Sm和O如图所示,Ni位于O形成的正八面体空隙中,则该稀土镍基氧化物的化学式为。
(5)、“”隔绝空气“灼烧”得 , 反应的化学方程式为。(6)、Sm、Ni、O形成的稀土镍基氧化物的晶胞结构中Sm和O如图所示,Ni位于O形成的正八面体空隙中,则该稀土镍基氧化物的化学式为。
-
18、常温下,用盐酸滴定弱碱MOH溶液,溶液中pH、分布系数随滴加盐酸体积V(盐酸)的变化关系如图所示,[比如的分布系数: , 已知:。下列说法错误的是
 A、 B、MOH的电离平衡常数是 C、a点: , D、时,
A、 B、MOH的电离平衡常数是 C、a点: , D、时, -
19、近年来,研究者开发出新工艺利用乙酸合成乙酸乙酯,使生产成本明显降低。向密闭容器中充入等物质的量的乙烯(g)与乙酸(g),发生的反应为 , 测得在不同压强下乙酸乙酯的平衡产率随温度(T)的变化关系如图所示。下列说法错误的是
 A、正反应速率: B、a、c、d点对应的压强平衡常数之比为 C、该反应在任何温度下都不能自发进行 D、该反应的正反应活化能大于逆反应的活化能
A、正反应速率: B、a、c、d点对应的压强平衡常数之比为 C、该反应在任何温度下都不能自发进行 D、该反应的正反应活化能大于逆反应的活化能 -
20、精炼铜产生的铜阳极泥富含Cu、Ag、Au等多种元素。研究人员设计了一种从铜阳极泥中分离提收金和银的流程,如下图所示。

下列说法正确的是
A、浸取1和浸取2中温度越高,反应速率越快 B、相同条件下,等浓度的在盐酸环境中的氧化性比硫酸环境中的氧化性强 C、可用氨水分离AgCl与其他难溶杂质 D、“还原”步骤中,产物和Au的物质的量之比为