相关试卷
-
1、在金催化剂表面反应的历程如图所示。
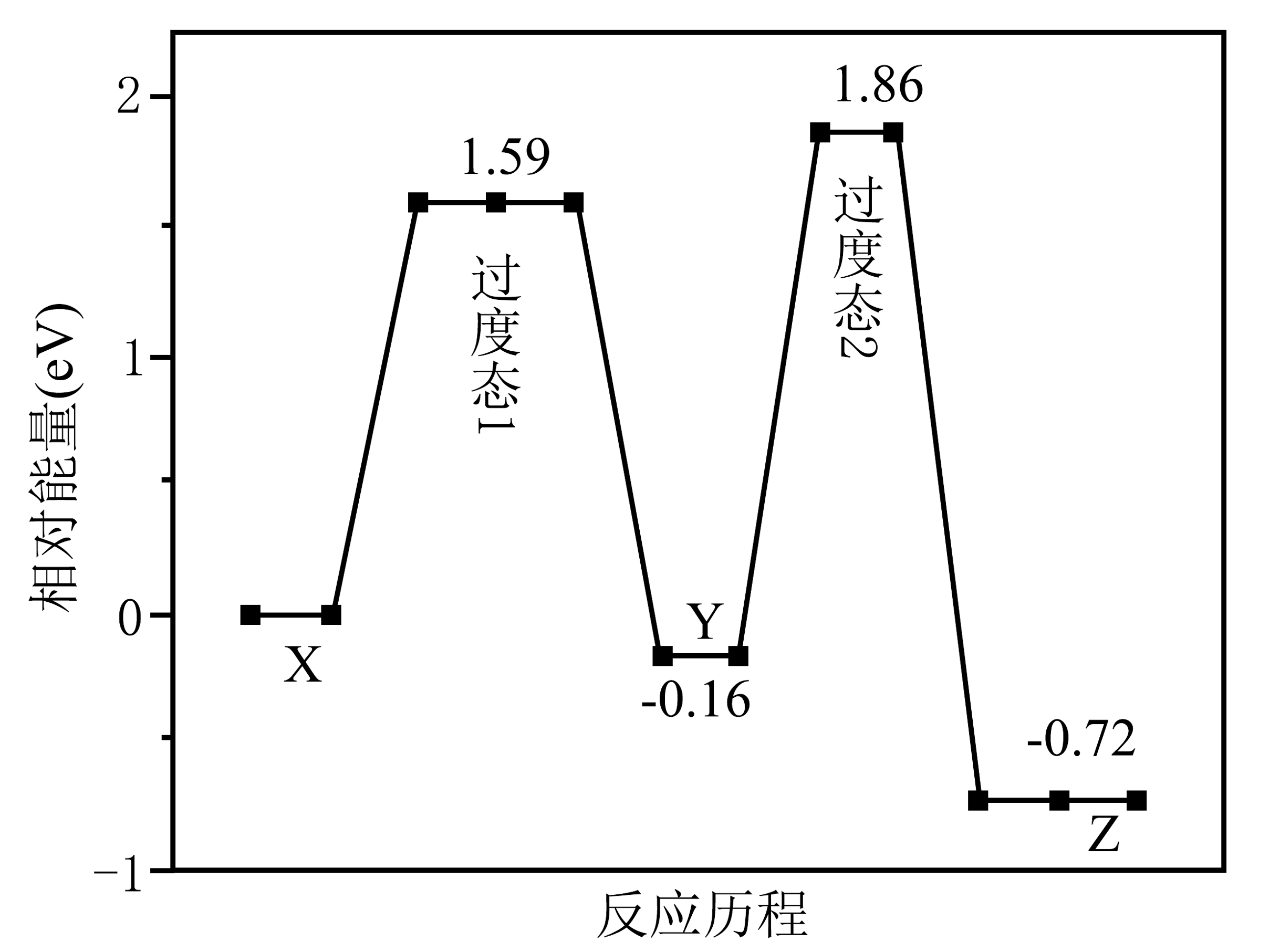
下列叙述错误的是
A、总反应分两步进行 B、总反应的 C、是中间产物 D、 -
2、合成氨的热化学方程式为 , 下列有关叙述错误的是A、反应物的总能量大于生成物的总能量 B、生成1mol (g)时放出19.3kJ的热量 C、形成化学键放出的总能量大于断裂化学键吸收的总能量 D、将1mol (g)与3mol (g)置于密闭容器中充分反应后放出热量为38.6kJ
-
3、对于可逆反应A(g)+3B(s)⇌2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是A、v(C)=0.2 mol·L-1·s-1 B、v(B)=0.4 mol·L-1·s-1 C、v(D)=6 mol·L-1·min-1 D、v(A)=5 mol·L-1·min-1
-
4、现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期主族元素,它们的原子序数依次增大。请根据下列相关信息,回答问题:
相关信息
元素的核外电子数和其电子层数相等,是宇宙中含量最丰富的元素
A
空气中含量最多的元素
B
地壳中含量最多的元素
C
同周期中原子半径最小的元素
D
元素的原子核外最高能层的p轨道半满
E
元素的原子核外s电子与p电子的数目之比为2:3
F
(1)、按电子排布, A元素位于区,基态F原子核外电子的空间运动状态有种。(2)、写出B单质的电子式 , 基态D原子的核外电子排布式 , 基态E原子的价层电子轨道表示式。(3)、B、C、D、E四种元素中,原子半径从大到小的顺序为(用元素符号表示),B、C、E三种元素最简氢化物的稳定性由大到小的顺序(用化学式表示) -
5、请回答下列问题:(1)、写出稀氨水中一水合氨的电离方程式;若想增大该溶液中的浓度而不增大OH-的浓度,应采取的措施是(忽略溶液体积的变化)(填字母)。
A.适当升高温度 B.加入NH4Cl固体 C.通入NH3 D.加入少量浓盐酸
(2)、将0.1mol/L的CH3COOH溶液加水稀释,下列有关稀释后醋酸溶液的说法正确的是___________(填字母)。A、电离程度增大 B、溶液中离子总数增多 C、溶液导电性增强 D、溶液中醋酸分子增多(3)、磷能形成次磷酸(H3PO2)、亚磷酸(H3PO3)等多种含氧酸。H3PO2是一元中强酸,其中磷元素的化合价为;写出其电离方程式:;推测NaH2PO2是(填“正盐”或“酸式盐”)。(4)、已知25℃,NH3·H2O的溶液中, , H2SO3的 , , 若氨水的浓度为2.0mol/L,溶液中的。将SO2通入该氨水中,当为10-7mol/L时,溶液中的。 -
6、
I.工业上用H2和CO工合成甲醇的反应为:①
该反应平衡常数(K)随温度的变化情况如下表所示。
温度/℃
250
300
350
K
2.041
0.270
0.012
完成下列填空:
(1)请书写出该反应的平衡常数表达式。
(2)250℃时,测得各组分浓度如下表所示,通过计算得出浓度商Q为(填数值,保留三位小数),则此时v(正)v(逆)。(填“>”、“<”或“=”)
物质
H2
CO
CH3OH
浓度/mol·L-1
0.30
1.6
0.70
Ⅱ.工业上也能采用CO2催化氢化的方法合成甲醇:
②
已知:
(3)写出CO2催化氢化合成甲醇的热化学方程式:。
(4)想要增大反应②的平衡常数,能改变的条件是。
Ⅲ.甲醇是一种重要的化工原料和新型燃料。如图是甲醇燃料电池工作的示意图,工作时,关闭K。

(5)甲中负极的电极反应式为。
(6)若丙中C为铝,D为石墨,W溶液为稀H2SO4 , 若一定条件下铝钝化形成致密Al2O3 , 则C电极反应式为。
(7)若把乙装置改为铁钉镀铜装置,铁钉是电极(A、B),该电极上发生反应(氧化、还原)。
-
7、填空(1)、断开气态物质中1mol某种共价键生成气态原子需要吸收的能量称为键能(kJ·mol−1)。如表所示是一些共价键的键能。
共价键
H-H
N≡N
N-H
键能(kJ·mol-1)
436
946
391
根据上表的数据,在合成1mol氨(“放出”或“吸收”)的热量为kJ。
(2)、在2L容器中投入2molSO2和bmolO2 , 下图是部分反应物与生成物随时间的变化曲线。
①10min时v(正)v(逆)(填“大于”或“小于”或“等于”);0~10min内,v(SO3)=。
②平衡时,SO2的转化率为。
③下列条件能够加快反应速率的是。
A.升高温度
B.保持压强不变,充入He使容积增大
C.保持体积不变,充入He使压强增大
D.充入一定量的氧气
④下列情况能说明该反应达到化学平衡的是。
A.v(SO3)=v(SO2)
B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变
D.混合气体的总物质的量不再改变
E.SO2、O2、SO3的物质的量之比达到2∶1∶2
-
8、已知:常温下, , , 向1L含0.05mol Fe2(SO4)3和0.1mol FeSO4的酸性混合溶液中通入NH3 , 至该溶液的pH为2,溶液体积变化可忽略不计,所得溶液中的值为A、1:1 B、 C、 D、
-
9、科学探究是化学学科核心素养之一,下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
向Na2SiO3溶液中通入少量NO2
有透明凝胶生成
非金属性:N>Si
B
向两支盛有5mL0.1mol·L-1的H2O2溶液的试管中,一支加入2滴0.05mol·L-1的Fe2(SO4)3溶液,另一支加入2滴0.01mol·L-1CuSO4溶液
前者产生气泡较快
催化能力:Fe3+>Cu2+
C
取5mL0.1mol·L-1KI溶液于试管中,加入10mL0.1mol·L-1FeCl3溶液,充分反应后萃取分液,向水层加KSCN溶液
水层溶液变红
KI与FeCl3的反应是可逆反应
D
向足量NaOH溶液中先加入少量MgCl2溶液,充分反应后加入CuCl2溶液
先产生白色沉淀,后产生蓝色沉淀
:
A、A B、B C、C D、D -
10、下列指定反应的离子方程式正确的是A、用醋酸除去水垢: B、KClO碱性溶液与反应: C、向硫酸铝溶液中滴加碳酸钠溶液: D、电解饱和食盐水获取烧碱和氯气:
-
11、下列依据热化学方程式得出的结论正确的是A、 , 则 B、已知 ; ;则 C、已知31g白磷比31g红磷能量多bkJ,则P4(白磷,s)=4P(红磷,s) D、已知 , 则氢气燃烧热
-
12、已知 , 在V2O5存在时,该反应机理为:①(快)②(慢),下列说法错误的是A、该反应速率主要由第②步基元反应决定 B、V2O5为该过程的催化剂,VO2为中间产物 C、V2O5的存在提高了该反应的反应速率和产率 D、催化剂能降低反应的活化能,提高活化分子百分数
-
13、现有三种元素的基态原子的电子排布式如下:①1s22s22p63s23p1;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是A、第一电离能:③>②>① B、原子半径:③>②>① C、电负性:③< ②< ① D、最高正化合价:③>②>①
-
14、下列关于元素周期表的描述正确的是A、有7个周期,18个族 B、第IA族元素也称为碱金属元素 C、元素种类最多的族为第IIIB族 D、He的价电子层为1s2 , 属于s区元素
-
15、铜的还原性较弱,不能与稀硫酸反应被稀硫酸氧化。某学生根据所学知识,欲实现Cu+H2SO4=CuSO4+H2↑反应,设计了四个实验,如图所示,你认为可行的实验是:A、
 B、
B、 C、
C、 D、
D、
-
16、基本概念和理论是化学思维的基石。下列叙述错误的是A、理论认为模型与分子的空间结构相同 B、元素性质随着原子序数递增而呈周期性变化的规律称为元素周期律 C、泡利原理认为一个原子轨道内最多只能容纳两个自旋相反的电子 D、杂化轨道由1个s轨道和3个p轨道混杂而成
-
17、下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
①
②
③
④
⑤
⑥
⑦
⑧
(1)、元素Cs在周期表中的位置是 , ⑤的阳离子结构示意图为。(2)、元素Se在周期表中的位置如上方周期表所示,预测具有一定性(填写“氧化”、“还原”或“氧化和还原”)。Se与⑦的简单氢化物稳定性较强的是(填写化学式)。(3)、在元素周期表中,存在对角线相似,即某些主族元素与其右下方的主族元素的性质相似的(如锂和镁,铍和铝)。根据周期表对角线规律,金属Be单质及其化合物的性质与铝单质及其化合物的性质相似。写出Be与NaOH溶液反应的离子方程式________。(4)、M同学利用下图探究N、C、Si的非金属性大小,试剂X是________。 (5)、单质①在单质⑧中安静燃烧,火焰呈________色,可以证明燃烧反应不一定需要氧气参加。(6)、写出一条能证明④的非金属性强于③的实验事实________。
(5)、单质①在单质⑧中安静燃烧,火焰呈________色,可以证明燃烧反应不一定需要氧气参加。(6)、写出一条能证明④的非金属性强于③的实验事实________。 -
18、
I.实验小组利用传感器探究和的性质。
【查阅资料】越小,浓度越小,溶液碱性越弱。
【实验过程】
编号
实验操作
实验数据
实验①
测量下述实验过程的温度变化


实验②
测量下述实验过程的变化


【分析与解释】
(1)实验①中,溶解时吸收热量的物质是________。(填化学式)
(2)实验②中,未参与该反应的实验证据是________。
(3)实验②中,滴加溶液的pH变化与滴加溶液的有明显差异,原因是滴加溶液的烧杯中,参与反应的离子有________。
(4)工业上制得的纯碱中常含有一定量的 , 取质量为5.00g的纯碱样品,充分加热后,质量减少0.155g,此样品中的质量分数________。(保留3位有效数字)
II.可用和制备漂粉精,漂粉精常用于游泳池的消毒。已知微生物的细胞膜表面是带有负电荷的,池水的酸碱性对漂粉精的消毒效果影响明显。
(5)写出制备漂粉精的化学方程式________。
(6)新制氯水中,能透过细胞膜起消毒杀菌作用的微粒是________(填化学式),若池水碱性过强,消毒作用会________(填“增强”或“减弱”)。
(7)若池水酸性过强,会刺激眼睛和皮肤。有时加入小苏打以降低酸性,起到降低酸性作用的离子方程式是________。
-
19、明矾[]在造纸、净水等方面应用广泛,实验室以铝灰为原料制各明矾的流程下图所示。

已知:①铝灰含、为和少量;
②不溶于强酸;
③氨水的主要成分是 , 是一元弱城,其电离方程式:
④不同温度的溶解度:
温度/℃
0
10
20
30
40
60
80
90
/g
3.00
3.99
5.90
8.39
11.7
24.8
71.0
109
回答下列问趣:
(1)、“酸漫”后溶液中主要的金属离子有、。“滤渣I”的主要成分为。(填化学式)(2)、①“氧化”过程中的作用是(用离子方程式表示)。②的“氧化效率”与温度的关系如图所示,试解释温度过高,“氧化效率”降低的可能原因是。
 (3)、溶液的pH对铝、铁沉淀率的影响如图所示。“调pH”时应控制溶液的pH范围为________。(填编号)
(3)、溶液的pH对铝、铁沉淀率的影响如图所示。“调pH”时应控制溶液的pH范围为________。(填编号)
A.3.0~3.5 B.4.0~4.5 C.4.5~5.0
(4)、若某工厂研究小组为了避免滤液中含有 , 干扰明矾的制备,在“沉铝”中选择加入溶液至过量,发现铝沉淀量减少,原因是________(用离子方程式表示)。(5)、得到明矾晶体的“系列操作”包括、、过滤、洗涤、干燥。 -
20、实验制备收集干燥纯净的氯气,并探究其性质。所用仪器及药品如图所示:
 (1)、上述实验制取氯气的离子反应方程式为________。(2)、选择上述仪器制备收集干燥纯净的氯气,并按顺序连接(填各接口处的字母):a________i。(3)、如下图所示,在A处缓慢通入干燥的氯气。当打开B处的弹簧夹时,C处的红布条看不到明显现象;当关闭B处的弹簧夹后,C处的红布条逐渐褪色。则D瓶中盛放的溶液可能是___________。(填编号)
(1)、上述实验制取氯气的离子反应方程式为________。(2)、选择上述仪器制备收集干燥纯净的氯气,并按顺序连接(填各接口处的字母):a________i。(3)、如下图所示,在A处缓慢通入干燥的氯气。当打开B处的弹簧夹时,C处的红布条看不到明显现象;当关闭B处的弹簧夹后,C处的红布条逐渐褪色。则D瓶中盛放的溶液可能是___________。(填编号) A、饱和溶液 B、浓溶液 C、足量溶液 D、浓硫酸(4)、某学习小组拟用手持技术对新制饱和氯水进行检测,下列图像变化最不可能的是___________。(填编号)
A、饱和溶液 B、浓溶液 C、足量溶液 D、浓硫酸(4)、某学习小组拟用手持技术对新制饱和氯水进行检测,下列图像变化最不可能的是___________。(填编号) A、图1说明光照使氯水的酸性增强,新制氯水需避光保存 B、图2说明久置的氯水失去漂白能力 C、电导率是表示物质传输电流能力强弱的一种测量值,图3表示氯水的电导率随时间的变化趋势 D、图4说明光照时氯水中的某种成分分解产生氧气(5)、是一种灰黑色的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:取一定量的溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设。
A、图1说明光照使氯水的酸性增强,新制氯水需避光保存 B、图2说明久置的氯水失去漂白能力 C、电导率是表示物质传输电流能力强弱的一种测量值,图3表示氯水的电导率随时间的变化趋势 D、图4说明光照时氯水中的某种成分分解产生氧气(5)、是一种灰黑色的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:取一定量的溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设。假设1:被氧化
假设2:被氧化。
请你完成下表,验证假设:
实验操作
预期现象
得出结论
甲组
取少量黄色溶液于A试管中,滴加几滴淀粉溶液
①
假设1成立
乙组
取少量黄色溶液于B试管中,滴加几滴②
溶液变红
假设2成立
③甲组同学得出结论“可将氧化”,其反应的离子方程式为。
④丙组同学认为乙组实验不够严谨:加入少量的氯水,只能与还原性强的离子先反应;
丙组改进了实验:用煮沸冷却后的水配制溶液,向溶液中先加入煤油,再于液面下依次加入少量新制氯水和试剂②,溶液不变红,证明假设2不成立,证明了还原性:(填“>”、“<”或“=”),煮沸的作用是。