相关试卷
-
1、第四届湖南旅游发展大会将于5月24-26日在岳阳市举行。在旅游过程中,我们可以学习到很多化学知识。以下说法正确的是A、君山银针茶叶中含有的茶多酚不易被氧化,具有抗氧化功效 B、巴陵石化生产的乙烯是一种精细化学品,其产量可衡量国家石油化工水平 C、洞庭湖的芦苇含纤维素,纤维素属于有机高分子化合物 D、岳阳楼使用的红色油漆中含有的三氧化二铁属于金属材料
-
2、镍离子和钴离子性质相似,可用如图所示装置实现二者分离。图中的双极膜中间层中的解离为和 , 并在直流电场作用下分别向两极迁移,与乙酰丙酮不反应。下列说法正确的是
 A、电流方向: B、石墨M电极的电极反应式为 C、水解离出的可以抑制Ⅱ室中的转化反应 D、导线中通过1mol电子时,Ⅰ室与Ⅲ室溶液质量变化之差约为65g
A、电流方向: B、石墨M电极的电极反应式为 C、水解离出的可以抑制Ⅱ室中的转化反应 D、导线中通过1mol电子时,Ⅰ室与Ⅲ室溶液质量变化之差约为65g -
3、
S和是自然界中硫循环的重要组成部分。
Ⅰ.S的产生与去除
(1)水体中的与在微生物作用下可转化为和S,该反应的离子方程式为。
(2)废水中的硫化物可用将其氧化为单质S进行回收。
①控制废水pH约为8,用适量30%的溶液将废水中的转化为单质S,该反应的离子方程式为。
②在1L废水中单质S回收率随加入量的变化如图所示。加入量大于12mg时,废水中单质S的回收率下降的原因可能是。

Ⅱ.烟气中的测定与利用
(3)含量的测定
如图所示,向装置通入含烟气,用含淀粉的碘水吸收(发生的反应为),当通入40L烟气时恰好完全反应,停止通入烟气;将吸收液转移至锥形瓶中,并用水洗涤装置2~3次,将洗涤液与吸收液合并;向吸收液中加入过量溶液,完全反应后过滤洗涤干燥,得到沉淀0.233g。

①判断碘水中恰好完全反应的现象为。
②计算该烟气中的含量(以为单位,写出计算过程)。
③若实验过程中未用水洗涤装置,测得的含量会(填“偏大”或“偏小”或“不变”)。
(4)的脱除
用氨水吸收过量可得溶液,再通入空气氧化,得到硫酸盐。在空气氧化时,溶液中有逸出的原因是(结合相关离子方程式分析)。
-
4、
以海水和海带为原料可制取碘化镁。
Ⅰ.海带制碘
实验室用海带制备碘单质的流程如下:

(1)为使海带灰中的碘元素充分转移至水中,可采取的措施有。
(2)含溶液中通入氯气可获得。说明性,(填“>”或“=”或“<”)。
(3)实验室进行有机溶剂萃取水中碘的实验,须使用的玻璃仪器有、烧杯。
Ⅱ.制碳酸镁
向除去的浓缩海水中通2分钟至酸性,然后在通的同时加入NaOH溶液,可得到沉淀,过滤洗涤干燥后得到。过程中海水pH随时间变化如图所示。

(4)写出生成的离子反应方程式:。
(5)先通2分钟的目的是防止制得的中混有(填化学式)。
(6)待完全沉淀后,结束时若先停止加入NaOH,海水中的产率会减小的原因是。
Ш.制碘化镁
以单质、和为原料,反应可得到溶液,同时产生和。
(7)该反应中的作用为。
(8)为提高和的利用率,须控制约为。
-
5、
以食盐水和HCl为原料均可制。
Ⅰ.以食盐水为原料制
(1)除去粗盐中含有、、等杂质离子,常用试剂为:溶液、NaOH溶液、溶液、盐酸。
①用于除去的试剂是。
②除去时,判断已沉淀完全的方法是。
③待杂质离子沉淀完全,过滤后向滤液中加入盐酸,发生反应的离子方程式有。
(2)电解饱和食盐水可得到、和NaOH。
①电解饱和食盐水转移电子的物质的量为1mol时,理论上产生在标准状况下的体积为。
②电解时有少量产生,则电解产生的(填“>”或“<”或“=”)1:1。
③电解后的溶液中产生少量的可能原因是(用化学方程式表示)。
Ⅱ.以HCl为原料制
(3)利用循环可将HCl氧化为 , 转化关系如图所示。

①反应b在340~380℃条件下进行,写出该反应的化学方程式:。
②已知:是酸性氧化物,难溶于水。溶解度如下表:
温度/℃
20
40
60
80
溶解度/g
73
77.3
87.6
96.6
请补充完整回收废催化剂(含CuO、、等)获取晶体的实验方案:取废催化剂于烧杯中, , 过滤、洗涤、干燥得晶体。
-
6、A、B、C、D、E、F、G代表7种短周期主族元素。在周期表中的位置如下:
 (1)、C、F、G三种元素原子中,半径最大的是(填元素符号)。(2)、由A、B形成的某种化合物分子中含有10个电子,写出其电子式:。(3)、F、G的最高价氧化物的水化物酸性较强的是(填酸的化学式)。(4)、D、E分别对应的最高价氧化物的水化物之间反应的离子方程式为。(5)、化合物熔融状态不导电,其含有化学键的类型为。(6)、写出一个能够说明元素C的非金属性比元素F强的化学方程式:。
(1)、C、F、G三种元素原子中,半径最大的是(填元素符号)。(2)、由A、B形成的某种化合物分子中含有10个电子,写出其电子式:。(3)、F、G的最高价氧化物的水化物酸性较强的是(填酸的化学式)。(4)、D、E分别对应的最高价氧化物的水化物之间反应的离子方程式为。(5)、化合物熔融状态不导电,其含有化学键的类型为。(6)、写出一个能够说明元素C的非金属性比元素F强的化学方程式:。 -
7、阅读下列材料,完成下面小题:
工业废碱渣的主要成分为等,水浸后用于烟气脱硫后得到 , 再经中和获得;可用于处理废水中的。相关过程如下:
 (1)、下列相关说法不正确的是A、“水浸”前先将废碱渣粉碎可加快水浸速率 B、“吸收”后脱硫烟气中的比“吸收”前烟气中的多 C、“中和”时反应的化学方程式为 D、向溶液中滴加溶液,有白色沉淀产生,说明其中含(2)、适量除去弱酸性废水中反应为:(未配平),下列有关说法正确的是A、发生氧化反应 B、是还原产物 C、反应后废水的pH减小 D、反应中每产生1mol 转移2mol电子
(1)、下列相关说法不正确的是A、“水浸”前先将废碱渣粉碎可加快水浸速率 B、“吸收”后脱硫烟气中的比“吸收”前烟气中的多 C、“中和”时反应的化学方程式为 D、向溶液中滴加溶液,有白色沉淀产生,说明其中含(2)、适量除去弱酸性废水中反应为:(未配平),下列有关说法正确的是A、发生氧化反应 B、是还原产物 C、反应后废水的pH减小 D、反应中每产生1mol 转移2mol电子 -
8、实验室用下图装置模拟侯氏制碱法原理,以NaCl、、等为原料制取少量。下列有关说法正确的是
 A、除去中的少量HCl可在乙装置中加入饱和溶液 B、用冰水浴冷却丙装置有利于析出固体 C、丙装置中析出固体的上层清液中不存在 D、丁装置是为了吸收丙装置中逸出的和
A、除去中的少量HCl可在乙装置中加入饱和溶液 B、用冰水浴冷却丙装置有利于析出固体 C、丙装置中析出固体的上层清液中不存在 D、丁装置是为了吸收丙装置中逸出的和 -
9、在指定条件下,下列选项所示的物质间转化能实现的是A、 B、 C、 D、
-
10、根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向溴水中加入等体积 , 振荡后静置,上层接近无色,下层橙红色
在中的溶解度大于在水中的溶解度
B
向新制饱和氯水中加入过量的碳酸钙粉末,振荡,有气泡产生
HClO的酸性比强
C
向久置于空气中的固体中滴加稀硫酸,有气泡产生
已完全变质为
D
将盐酸滴入少量磷酸钙[]固体中,固体逐渐溶解
Cl的非金属性强于P
A、A B、B C、C D、D -
11、下列有关钠及其化合物的性质与用途具有对应关系的是A、Na有强还原性,可用于制造高压钠灯 B、有强氧化性,可用作漂白剂 C、能与酸反应,可用于去除物品表面油污 D、水溶液呈碱性,可用于制作发酵粉
-
12、被称为“植物生长和高产的营养剂”。下列相关说法正确的是A、热稳定性: B、离子半径: C、最外层电子数: D、单质与水反应的剧烈程度:Mg>K
-
13、下列有关实验的原理、操作的说法不正确的是A、蒸发结晶是利用溶质的溶解度随温度变化有较大差异 B、用含少量水的容量瓶配制一定物质的量浓度的溶液 C、蒸馏实验中被蒸馏出的物质微粒间间距先增大后减小 D、检验草木灰中的钠元素,可根据试样在火焰上灼烧的焰色判断
-
14、根据下列实验信息,完成下面小题:
用下图装置进行实验验证浓硫酸与木炭在加热后得到的气体中含有、和。实验过程中分别观察到无水硫酸铜变蓝、品红溶液褪色、酸性高锰酸钾溶液颜色变浅、澄清石灰水中出现白色浑浊。
 (1)、下列化学用语表示正确的是A、的电子式为
(1)、下列化学用语表示正确的是A、的电子式为 B、的摩尔质量为
C、的结构示意图为
B、的摩尔质量为
C、的结构示意图为 D、中子数为8的碳原子可表示为
(2)、下列有关说法不正确的是A、中只存在共价键 B、用光照射溶液会产生光路 C、属于酸性氧化物 D、澄清石灰水变浑浊过程中分散质粒子变大(3)、下列有关实验现象分析不正确的是A、无水硫酸铜变蓝证明气体中有 B、品红溶液褪色证明气体中有 C、酸性高锰酸钾溶液颜色变浅证明有漂白性 D、澄清石灰水中出现白色浑浊证明气体中有(4)、下列有关反应表示正确的是A、木炭与浓硫酸反应: B、二氧化硫溶于水: C、酸性高锰酸钾溶液颜色变浅: D、澄清石灰水中出现白色浑浊:
D、中子数为8的碳原子可表示为
(2)、下列有关说法不正确的是A、中只存在共价键 B、用光照射溶液会产生光路 C、属于酸性氧化物 D、澄清石灰水变浑浊过程中分散质粒子变大(3)、下列有关实验现象分析不正确的是A、无水硫酸铜变蓝证明气体中有 B、品红溶液褪色证明气体中有 C、酸性高锰酸钾溶液颜色变浅证明有漂白性 D、澄清石灰水中出现白色浑浊证明气体中有(4)、下列有关反应表示正确的是A、木炭与浓硫酸反应: B、二氧化硫溶于水: C、酸性高锰酸钾溶液颜色变浅: D、澄清石灰水中出现白色浑浊: -
15、中国“祝融号”火星探测器探测发现火星上存在矿物。该物质所含元素属于第二周期的是A、Mg B、Si C、Fe D、O
-
16、甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g)⇌CH3OH(g)。(1)、CO的平衡转化率与温度、压强的关系如图所示。
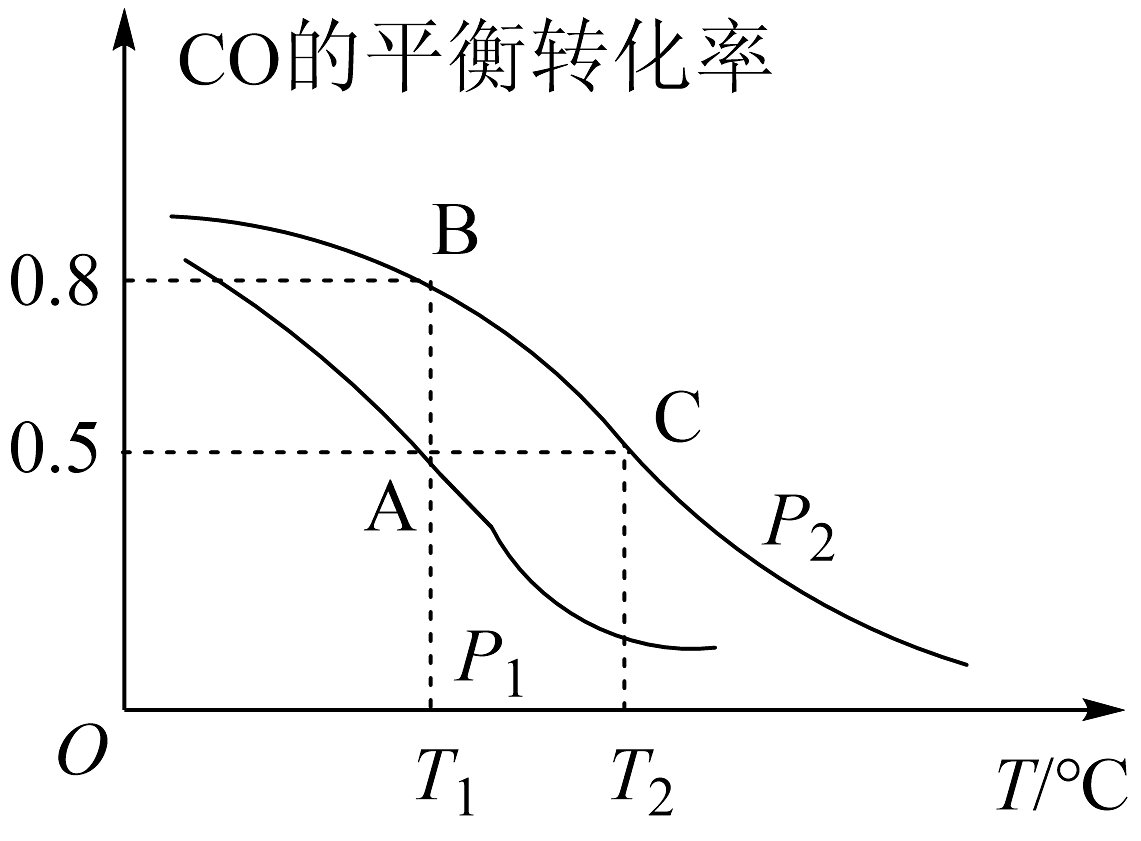
①p1、p2的大小关系是p1p2(填“>”“<"或"=”)。
②A、B、C三点的平衡常数KA、KB、Kc的大小关系是。
③下列叙述能说明上述反应能达到化学平衡状态的是(填字母)。
a.2v正(H2)=v逆(CH3OH)
b.CH3OH的体积分数不再改变
c.混合气体的平均摩尔质量不再改变
d.同一时间内,消耗0.04molH2 , 生成0.02molCO
(2)、在T2℃、p2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。①平衡时H2的体积分数是;平衡后再加入1.0molCO后重新到达平衡,则CO的转化率(填“增大""不变”成“减小”),CO与CH3OH的浓度比(填"增大”“不变"或“减小")。
②若以不同比例投料,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)v(逆)(填“”“<"或“=”)。
③若p2压强恒定为p,则平衡常数Kp=(Kp用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
-
17、甲醇是一种重要的化工原料,具有广阔的开发和应用前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇(CH3OH)。(1)、已知一定条件下,发生反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH1= -41.2 kJ/mol,CH3OH(g)+H2O(g)CO2(g)+3H2(g) ΔH2= +49.5 kJ/mol,该条件下,水煤气转化成甲醇的热化学方程式是 。
在体积可变的恒压密闭容器中投入0.5 mol CO和0.75 mol H2 , 不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量(n)随温度(T)、压强(p)的变化如图1所示。
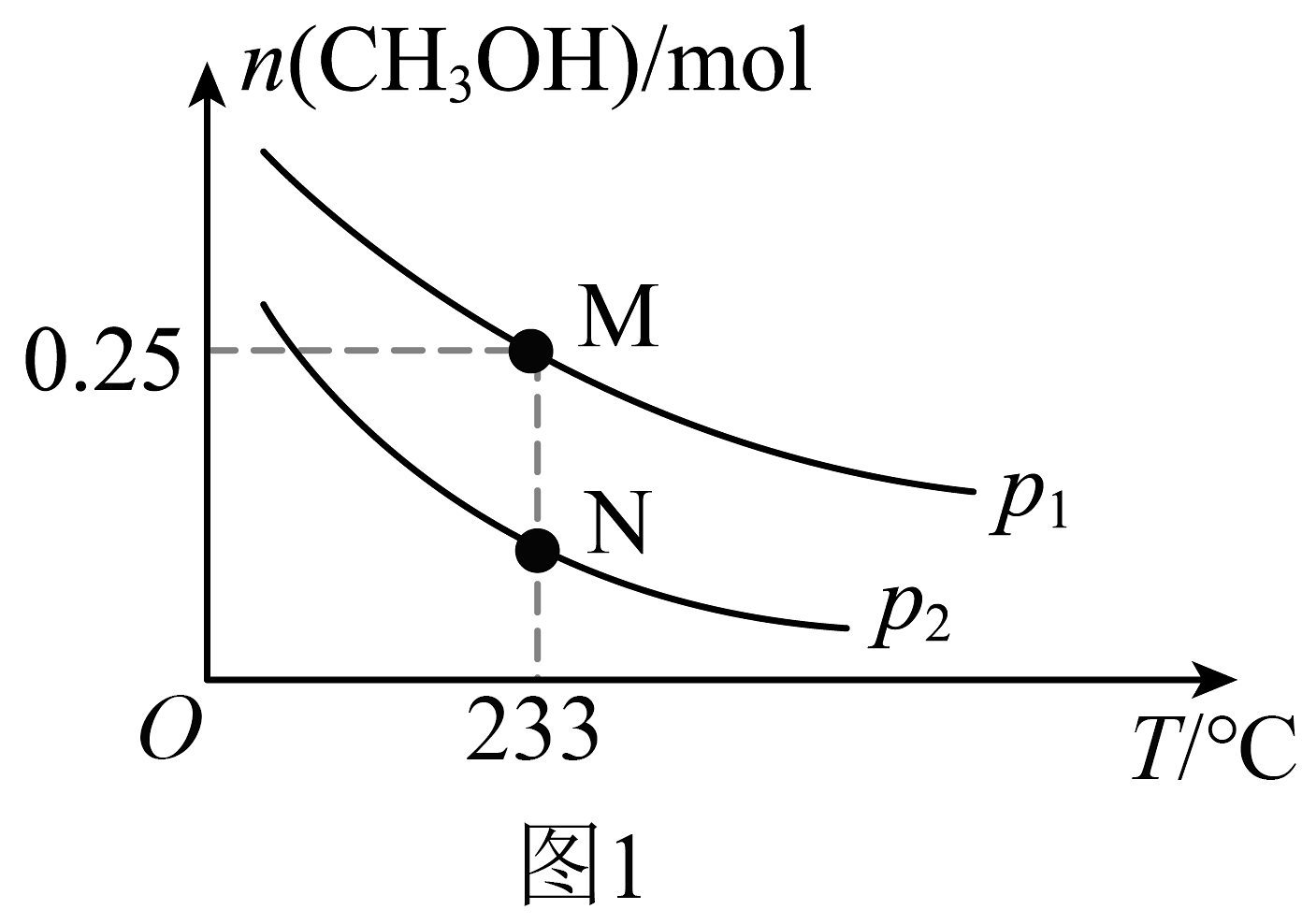 (2)、M点对应的平衡混合气体的体积为1 L,则233℃时,求反应的平衡常数K。(写出计算过程)(3)、工业上可利用甲醇茾基化法进一步制取甲酸甲酯:CH3OH(g)+CO (g)⇌HCOOCH3(g)。在容积不变的密闭容器中,投入等物质的量的CH3OH(g)和CO (g),在相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
(2)、M点对应的平衡混合气体的体积为1 L,则233℃时,求反应的平衡常数K。(写出计算过程)(3)、工业上可利用甲醇茾基化法进一步制取甲酸甲酯:CH3OH(g)+CO (g)⇌HCOOCH3(g)。在容积不变的密闭容器中,投入等物质的量的CH3OH(g)和CO (g),在相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。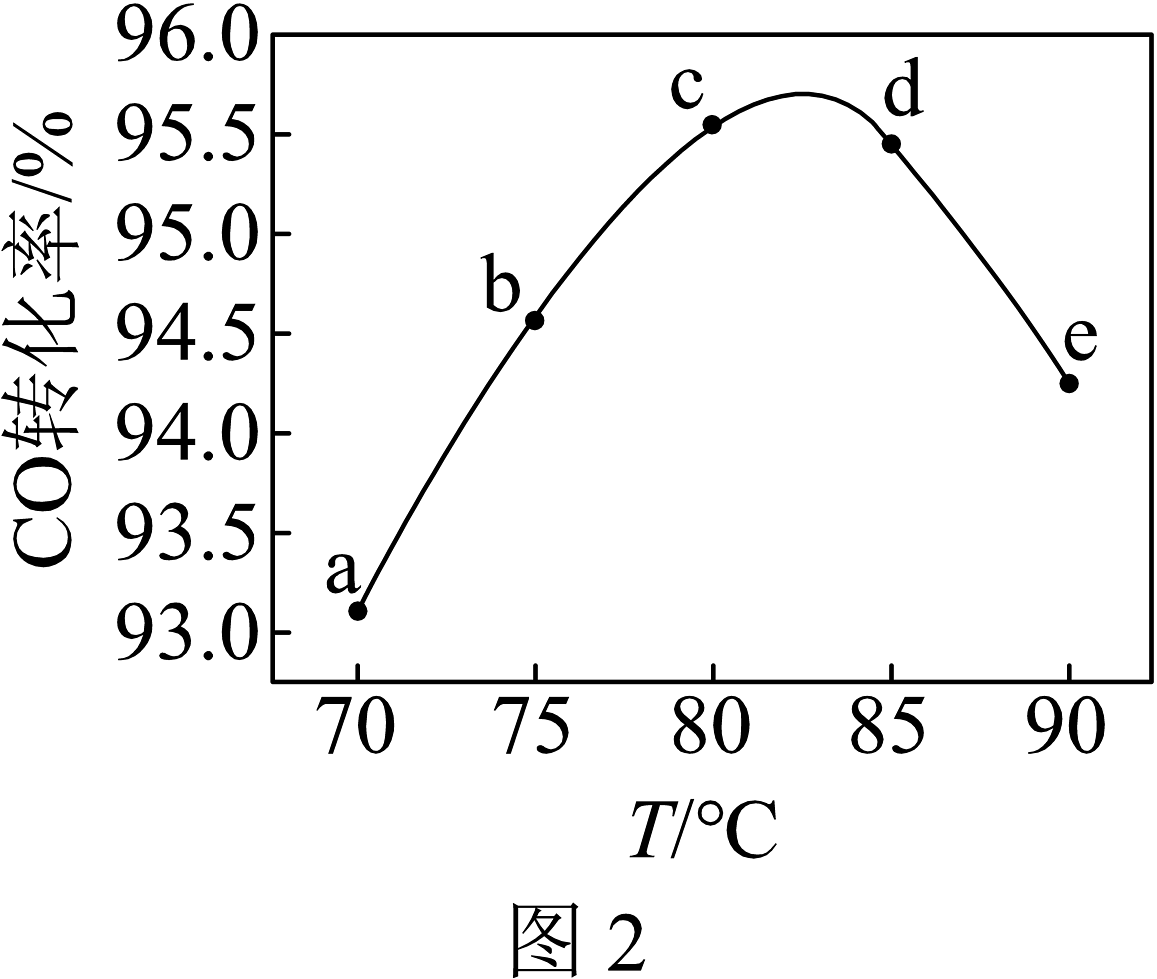
①b、c、d三点中,尚未达到化学平衡状态的点是。
②该反应是 (填“放热”或“吸热”)反应。
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由。
-
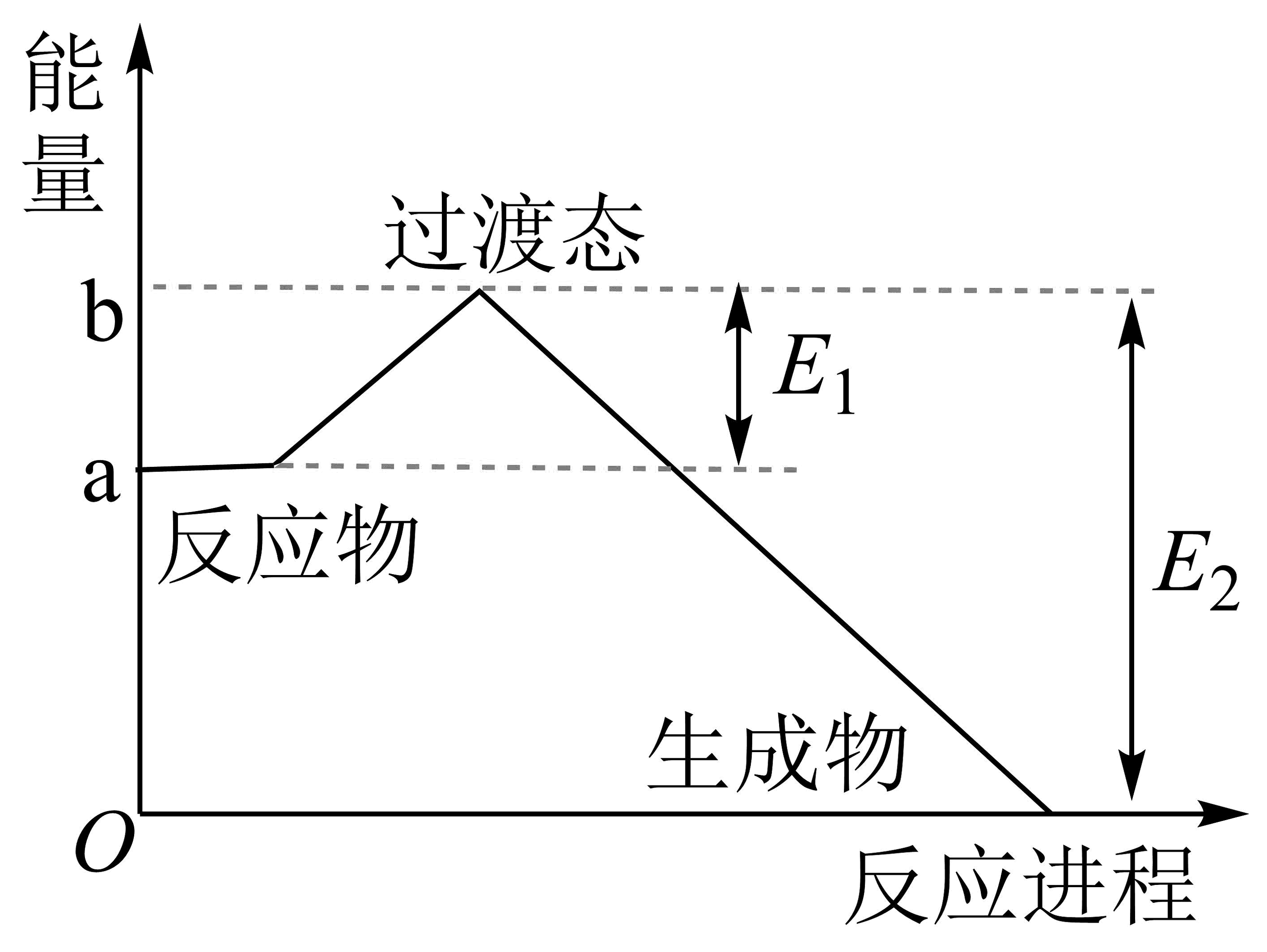
18、完成下列问题(1)、20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态,下图为是NO2和CO反应生成CO2和NO过程中能量变化示意图。在反应体系中加入正催化剂,E1和E2的变化是:E1 , E2(填“增大”、“减小”或“不变”),对反应热是否有影响?。
 (2)、中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(2)、中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题: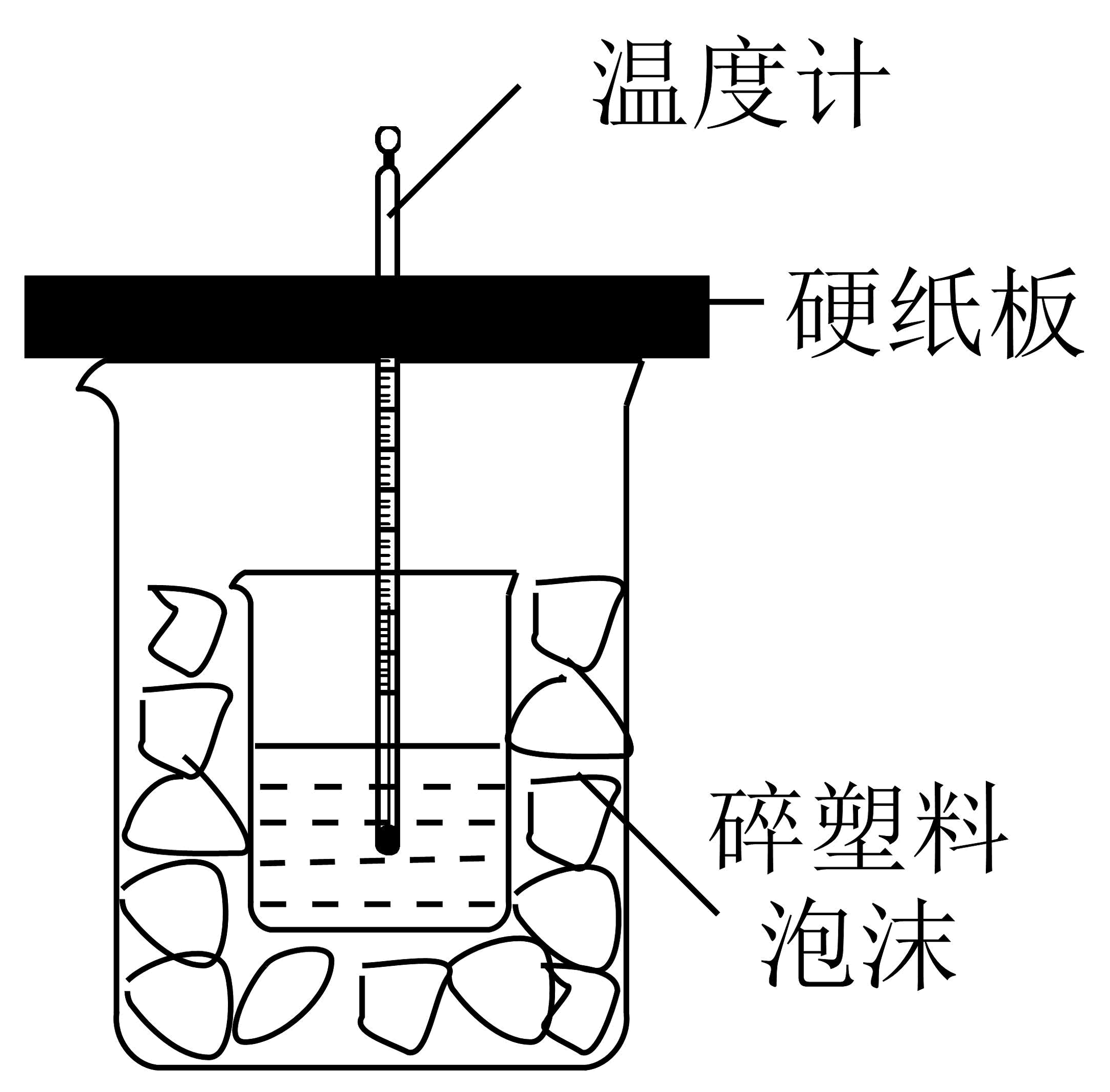
①从实验装置看,烧杯间填满碎塑料泡沫的作用是。
②大烧杯上如不盖硬纸板,则求得的中和热数值(填“偏大”、“偏小”、“无影响”)
③实验中改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热的数值(填“相等”或“不相等”)。
-
19、某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
实验编号
实验温度/℃
试管中所加试剂及其用量/mL
0.6 mol/LH2C2O4溶液
H2O
3 mol/L稀H2SO4溶液
0.05 mol/L KMnO4溶液
①
25
3.0
V1
2.0
3.0
②
25
2.0
3.0
2.0
3.0
③
30
2.0
V_2
2.0
3.0
(1)、该实验的原理是(用化学方程式表示):2KMnO4+5 H2C2O4+3 H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。该实验还需要测量的数据是。(2)、V1= , V2=。(3)、探究温度对化学反应速率的影响,应选择实验(填实验编号)。(4)、若实验①用时1.5 min则第一组实验的化学反应速率(用草酸表示)为。(5)、某同学绘制了瞬时速率和时间的图像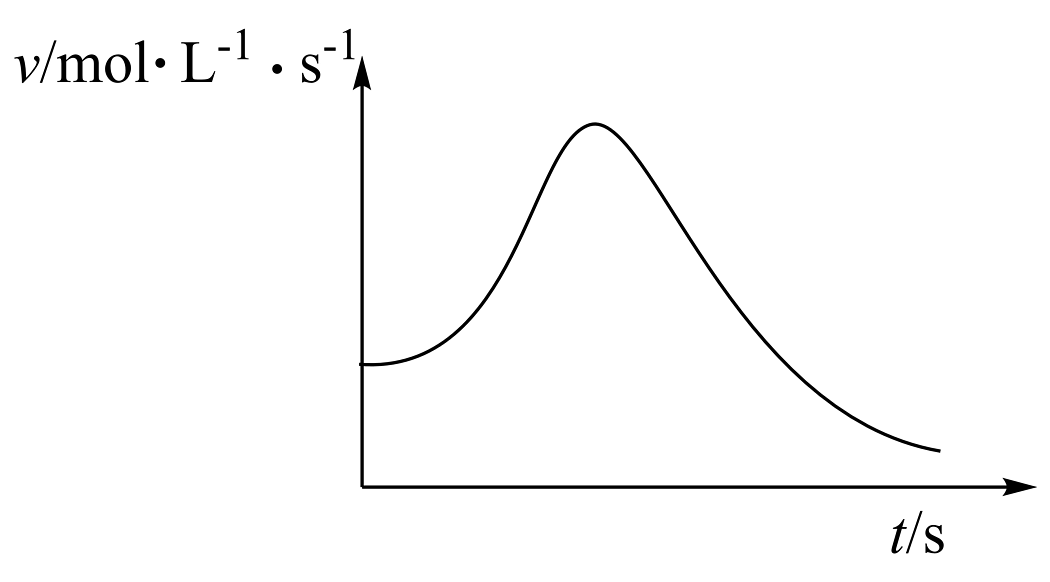
①该同学提出猜想
猜想a:温度上升导致速率快速上升
猜想b:反应产生了催化剂
该同学发现该反应前后体系温度上升了0.5℃,因此不成立(猜想a或猜想b)。
②该同学推测可能的催化剂是(填物质化学式)。
③验证猜想的方法是。
-
20、恒容密闭容器中,反应在不同温度下达到平衡时,各组分的物质的量如图所示。下列说法错误的是
 A、该反应的 B、为随温度的变化曲线 C、向平衡体系中充入惰性气体,平衡不移动 D、向平衡体系中加入的平衡转化率减小
A、该反应的 B、为随温度的变化曲线 C、向平衡体系中充入惰性气体,平衡不移动 D、向平衡体系中加入的平衡转化率减小