相关试卷
-
1、自然资源部于2025年1月19日宣布在甘肃安坝里北矿区发现超大规模金矿,这将增加我国黄金资源战略储备量,降低对外部黄金资源的依赖,为芯片制造、航空航天等高端制造业提供关键原材料支持。关于金元素及其化合物的性质,下列说法正确的是A、刘禹锡“千淘万漉虽辛苦,吹尽狂沙始到金。”这句诗描述了收集自然界单质金的传统方法——淘金法,原理是利用了金砂与河沙的化学性质不同 B、氰化法是从含金矿石中炼金的常用方法: , , 则理论上每提炼出 , 转移电子数为 C、根据氰化法的反应原理可知,氧化性: D、和可直接接触反应生成铯汞齐(一种合金),与在特定条件下能够反应生成金化铯(一种盐),据此可以推断出电负性:
-
2、小明是一位高一新生,有一天他看见饮用水中有些许水垢(含、等) , 于是他想起刚刚学过的“氯及其化合物”一章,新制氯水中含有、等微粒 , 可与水垢反应使其消失,并且可用于饮用水的杀菌消毒。于是他通过类比认为有效成分为的“84”消毒液同样可以,便取出厕所中的“84”消毒液,欲加入饮用水中。母亲一把夺过,并告诫他:“氯水中有大量有毒的 , 所以也有毒 , 不可用于饮用水的杀菌消毒,但是可用于物品清洁。”上述划线的说法中,错误的有A、2个 B、3个 C、4个 D、5个
-
3、短周期元素、、、的相对原子质量依次递增,其形成的一种化合物结构如图所示。下列说法正确的是
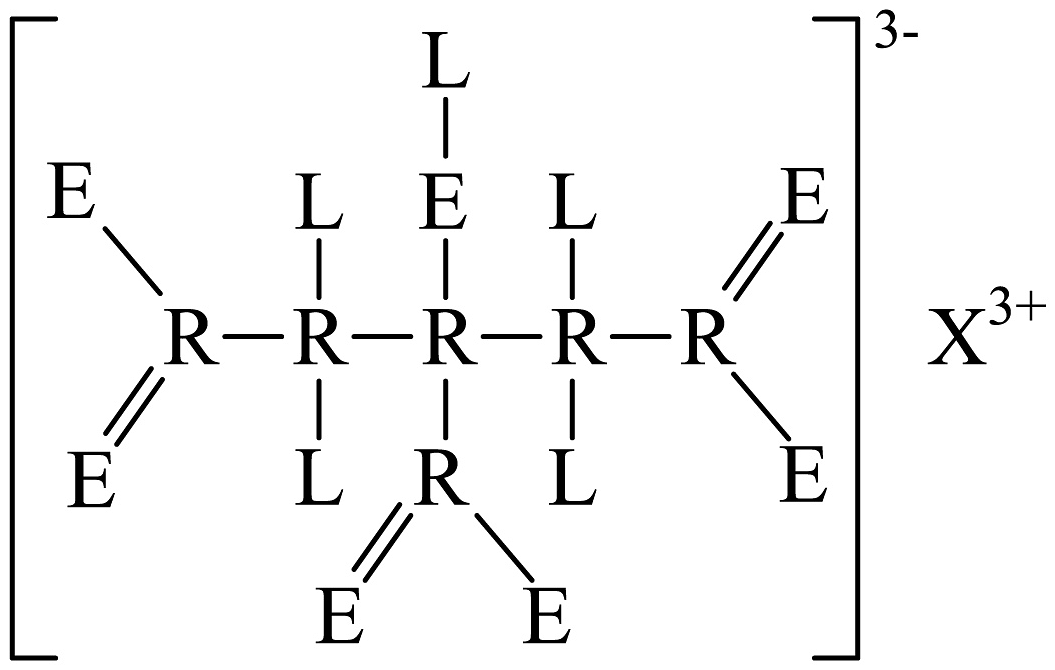 A、R、L、E可以组成最简单的蛋白质 B、形成的某种化合物可用于治疗胃酸过多 C、和是同族元素 D、分子是非极性分子
A、R、L、E可以组成最简单的蛋白质 B、形成的某种化合物可用于治疗胃酸过多 C、和是同族元素 D、分子是非极性分子 -
4、年关将至,Flawless成员准备对房间进行大扫除,下列说法正确的是A、准备清理厕所时,可以将84消毒液和洁厕灵混合使用来提高效率 B、清理厨房油污时,可以使用热的碳酸钠溶液 C、整理书柜时发现,一些书籍发生了变黄的现象,这是由于阳光照射引发的还原反应 D、在一些地方有贴灶王爷的习俗,可以使用加热的面糊进行粘贴,该过程中没有发生化学反应
-
5、以下化学用语不正确的是A、的俗名是氯仿 B、葡萄糖的实验式: C、基态原子的价电子排布式: D、的电子式为
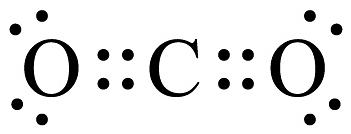
-
6、对以下物质性质的描述正确的是A、晶体是离子晶体 B、分子是非极性分子 C、中阴阳离子数目比为 D、的空间结构为形
-
7、下列有关物质结构和性质的说法,正确的是A、与的中心原子杂化轨道类型均为杂化 B、和都是单质,在中溶解度几乎一样 C、可燃冰()中甲烷分子与水分子之间并没有氢键 D、分子晶体都存在分子间作用力和共价键
-
8、一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述不正确的是
 A、该化合物中W、X、Y之间均为共价键 B、X的原子核外电子排布式为1s22s22p2 C、Y的最高化合价氧化物的水化物为强酸 D、Z的单质既能与水反应,也可与甲醇反应
A、该化合物中W、X、Y之间均为共价键 B、X的原子核外电子排布式为1s22s22p2 C、Y的最高化合价氧化物的水化物为强酸 D、Z的单质既能与水反应,也可与甲醇反应 -
9、某研究小组按以下路线对内酰胺F的合成进行了探索:

回答下列问题:
(1)、从实验安全角度考虑,A→B中应连有吸收装置,吸收剂为。(2)、C的名称为 , 它在酸溶液中用甲醇处理,可得到制备(填标号)的原料。a.涤纶 b.尼龙 c.维纶 d.有机玻璃
(3)、下列反应中不属于加成反应的有(填标号)。a.A→B b.B→C c.E→F
(4)、写出C→D的化学方程式。(5)、已知 (亚胺)。然而,E在室温下主要生成G
(亚胺)。然而,E在室温下主要生成G , 原因是。 (6)、已知亚胺易被还原。D→E中,催化加氢需在酸性条件下进行的原因是 , 若催化加氢时,不加入酸,则生成分子式为的化合物H,其结构简式为。
, 原因是。 (6)、已知亚胺易被还原。D→E中,催化加氢需在酸性条件下进行的原因是 , 若催化加氢时,不加入酸,则生成分子式为的化合物H,其结构简式为。 -
10、
学习小组为探究、能否催化的分解及相关性质,室温下进行了实验I~Ⅳ。
实验I
实验Ⅱ
实验Ⅲ



无明显变化
溶液变为红色,伴有气泡产生
溶液变为墨绿色,并持续产生能使带火星木条复燃的气体
已知:为粉红色、为蓝色、为红色、为墨绿色。回答下列问题:
(1)配制的溶液,需要用到下列仪器中的(填标号)。
a.
 b.
b.  c.
c.  d.
d.
(2)实验I表明(填“能”或“不能”)催化的分解。实验Ⅱ中大大过量的原因是。实验Ⅲ初步表明能催化的分解,写出在实验Ⅲ中所发生反应的离子方程式、。
(3)实验I表明,反应难以正向进行,利用化学平衡移动原理,分析、分别与配位后,正向反应能够进行的原因。
实验Ⅳ:

(4)实验Ⅳ中,A到B溶液变为蓝色,并产生气体;B到C溶液变为粉红色,并产生气体。从A到C所产生的气体的分子式分别为、。
-
11、用和焦炭为原料,经反应I、Ⅱ得到 , 再制备乙炔是我国科研人员提出的绿色环保新路线。
反应I:
反应Ⅱ:
回答下列问题:
(1)、写出与水反应的化学方程式。(2)、已知、(n是的化学计量系数)。反应Ⅰ、Ⅱ的与温度的关系曲线见图1。
①反应在的。
②保持不变,假定恒容容器中只发生反应I,达到平衡时 , 若将容器体积压缩到原来的 , 重新建立平衡后。
(3)、恒压容器中,焦炭与的物质的量之比为 , 为载气。和下,产率随时间的关系曲线依实验数据拟合得到图2(不考虑接触面积的影响)。
①初始温度为 , 缓慢加热至时,实验表明已全部消耗,此时反应体系中含物种为。
②下,反应速率的变化特点为 , 其原因是。
-
12、科学家合成了一种如图所示的纳米“分子客车”,能装载多种稠环芳香烃。三种芳烃与“分子客车”的结合常数(值越大越稳定)见表。下列说法错误的是

芳烃
芘
并四苯
蒄
结构



结合常数
385
3764
176000
A、芳烃与“分子客车”可通过分子间相互作用形成超分子 B、并四苯直立装载与平躺装载的稳定性基本相同 C、从分子大小适配看“分子客车”可装载2个芘 D、芳烃π电子数越多越有利于和“分子客车”的结合 -
13、我国科学家设计了一种双位点电催化剂,用和电化学催化合成甘氨酸,原理如图,双极膜中解离的和在电场作用下向两极迁移。已知在溶液中,甲醛转化为 , 存在平衡。电极上发生的电子转移反应为。下列说法错误的是
 A、电解一段时间后阳极区减小 B、理论上生成双极膜中有解离 C、阳极总反应式为 D、阴极区存在反应
A、电解一段时间后阳极区减小 B、理论上生成双极膜中有解离 C、阳极总反应式为 D、阴极区存在反应 -
14、气氛下,溶液中含铅物种的分布如图。纵坐标()为组分中铅占总铅的质量分数。已知 , 、 , 。下列说法错误的是
 A、时,溶液中 B、时, C、时, D、时,溶液中加入少量 , 会溶解
A、时,溶液中 B、时, C、时, D、时,溶液中加入少量 , 会溶解 -
15、鹰爪甲素(如图)可从治疗疟疾的有效药物鹰爪根中分离得到。下列说法错误的是
 A、有5个手性碳 B、在条件下干燥样品 C、同分异构体的结构中不可能含有苯环 D、红外光谱中出现了以上的吸收峰
A、有5个手性碳 B、在条件下干燥样品 C、同分异构体的结构中不可能含有苯环 D、红外光谱中出现了以上的吸收峰 -
16、化学用语可以表达化学过程,下列化学用语表达错误的是A、用电子式表示的形成:
 B、亚铜氨溶液除去合成氨原料气中的:
C、用电子云轮廓图示意键的形成:
B、亚铜氨溶液除去合成氨原料气中的:
C、用电子云轮廓图示意键的形成: D、制备芳纶纤维凯芙拉:
D、制备芳纶纤维凯芙拉:

-
17、关于物质的分离、提纯,下列说法错误的是A、蒸馏法分离和 B、过滤法分离苯酚和溶液 C、萃取和柱色谱法从青蒿中提取分离青蒿素 D、重结晶法提纯含有少量食盐和泥沙的苯甲酸
-
18、2024年5月8日,我国第三艘航空母舰福建舰顺利完成首次海试。舰体表面需要采取有效的防锈措施,下列防锈措施中不形成表面钝化膜的是A、发蓝处理 B、阳极氧化 C、表面渗镀 D、喷涂油漆
-
19、水煤气是的主要来源,研究对体系制的影响,涉及主要反应如下:
回答下列问题:
(1)、的焓变(用代数式表示)。(2)、压力p下,体系达平衡后,图示温度范围内已完全反应,在温度时完全分解。气相中 , 和摩尔分数随温度的变化关系如图所示,则a线对应物质为(填化学式)。当温度高于时,随温度升高c线对应物质摩尔分数逐渐降低的原因是。 (3)、压力p下、温度为时,图示三种气体的摩尔分数分别为0.50,0.15,0.05,则反应的平衡常数;此时气体总物质的量为 , 则的物质的量为;若向平衡体系中通入少量 , 重新达平衡后,分压将(填“增大”“减小”或“不变”),将(填“增大”“减小”或“不变”)。
(3)、压力p下、温度为时,图示三种气体的摩尔分数分别为0.50,0.15,0.05,则反应的平衡常数;此时气体总物质的量为 , 则的物质的量为;若向平衡体系中通入少量 , 重新达平衡后,分压将(填“增大”“减小”或“不变”),将(填“增大”“减小”或“不变”)。 -
20、心血管药物缬沙坦中间体(F)的两条合成路线如下:

已知:
I.

Ⅱ.
回答下列问题:
(1)、A结构简式为;B→C反应类型为。(2)、C+D→F化学方程式为。(3)、E中含氧官能团名称为;F中手性碳原子有个。(4)、D的一种同分异构体含硝基和3种不同化学环境的氢原子(个数比为),其结构简式为。(5)、C→E的合成路线设计如下:试剂X为(填化学式);试剂Y不能选用 , 原因是。