相关试卷
- 广东省惠州市2016-2017学年高一上学期化学期末考试试卷
- 山东省淄博七中2016-2017学年高一上学期化学期中考试试卷
- 河南省焦作市2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博市淄川一中2016-2017学年高一上学期化学期中考试试卷
- 山东省德州市陵城一中2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博六中2016-2017学年高二上学期化学期中考试试卷
- 山东省临沂市蒙阴一中2016-2017学年高二上学期化学期中考试试卷
- 2016-2017学年山东省烟台市高一下学期期中化学试卷
- 2016-2017学年山东省德州市夏津一中高一下学期期中化学试卷
- 2016-2017学年山东省德州市武城二中高一下学期期中化学试卷(普通班)
-
1、关于溴的性质,下列说法不正确的是A、可被氧化为 B、与水溶液反应的还原产物为 C、 , 说明氧化性: D、与足量溶液反应生成和 , 转移电子
-
2、关于实验室安全,下列说法不正确的是A、若不慎盐酸沾到皮肤上,应立即用大量水冲洗,然后用溶液冲洗 B、实验室制备时,可用溶液吸收尾气 C、水银易挥发,若不慎有水银洒落,无需处理 D、难溶于水,可用处理废水中的 , 再将沉淀物集中送至环保单位进一步处理
-
3、根据元素周期律,下列说法不正确的是A、第一电离能:N>O>S B、化合物中键的极性:SiCl4>PCl3 C、碱性:LiOH>KOH D、化合物中离子键百分数:MgO>Al2O3
-
4、化学与生产生活密切相关,下列说法不正确的是A、具有强氧化性,可用于杀菌消毒 B、聚丙烯是高分子材料,可用作吸水剂 C、溶液呈碱性,可用于除油污 D、硬铝密度小、强度高,抗腐蚀能力强,可用作飞机材料
-
5、下列化学用语表示不正确的是A、基态S原子的电子排布式: B、质量数为14的碳原子: C、乙烯的结构简式: D、的电子式:

-
6、下列属于极性分子的是A、 B、 C、 D、
-
7、常温下,Ba(OH)2和NaOH的混合溶液中c(OH-)=1.0 mol/L,取该溶液100 mL,持续通入CO2 , 当通入的CO2体积为0.56 L时生成沉淀最多,试通过计算回答:(气体体积均在标准状态下测得,设溶液体积在反应过程中不发生变化)(1)、混合溶液中Ba(OH)2物质的量是mol,NaOH物质的量浓度是mol/L。(2)、当溶液中Na+与Ba2+的物质的量之比为10:1时,通入的CO2总体积可能是L。
-
8、回答有关氯气制备的几个问题
实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和制取少量漂白粉。现已知反应温度稍高即发生副反应:。现有两个同学分别设计的两套实验装置如下图:
 (1)、写出实验室制取氯气的离子方程式。(2)、上述装置中由A、B、C、D、E部分组成,请从上述A、B、C、D、E装置中选取合理的部分,重新组装一套较完整的实验装置,装置各部分连接顺序是(按气流流动的方向)。该实验发现得到的含量偏低,推测该组合中还缺少的装置是。(3)、漂白粉长时间暴露在空气中容易发生变质,为了判断一份久置的漂白粉是否变质及变质程度,甲同学设计实验进行验证:取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊,证明漂白粉没有变质。
(1)、写出实验室制取氯气的离子方程式。(2)、上述装置中由A、B、C、D、E部分组成,请从上述A、B、C、D、E装置中选取合理的部分,重新组装一套较完整的实验装置,装置各部分连接顺序是(按气流流动的方向)。该实验发现得到的含量偏低,推测该组合中还缺少的装置是。(3)、漂白粉长时间暴露在空气中容易发生变质,为了判断一份久置的漂白粉是否变质及变质程度,甲同学设计实验进行验证:取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊,证明漂白粉没有变质。①漂白粉中的能与空气中的和水蒸气反应,写出该反应的化学方程式。
②你认为甲同学的实验能否证明漂白粉没有变质?请说明你的判断理由:。
-
9、某次实验中预计需要使用的纯碱溶液,下面是某同学在实验室配制该溶液的流程图,回答下列问题:
 (1)、流程图中的配制过程少了一步,请指出缺少的步骤是。(2)、实验所需要的仪器除了烧杯,玻璃棒,托盘天平,还需要 , 。根据图示的相关数据,可以求得a=。使用容量瓶前对容量瓶必须进行的一项操作是。(3)、所给出的流程图中体现出的操作内容有明显错误,请写出两个:①;②。(4)、下列实验操作对所配制溶液浓度的影响,其中所配溶液浓度偏大的是___________。A、溶解后,没有洗涤玻璃棒以及烧杯 B、定容时俯视容量瓶上的刻度线 C、溶液未冷却至室温就转移到容量瓶中 D、定容后将容量瓶振荡摇匀,静置后发现液面低于刻度线,于是又加入少量水
(1)、流程图中的配制过程少了一步,请指出缺少的步骤是。(2)、实验所需要的仪器除了烧杯,玻璃棒,托盘天平,还需要 , 。根据图示的相关数据,可以求得a=。使用容量瓶前对容量瓶必须进行的一项操作是。(3)、所给出的流程图中体现出的操作内容有明显错误,请写出两个:①;②。(4)、下列实验操作对所配制溶液浓度的影响,其中所配溶液浓度偏大的是___________。A、溶解后,没有洗涤玻璃棒以及烧杯 B、定容时俯视容量瓶上的刻度线 C、溶液未冷却至室温就转移到容量瓶中 D、定容后将容量瓶振荡摇匀,静置后发现液面低于刻度线,于是又加入少量水 -
10、按要求书写离子方程式或化学方程式(1)、与水反应的化学方程式:。(2)、制备漂白液的离子方程式:。(3)、Fe与高温反应化学方程式。(4)、溶液和(硫酸酸化)的离子方程式:。(5)、配平化学方程式,并用单线桥法标明电子转移的方向和数目。(配平和单线桥)
_________________________________=_________________________________。
-
11、下列物质中:
①酒精 ②氨气 ③硫酸钡 ④氢氧化钠 ⑤二氧化碳 ⑥饱和食盐水 ⑦熔融氯化镁 ⑧醋酸 ⑨氨水
(1)、属于电解质的是 , 属于非电解质的是。(2)、书写熔融电离方程式:。(3)、水溶液中滴加至中性,离子方程式。 -
12、下列实验中,对应的现象以及解释或结论都正确且两者具有因果关系的是
选项
实验操作
现象
解释或结论
A
某溶液中加入氯水振荡后再滴加KSCN溶液
溶液呈红色
原溶液中含有
B
某固体中加入足量盐酸酸化,然后加入溶液
有白色沉淀出现
原固体中含有
C
将某固体溶于水,溶液中滴加NaOH溶液,用湿润的红色石蕊试纸检验
试纸没有变蓝
此固体物质仍然可能含
D
取Fe与水蒸气反应后的产物溶于足量的稀硫酸中,取其溶液滴加酸性溶液,振荡
溶液褪色
则产物中不含有+3价Fe
A、A B、B C、C D、D -
13、某100mL无色溶液可能含有、、、、、中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是
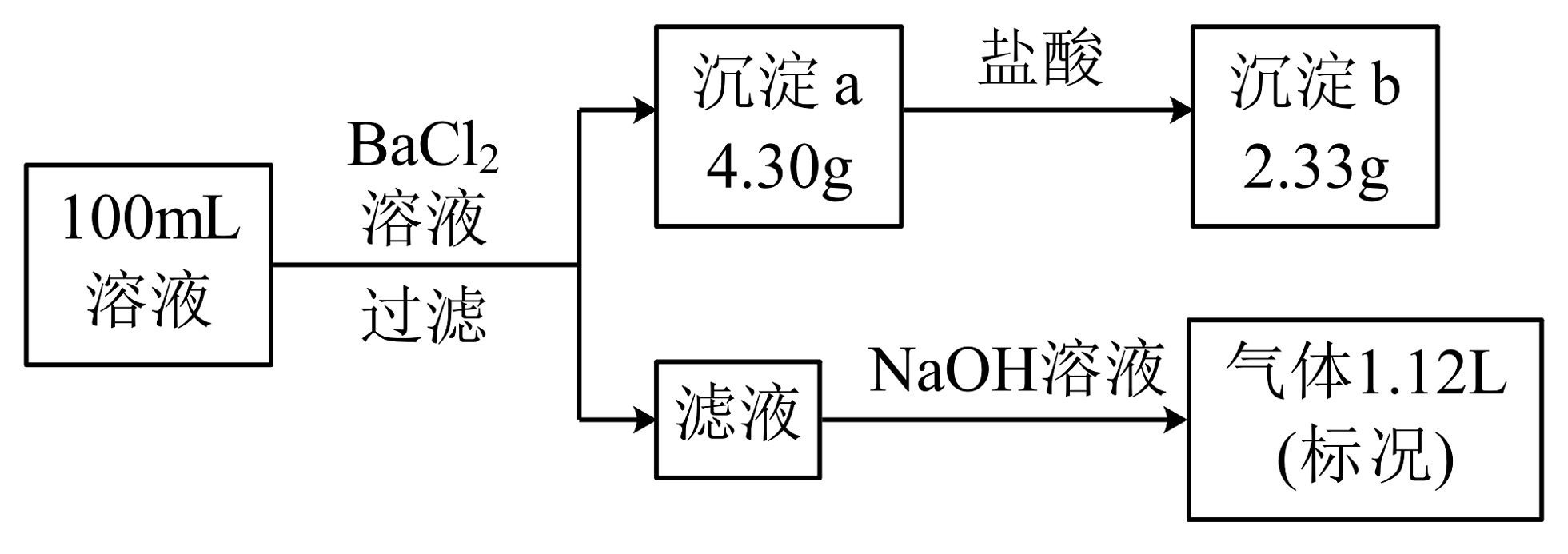 A、原溶液一定存在和 , 一定不存在 B、原溶液一定存在 , 可能存在 C、原溶液中 D、若原溶液中不存在 , 则
A、原溶液一定存在和 , 一定不存在 B、原溶液一定存在 , 可能存在 C、原溶液中 D、若原溶液中不存在 , 则 -
14、工业上用电解饱和食盐水的方法制取 , 同时得到和。电解之前食盐水需要精制,目的是除去粗盐中的、、等杂质离子,工业流程如下:

精制过程中的试剂a.溶液,b.溶液,c.稀盐酸
下列说法不正确的是( )
A、精制过程,试剂的合理加入顺序为b、a、c B、操作1是过滤,固体的主要成分是、、和少量的泥砂 C、电解过程发生了氧化还原反应 D、和在两个不同的电极上产生 -
15、在含有0.078mol的溶液中通入0.009mol , 再加入含有0.01mol的溶液后,恰好完全转化为 , 则反应后X元素的化合价为( )A、 B、0 C、 D、不能确定
-
16、下列叙述正确的是
①与都能和水反应生成碱,它们都是碱性氧化物
②的漂白原理与活性炭的漂白原理相同
③钠在常温下不容易被氧化
④可作供氧剂,而不行
⑤石蕊试液中加入粉末,先变蓝后褪色,并有气泡生成
⑥钠与浓溶液反应,放出的气体中含和
A、都正确 B、②③④⑤ C、②⑤⑥ D、④⑤⑥ -
17、CO和CO2的混合气体18g,完全燃烧后测得CO2体积为11.2L(标准状况),下列说法不正确的是( )A、混合气体中CO的质量是7g B、混合气体中CO2在非标准状况下的体积也可能是5.6L C、混合气体中CO的体积分数是50% D、混合气体的平均摩尔质量是36
-
18、下列有关新制氯水的说法不正确的是A、新制氯水呈黄绿色,是因为氯水中含有 B、新制氯水滴到溶液中,有气泡产生,说明氯水中呈酸性 C、新制氯水滴到硝酸银溶液中,能产生白色沉淀 D、新制氯水光照一段时间,酸性会减弱
-
19、下列关于钠的实验现象的叙述不正确的是
选项
实验操作
实验现象
A
切开一小块钠,观察切面颜色的变化
钠切面颜色变暗,最后呈淡黄色
B
把一小块钠投入溶液中
钠熔化成闪亮的小球,在液面上四处游动,发出“嘶嘶”的响声,产生蓝色沉淀
C
把一小块钠投入滴有紫色石蕊溶液的冷水中
钠熔化成闪亮的小球,在液面上四处游动,发出“嘶嘶”的响声,反应后溶液变蓝
D
把一小块钠迅速投入热坩埚中,继续加热坩埚片刻
钠熔成小球,然后剧烈燃烧,发出黄色火焰,生成淡黄色固体
A、A B、B C、C D、D -
20、下列离子方程式不正确的是A、氢氧化钠溶液与二氧化硅反应 SiO2 + 2OH-=SiO32- + H2O B、碳酸钠溶液与氢氧化钡溶液反应 CO32-+ Ba(OH)2=BaCO3↓+2OH- C、酸性硫酸亚铁溶液在空气中被氧化 4Fe2++O2+4H+=4Fe3++2H2O D、氯气与氢氧化钠溶液反应 Cl2+ 2OH-=ClO- +Cl-+H2O