相关试卷
- 广东省惠州市2016-2017学年高一上学期化学期末考试试卷
- 山东省淄博七中2016-2017学年高一上学期化学期中考试试卷
- 河南省焦作市2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博市淄川一中2016-2017学年高一上学期化学期中考试试卷
- 山东省德州市陵城一中2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博六中2016-2017学年高二上学期化学期中考试试卷
- 山东省临沂市蒙阴一中2016-2017学年高二上学期化学期中考试试卷
- 2016-2017学年山东省烟台市高一下学期期中化学试卷
- 2016-2017学年山东省德州市夏津一中高一下学期期中化学试卷
- 2016-2017学年山东省德州市武城二中高一下学期期中化学试卷(普通班)
-
1、下列化学用语或表述正确的是A、基态氧原子的轨道表示式:
 B、甲醛分子的空间填充模型:
B、甲醛分子的空间填充模型:  C、用电子式表示 HCl的形成过程:
C、用电子式表示 HCl的形成过程: D、钢铁发生吸氧腐蚀时的负极反应式:O2 + 2H2O + 4e-= 4OH-
D、钢铁发生吸氧腐蚀时的负极反应式:O2 + 2H2O + 4e-= 4OH-
-
2、以下各组物质在发生相应变化时所克服的微粒间作用力完全相同的是A、蔗糖溶于水和HCl气体溶于水 B、金刚石熔化和金属铁熔化 C、AlCl3升华和液溴挥发 D、食盐粉碎和冰粉碎
-
3、以下化学与生活、科技相关的说法错误的是A、春节夜空绽放的璀璨烟火与原子核外电子发生跃迁释放能量有关 B、北京冬奥会上运动员“战袍”内层添加石墨烯片用于保暖,石墨烯是一种单质 C、三星堆“祭祀坑”出土的竖披发青铜人中含有金属铜,铜单质为一种晶体 D、深藏于我国南海海底的天然气水合物是一种有机高分子化合物
-
4、
CO2的资源化利用具有重要的意义。
合成尿素[CO(NH2)2]是利用CO2的途径之一。尿素合成主要通过下列反应实现:
反应Ⅰ:2NH3(g)+CO2(g)=NH2COONH4(s) △H1=-272kJ/mol
反应Ⅱ:NH2COONH4(s)=CO(NH2)2(1)+H2O(g)△H2=+138kJ/mol
(1)二氧化碳和氨气合成尿素固体和水蒸气的反应自发进行的条件是(填“低温”、“高温”或“任意条件”)。
(2)MgO是CO2和环氧乙烷合成碳酸乙烯酯的催化剂)可由MgCl2与沉淀剂(尿素或氢氧化钠)反应,先生成沉淀,过滤后将沉淀焙烧得到。已知向MgCl2溶液中加入尿素生成Mg5(CO3)4(OH)沉淀,与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO其催化剂效果更好,其原因是。
二氧化碳加氢制甲醇已经成为研究热点。合成甲醇主要发生的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-49kJ/mol
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41kJ/mol
在密闭容器中,1.01×105Pa、n起始(CO2):n起始(H2)=1:3,其他条件相同时,反应温度对CO2的转化率和n(CH3OH)的选择性的影响分别如图1和图2所示。其中,CH3OH的选择性可表示为×100%

(3)图1,温度高于260℃时,CO2的平衡转化率呈上升变化的原因是。
(4)图2,温度相同时CH3OH选择性的实验值略高干其平衡值,从化学反应银率的角度解释其原因是。
K2FeO4氧化法脱除H2S的装置如图3所示。其他条件一定,溶液中c()与电流密度(电流密度与电压成正比)的关系如图4所示。(已知:K2FeO4具有强氧化性,在酸性或中性溶液中不稳定、强碱性溶液中较稳定。)

(5)写出电解时阳极的电极反应式:。
(6)电流密度大于4mA·cm-2时,溶液中c()上升幅度变小的原因是。
(7)控制电流密度为4mA·cm-2 , 分别以不同浓度的KOH溶液为电解质,电解相同时间后通入H2S充分反应,测得H2S的氧化率与KOH溶液浓度的关系下图所示。c(KOH)=8mol·L-1时H2S的氧化率达到最大的原因是。

-
5、
工业合成氨和氨催化氧化制取硝酸是人类科技的一项重大突破。
(1)请写出如图所示的的N2和H2反应生成液态NH3的热化学方程式:。

(2)已知N2(g)+3H2(g)2NH3(g) △H<0。
①在恒温恒容密闭容器中充入2molN2和6molH2进行合成氨反应,下列能说明该反应已达平衡状态的是。
a.断裂6molH—H同时生成6molN—H
b.容器内压强保持不变
c.混合气体密度保持不变
d.容器内N2、H2、NH3物质的量之比为1:3:2
e.NH3的百分含量保持不变
②已知传统合成氨反应的速率方程为,v=kcα(N2)cΒ(H2)c-1(NH3),在合成氨过程中,需要不断分离出氨,可能的原因为。
工业用氨催化氧化制取硝酸尾气中,氮氧化物是造成大气污染的主要污染源之一。常用的处理方法有选择性催化还原法。NH3在固态FeTiOx表面还原NO的机理如图所示。

(3)理论上处理1molNO同时消耗O2的物质的量为。
(4)若工业尾气中同时含SO2 , 将会使NO的去除率下降,可能的原因是。
ClO2氧化吸收NO法。将含NO尾气通入ClO2溶液中,ClO2能将NO氧化为NO2 , NO2溶于水反应生成HNO2和HNO3.研究发现,吸收后尾气无NO,但随着ClO2浓度增大吸收后尾气中NO2增多。
(5)可能原因是ClO2降低了NO2在水中的溶解度,请设计实验进行验证。
-
6、
金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:
在一定温度下,氧化铁可以与一氧化碳发生如下反应:Fe2O3+3CO2Fe+3CO2 , 已知该反应在不同温度下的平衡常数如下表:
温度/℃
1000
1150
1300
平衡常数
64.0
50.7
42.9
回答下列问题:
(1)该反应的平衡常数表达式K=________,△H________0(填“>”,“<”或“=”)。
(2)欲提高及应中CO的平衡转化率,可采取的措施是_______。
A. 减少Fe的量 B. 加入合适的催化剂 C. 增大容器的体积 D. 降低反应的温度 (3)在一个容积为1L的密闭容器中,1000℃时加入Fe2O3、CO各2mol,反应经过10min后达到平衡。则10min内平均反应速率v(CO)=________mol/(L·min)。
金属可用于还原废水中的Cr(Ⅵ),其他条件相同时,用相同物质的量的Zn粉、Zn-Cu粉分别处理pH=2.5的含Cr(Ⅵ)废水,废水中Cr(Ⅵ)残留率随时间的变化如图所示。

(4)图中加Zn-Cu粉,其对应的实验方法处理含Cr(Ⅵ)废水的效果比图中a更好,其原因是________。
Fe-Ag金属复合材料可将酸性水体中的转化为和N2 , 其反应历程如题图15图2所示(吸附在金属复合材料表面的物种用*标注)。

(5)图中的去除机理可描述为________。
-
7、电化学原理在探究物质性质和实际生产中应用广泛,据此回答下列问题。(1)、通过SO2传感器可监测大气中SO2的含量,其工作原理如图所示。
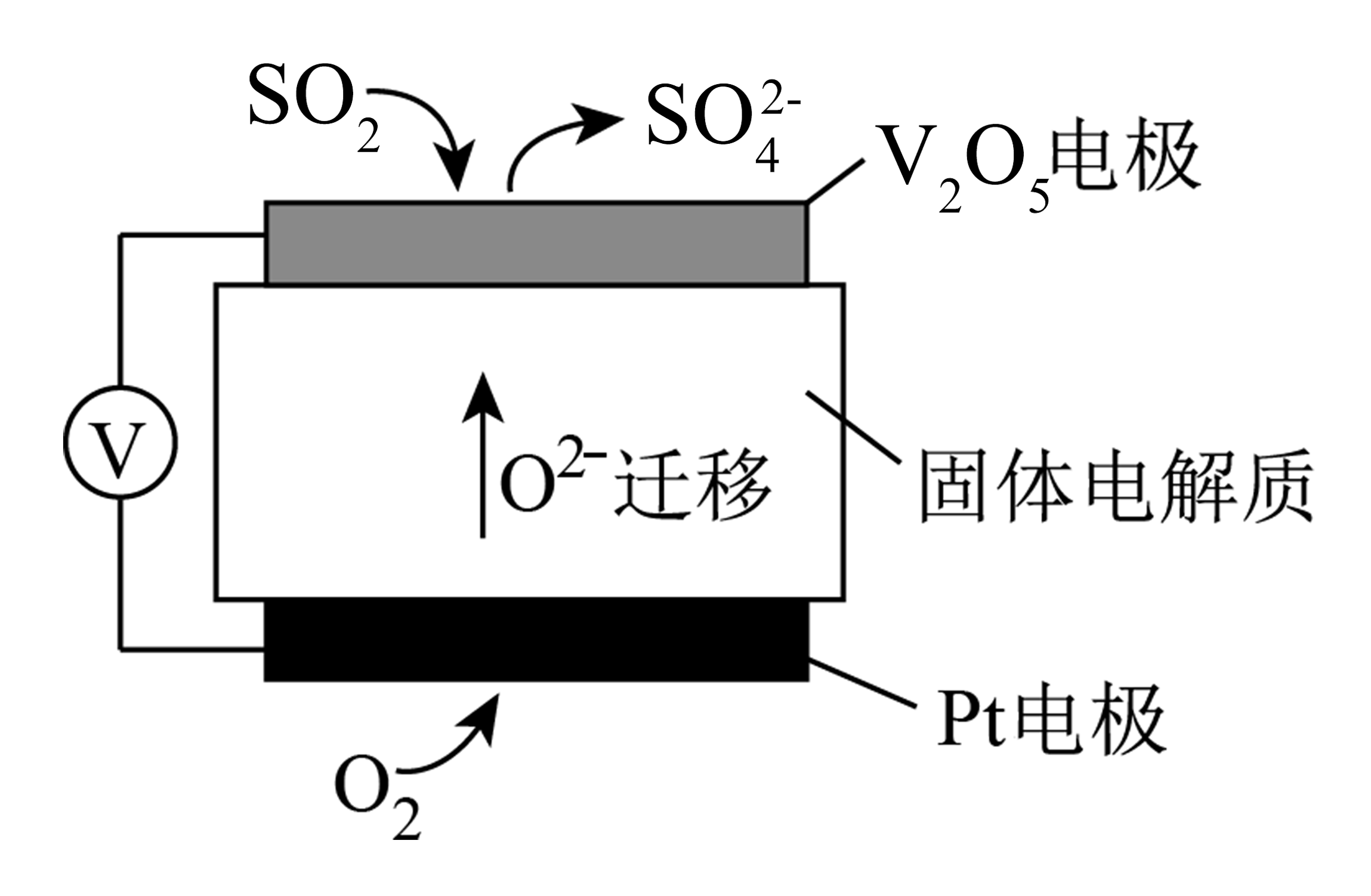
①固体电解质中O2-向极移动(填“正”或“负”)。
②发生在V2O5电极的电极反应式:。
(2)、人工光合系统装置,如图所示,可实现以CO2和H2O合成CH4。下列说法不正确的是_____。 A、该过程是将太阳能转化为化学能的过程 B、电池工作时,H+向Cu电极科动 C、GaN电极表面的电极反应式为2H2O-4e-=O2↑+4H+ D、反应CO2+2H2OCH4+2O2中每消耗1molCO2转移4mole-(3)、某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
A、该过程是将太阳能转化为化学能的过程 B、电池工作时,H+向Cu电极科动 C、GaN电极表面的电极反应式为2H2O-4e-=O2↑+4H+ D、反应CO2+2H2OCH4+2O2中每消耗1molCO2转移4mole-(3)、某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
为防止金属Fe被腐蚀,可以采用下列(填装置序号)装置进行防护;装置③中总反应的离子方程式为。
(4)、电镀在工业上有广泛的应用,可以镀锌、镀铜、镀金等。利用如图所示装置可以将铜牌变为银牌,即在铜牌表面电镀一层银,该电解池的阳极反应可表示为。 (5)、已知存在反应:2+2H+=+H2O。用如图装置,以石墨作电极电解Na2CrO4溶液制备Na2Cr2O7溶液其转化原理可描述为。
(5)、已知存在反应:2+2H+=+H2O。用如图装置,以石墨作电极电解Na2CrO4溶液制备Na2Cr2O7溶液其转化原理可描述为。
-
8、乙醛酸是一种重要的化工中间体,可用如下图所示的电化学装置合成。图中的双极膜中间层中的解离为和 , 并在直流电场作用下分别向两极迁移。下列说法正确的是
 A、在上述电化学合成过程中只起电解质的作用 B、阳极上的反应式为:
A、在上述电化学合成过程中只起电解质的作用 B、阳极上的反应式为: +2H++2e-=
+2H++2e-= +H2O
C、制得乙醛酸,理论上外电路中迁移了电子
D、双极膜中间层中的在外电场作用下向铅电极方向迁移
+H2O
C、制得乙醛酸,理论上外电路中迁移了电子
D、双极膜中间层中的在外电场作用下向铅电极方向迁移
-
9、与下列图示相关的说法正确的是
 A、图甲表示某温度下,在2L密闭容器内发生反应Y(g)2Z(g)时,n(Y)和n(Z)随时间变化的情况,该图说明前10s内,反应速率v(Y)=0.079mol/(L·s) B、图乙表示2mL2mol/LKMnO4酸性溶液与5mL2mol/LH2C2O4溶液混合时,n(Mn2+)随时间变化的情况。该图说明生成的Mn2+一定对该反应有催化作用 C、图丙表示反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0在恒容密闭容器中,其他条件相同时,仅改变反应温度,n(CH3OH)随时间的变化,说明K1>K2 D、图丁是某恒愠密闭容器中反应BaCO3(s)BaO(s)+CO2(g)达到平衡后,tl时刻压缩容器体积,CO2的物质的量浓度随时间的变化
A、图甲表示某温度下,在2L密闭容器内发生反应Y(g)2Z(g)时,n(Y)和n(Z)随时间变化的情况,该图说明前10s内,反应速率v(Y)=0.079mol/(L·s) B、图乙表示2mL2mol/LKMnO4酸性溶液与5mL2mol/LH2C2O4溶液混合时,n(Mn2+)随时间变化的情况。该图说明生成的Mn2+一定对该反应有催化作用 C、图丙表示反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0在恒容密闭容器中,其他条件相同时,仅改变反应温度,n(CH3OH)随时间的变化,说明K1>K2 D、图丁是某恒愠密闭容器中反应BaCO3(s)BaO(s)+CO2(g)达到平衡后,tl时刻压缩容器体积,CO2的物质的量浓度随时间的变化 -
10、一定温度下,向2.0L的恒容密闭容器中充入1.6molCO、1.6molNO,发生反应2NO(g)+2CO(g)═N2(g)+2CO2(g),经过一段时间后达平衡。反应进行到不同时间测得n(CO)如表所示:
t/s
0
5
10
15
20
n(CO)/mol
1.6
1.4
0.6
0.4
0.4
下列说法正确的是
A、反应在前5s的平均速率为v(N2)=0.02mol•L-1 B、保持其他条件不变,降低温度,平衡时c(CO)=0.15mol•L-1 , 则反应的△H>0 C、相同温度下,起始时向容器中充入1.6molN2和3.2molCO2 , 达到平衡时,则此反应的化学平衡常数为67.5 D、相同温度下,起始时向容器中充入1.6molCO、1.6molNO、1.2molN2、2.4molCO2 , 达到平衡前v正<v逆 -
11、下列实验操作合理或能达到实验目的的是


A.测定中和反应的反应热
B.构成锌铜原电池


C.离子交换膜为阳离子交换膜
D.用于粗铜的电解精炼
A、A B、B C、C D、D -
12、阅读下列材料,完成下面小题。
NH3是重要的化工原料。工业合成氨,关乎到世界化工发展与粮食的安全,对其研究意义重大。自由能△G(单位kJ·mol-1)可用于判断一定温度下反应的自发性,△G<0能自发,△G=△H-T△S。工业合成氨的反应为:N2(g)+3H2(g)2NH3(g)在298K时以反应的△H=-92.3kJ/mol,△S=-200J/(K·mol)。实验研究表明,在用铁触媒作催化剂的条件下,合成氨反应速率与反应的物质的浓度关系为v=kcα(N2)dβ(H2)cγ(NH3),k是速率常数。
(1)、工业合成氨的反应为:N2(g)+3H2(g)2NH3(g),下列说法不正确的是A、在298K时,该反应能自发进行 B、合成氨反应活化能较大,需要外界提供能量才能发生 C、温度升高,使用铁触媒,反成物活化分子百分数增大,反应速率加快 D、升高温度该反应v(正)增大,v(逆)减小,平衡向逆反应方向移动(2)、某合成氨速率方程为v=kcα(N2)cβ(H2)cγ(NH3),k是速率常数,根据表中数据分析,下列数值正确的是实验
c(N2)/mol/L
c(H2)/mol/L
c(NH3)/mol/L
v/mol/(L·s)
1
m
n
p
q
2
2m
n
p
2q
3
m
n
0.1p
10q
4
m
2n
p
2.828q
A、α=1、β=1.5、γ=-l B、α=1、β=3、γ=2 C、α=2、β=1.5、γ=l D、α=2、β=3、γ=-l(3)、工业合成氨的反应为N2(g)+3H2(g)2NH3(g),中科院科研团队研制出“TM-LiH(TM表示过渡金属)”双活性中心催化剂体系,实现了传统金属催化剂在温和条件下的合成氨的性能,其原理如图(*表示催化剂的活性位点),下列分析不合理的是 A、状态Ⅰ表示N2发生吸附并解离N原子占据TM的活性位点 B、状态Ⅱ中反应为N*+LiH=LiNH+*,LiH是还原剂 C、一定温度和压强条件下使用“TM—LiH”可以提高氨的平衡转化率 D、“TM-LiH”不能改变合成氨反应的炫变但可以加快反应的速率
A、状态Ⅰ表示N2发生吸附并解离N原子占据TM的活性位点 B、状态Ⅱ中反应为N*+LiH=LiNH+*,LiH是还原剂 C、一定温度和压强条件下使用“TM—LiH”可以提高氨的平衡转化率 D、“TM-LiH”不能改变合成氨反应的炫变但可以加快反应的速率 -
13、下列化学反应表示正确的是A、铅蓄电池放电时的负极反应式为;Pb-2e-=Pb2+ B、已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol C、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4kJ/mol,则0.5L1mol/L的氨水与足量稀盐酸完全中和,放出的热量大于28.7 kJ D、以硫酸为电解质,通过催化电解可将N2转化为N2H4的阴极反应:N2+4H++4e-=N2H4
-
14、利用甲烷可以除去SO3 , 反应为8SO3(g)+6CH4(g)S8(g)+6CO2(g)+12H2O(g)。下列说法正确的是A、上述反应的△S<0 B、上述反应的化学平衡常数K= C、及时分离出H2O(g),正反应速率增大,平衡向正反应方向移动 D、上述反应中生成1molS8 , 转移电子的数目约为48×6.02×1023
-
15、全世界每年钢铁因锈蚀造成大量的损失,某城市拟用如图所示方法保护埋在弱碱性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是
 A、钢质管道易被腐蚀是因为在潮湿的土壤中形成了原电池 B、这种方法称为牺牲阳极的阴极保护法 C、钢管上的电极反应式:O2+2H2O+4e-=4OH- D、也可用外接直流电源保护钢管,直流电源负极连接金属棒X
A、钢质管道易被腐蚀是因为在潮湿的土壤中形成了原电池 B、这种方法称为牺牲阳极的阴极保护法 C、钢管上的电极反应式:O2+2H2O+4e-=4OH- D、也可用外接直流电源保护钢管,直流电源负极连接金属棒X -
16、下列事实不能用勒夏特列原理解释的是A、工业上生产硫酸时,充入过量的空气以提高SO2的转化率 B、对CO(g)+NO2(g)CO2(g)+NO(g),达到平衡后,增大压强可使颜色变深 C、实验室可用排饱和食盐水的方法收集氯气 D、溴水中有化学平衡Br2+H2OHBr+HBrO,当加入少量AgNO3溶液后,溶液的颜色变浅
-
17、“碳达峰、碳中和”是我国社会发展重大战略之一。与经催化重整可制得CO和 , 相关反应为:
主反应:
副反应:Ⅰ.
Ⅱ.
Ⅲ.
Ⅳ.
其中,副反应Ⅱ、Ⅲ、Ⅳ形成的积碳易导致催化剂活性降低。
(1)、主反应的。(2)、的还原能力(R)可衡量转化效率,(同一时段内与的物质的量变化量之比)。常压下,将和按物质的量之比1:3投料,反应相同时间,和的转化率随温度变化如图所示。
①的转化率在800℃时远大于400℃时的原因是。
②400~600℃时,R值的变化情况为。
③1000℃时R值为(写出计算过程)。
(3)、在Pt-Ni合金或Sn-Ni合金催化下脱氢反应历程与相对能量关系如图所示(*表示吸附在催化剂表面的物质)。
从化学反应速率角度分析,脱氢反应选择的催化剂为(填“Pt-Ni合金”或“Sn-Ni合金”),理由是。
(4)、催化与重整反应的路径甲和乙如图所示。研究表明,在催化剂中掺入可产生更多的氧空位,生成更多的可流动 , 能有效减少催化剂的积碳生成。①路径甲、乙中生成的不同中间产物为(填化学式)。
②反应路径中,减少催化剂积碳的反应为。

-
18、亚硝酰硫酸(NOSO4H)是有机合成中的常见试剂,常用于制造医药和染料。(1)、NOHSO4晶体是由NO+和硫酸氢根两种离子构成,NOHSO4易溶解在浓硫酸中,溶于水时会生成H2SO4、HNO3和NO。
①写出NOHSO4与水反应的化学方程式。
②每1molNOHSO4与水完全反应时转移电子的物质的量为。
(2)、实验室可以用如图所示装置制取亚硝酰硫酸溶液。装置Ⅰ制取SO2 , 装置Ⅲ用于制取亚硝酰硫酸。
①质量分数为70%,其密度为1.6g/cm-3的硫酸的物质的量浓度为mol/L(结果保留1位小数)。
②装置Ⅲ中使用20℃的冷水浴可以防止HNO3分解。若不使用冷水浴,实验中可观察到的现象是。
③碱石灰的作用。
(3)、可通过如下实验测定所得亚硝酰硫酸固体样品的质量分数。步骤Ⅰ:称取0.400g亚硝酰硫酸样品于锥形瓶中,加入22mL0.1000mol/LKMnO4溶液和少量稀硫酸,充分反应后溶液为紫红色;
步骤Ⅱ:向步骤Ⅰ所得溶液中滴加0.1000mol/LNa2C2O4标准溶液与过量的KMnO4溶液反应,恰好完全应时消耗Na2C2O4标准溶液25mL。滴定过程中发生反应:2+5+16H+=2Mn2++10CO2↑+8H2O。
①步骤Ⅰ反应后有Mn2+和等生成。写出NO+所发生反应的离子方程式:。
②计算亚硝酰硫酸样品的纯度(写出计算过程)。
-
19、铝是应用广泛的金属。以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)、“碱溶”时生成四羟基合铝酸钠Na[Al(OH)4]的离子方程式为。(2)、向“过滤所得滤液中加入NaHCO3溶液,生成Na2CO3和Al(OH)3 , 加入NaHCO3后溶液的pH(填“增大”、“不变”或“减小”)。已知:pH=-1gc(H+)。(3)、“电解”是电解熔融Al2O3 , 电解过程中作阳极的石墨易消耗,原因是。(4)、“电解”是电解Na2CO3溶液,原理如图所示。①阳极的电极反应式为 , ②阴极产生的物质A的化学式为。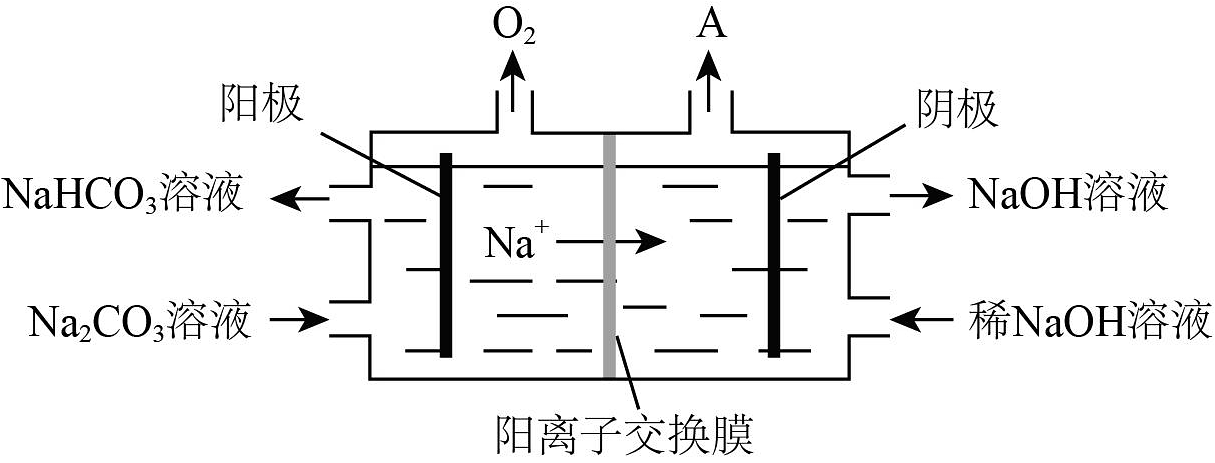 (5)、铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是。
(5)、铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是。 -
20、以软锰矿浆(主要成分MnO2 , 杂质为Fe、Al等元素的氧化物)和烟气(含有SO2、O2等)为原料可制备Mn2O3。(1)、向一定量软锰矿浆中匀速通入烟气,软锰矿浆能吸收烟气中SO2生成MnSO4 , 测得溶液中c(H2SO4)、c(MnSO4)随时间的变化如图所示。

随着吸收时间增加,溶液中c(H2SO4)的增加呈现由慢到快的趋势,其主要原因是。
(2)、常温下,向吸收后的混合溶液中增加c(H+)为1×10-10mol/L的氨水进行除杂。已知Kb(NH3·H2O)=1.8×10-5 , 该氨水的浓度为Y。(3)、向除杂后的溶液中加入NH4HCO3溶液,反应生成MnCO3沉淀。①该过程的离子方程式是。
②将过滤得到的滤液蒸发浓缩、冷却结晶,可得到的晶体为(填化学式)。
③在氧气气氛中加热分解MnCO3 , 测得加热升温过程中固体的质量变化如图所示。加热分解MnCO3制备Mn2O3 , 需要控制的温度为。
